EVALUATION OF STIMULATING EFFECT OF MAGNETIC AND ELECTROMAGNETIC FIELDS OF INFRARED WAVE RANGE THROUGH THE ZONE OF BIOLOGICALLY ACTIVE POINTS RESPONSIBLE FOR HEMATOPOIESIS ON MYELOBLASTIC BLOOD FORMING IN CATTLE
EVALUATION OF STIMULATING EFFECT OF MAGNETIC AND ELECTROMAGNETIC FIELDS OF INFRARED WAVE RANGE THROUGH THE ZONE OF BIOLOGICALLY ACTIVE POINTS RESPONSIBLE FOR HEMATOPOIESIS ON MYELOBLASTIC BLOOD FORMING IN CATTLE
Abstract
In modern veterinary medicine, synthetic immunostimulants are mainly used to improve animal immunity, the application of which is often complicated by side effects and prevents the production of environmentally friendly livestock products. Various quantum radiations, magnetic and electromagnetic fields and their combinations can be used both as an independent method of prevention and treatment of animals in various pathologies, and in combination with drugs. The aim of the study was to evaluate the stimulating effect of magnetic and electromagnetic fields of infrared wave range through the zone of biologically active points responsible for hematopoiesis on myeloblastic blood forming in cattle. The experiment was conducted in 2024 on the basis of Parvatkin A.V. IE PFE, Kochkurovsky district, Sabaevo viillage RM, SBI ‘Mordovian Republican Animal Disease Control Station’ and scientific laboratory of the Department of Morphology, Physiology and Veterinary Pathology of the Agrarian Institute of FSEI of HPE ‘MSU named after N.P. Ogaryov’ on red-and-white heifers, aged 2 months, live weight 85–90 kg, clinically healthy, from which two groups (control and experimental groups) of 20 animals each were formed according to the principle of analogues. Animals of the experimental group were irradiated 2 times a day for 10 days (average period of sessions of quantum therapy) in the area of BAP (biologically active points) responsible for hematopoiesis by magnetic and electromagnetic fields of quantum radiation of infrared wavelength range by the device ‘Edma’ by contact method for 10 minutes. The conducted studies allowed to establish that after local exposure to magnetic and electromagnetic fields of infrared wavelength range through the zone of biologically active points responsible for hematopoiesis in cattle red bone marrow there was a pronounced stimulation of cytosis of all directions of differentiation of cells of myeloblastic sprout of hematopoiesis, especially pronounced on the 10th day of the experiment, which indicates the stimulating effect of magnetic and electromagnetic fields of quantum radiation of infrared wavelength range.
1. Введение
Гемопоэз (кроветворение) – процесс образования, развития и созревания клеток крови в кроветворных органах. Миелопоэз – это часть процессов гемопоэза, заключающаяся в регулируемом образовании миелоидных клеток в костном мозге , , , .
Миелоидные клетки являются мощными модуляторами иммунного ответа и представляют собой физиологические механизмы иммунного контроля , , .
В современной ветеринарной медицине для повышения иммунитета животных в основном применяются синтетические иммуностимуляторы. Их использование часто осложняется побочными эффектами и не дает производить экологически чистую животноводческую продукцию , , .
Разнообразные квантовые излучения, магнитные и электромагнитные поля и их сочетания можно использовать в виде альтернативного метода фармакотерапии при лечении различных патологий животных. Также методы фотоэлектротерапии можно сочетать и комбинировать с общепринятыми методами лечения патологий , .
1.1. Актуальность
В настоящее время в ветеринарной медицине становятся все более востребованными методы регуляторного воздействия магнитных, электромагнитных полей и квантовых излучений различного спектрального состава на системы органов животных, что объясняется многократно подтвержденными фактом их выраженного влияния на гомеостаз и функции живых организмов.
Целью настоящей работы являлась оценка стимулирующего влияния воздействия магнитных и электромагнитных полей инфракрасного диапазона волн через зону биологически активных точек, отвечающих за кроветворение на миелобластический росток кроветворения у крупного рогатого скота.
2. Методы и принципы исследования
Для практического применения в ветеринарной медицине рекомендуется комбинированный прибор «Эдма». Он портативный, удобен для работы в ветеринарии и оказывает на организм животных комплексное воздействие электромагнитными, с низкоэнергетическим постоянным и низкочастотным переменными магнитными полями в сочетании с малоинтенсивным инфракрасным излучением. Сочетанные излучения данного аппарата улучшают микроциркуляция крови, обменные процессы в тканях и оказывают воздействующий тонус на нервные окончания на месте воздействия, активизируя гормональные и иммунные системы саморегуляции.
Эксперимент проводился в 2024 году на базе ИП КФХ Парваткина А.В. Кочкуровского района с. Сабаево РМ, ГБУ «Мордовская республиканская станция по борьбе с болезнями животных» и научной лаборатории кафедры морфологии, физиологии и ветеринарной патологии Аграрного института ФГОУ ВО «МГУ им. Н.П. Огарёва» на телочках красно-пестрой породы, в возрасте 2 месяца, живой массой 85-90 кг, клинически здоровых, из которых по принципу аналогов сформировали две группы (контрольную и опытную группы) по 20 голов в каждой. Животным опытной группы 2 раза в сутки в течение 10 дней (средний срок сеансов квантовой терапии) проводили облучение области БАТ (биологически активных точек), отвечающих за кроветворение (область лопатки с левой стороны) магнитными и электромагнитными полями квантового излучения и инфракрасного диапазона волн прибором «Эдма» контактным методом в течение 10-ти минут. Условия кормления и содержания у животных контрольной и опытной групп были одинаковыми.
В течение месяца после окончания сеансов квантовой терапии наблюдали за клиническим состоянием животных контрольной и опытной групп и отбирали для исследования красный костный мозг из грудины на 3-и, 10-е и 30-е сутки после окончания сеансов фотоэлектротерапии. Из отобранных для исследований образцов пунктата красного костного мозга делали мазки, окрашивали их азур-эозином по Романовскому и исследовали под микроскопом. Процентное соотношение клеток в костномозговом пунктате (миелограмму) выводили на основании подсчета 1000 клеток в наиболее тонкой части мазка. Микроскопическое исследования взятого пунктата позволила оценить количество и качество различных типов клеток красного костного мозга. Статистическую обработку цифровых данных проводили на компьютере IBM PC с помощью программы STAT (Торопов В.Л., 1993). Достоверность полученных данных определяли по Стъюденту. Данные считались достоверными при р≤0,05.
3. Основные результаты
Установлено, что на момент проведения эксперимента и во все сроки исследований клинический статус телочек был в пределах физиологической нормы, свойственного данному виду животных. Данные, полученные в результате эксперимента статистически обработанны и представлены в таблице 1. В таблице 1 и далее по тексту сокращение Н означает клетки нейтрофильного ряда миелобластического ростка кроветворения. В таблице 1 и далее по тексту сокращение Э означает клетки эозинофильного ряда миелобластического ростка кроветворения.
Таблица 1 - Корреляция цитоза клеток миелобластического ряда у крупного рогатого скота после локального воздействия магнитными и электромагнитными полями квантового излучения и инфракрасного диапазона волн на БАТ
№ п/п | Показа-тели | Перед постанов-кой опыта | Сроки исследования | |||||
3-и сутки | 10-е сутки | 30-е сутки | ||||||
контроль | опыт | контроль | опыт | контроль | опыт | |||
1. | Миело-бласты | 0,21±0,33 | 0,22±0,25 | 0,37±0,05 | 0,20±0,30 | 0,57±0,55 | 0,21±0,25 | 0,45±0,03 |
2. | Промие-лоциты Н | 3,56±0,30 | 3,54±0,30 | 3,64±0,25* | 3,56±0,25 | 4,47±0,03 | 3,55±0,30 | 4,33±0,25* |
3. | Миело-циты Н | 1,37±0,01 | 1,38±0,01 | 1,73±0,03* | 1,37±0,35 | 2,50±0,03 | 1,42±0,01 | 2,07±0,15* |
4. | Метамиелоциты Н (юные) | 5,20±0,18 | 5,20±0,25 | 5,35±0,20* | 5,20±0,20 | 5,67±0,20* | 4,80±0,18 | 5,07±0,16* |
5. | Палочко-ядер-ные Н | 4,83±1,05 | 4,83±1,01 | 5,03±1,05* | 4,92±1,05 | 6,65±0,03 | 5,01±0,75 | 5,53±0,06 |
6 | Сегмен-тоядер-ные Н | 10,07±0,65 | 10,10±0,75 | 12,96±0,70* | 10,12±0,65 | 13,45±0,60* | 10,40±0,65 | 13,0±0,62* |
Всего нейтрофилов | 25,24±0,35 | 25,27±0,25 | 29,08±0,30* | 25,37±0,35 | 33,31±0,40* | 25,39±0,35 | 30,45±0,40* | |
7. | Про- и миелоци-ты Э | 0,65±0,03 | 0,65±0,75 | 0,72±0,03 | 0,64±0,35 | 0,85±0,04 | 0,65±0,22 | 0,70±0,15 |
8. | Метамиелоциты Э | 1,26±0,30 | 1,26±0,75 | 2,75±0,05 | 1,34±0,30 | 3,37±0,25* | 1,36±0,30 | 2,77±0,30* |
9. | Палочкоядерные Э | 1,05±0,95 | 1,10±0,86 | 1,90±0,90* | 1,25±0,95 | 2,45±0,92* | 1,34±0,75 | 1,83±0,80* |
10. | Сегментоядерные Э | 1,95±0,15 | 1,90±0,15 | 2,80±0,03 | 1,94±0,25 | 3,12±0,20* | 1,95±0,75 | 2,65±0,01 |
Всего эозинофилов | 4,91±0,05 | 4,91±0,07 | 8,17±0,10* | 5,17±0,05 | 9,79±0,07* | 5,30±0,33 | 7,95±0,58 | |
11. | Базофи-лы | 1,75±0,08 | 1,82±0,02 | 9,15±0,06* | 3,75±0,08 | 9,93±0,12* | 4,02±0,04 | 8,50±0,06* |
Итого по миелобл. ряду | 31,90±0,35 | 32,0±0,42 | 46,40±0,40* | 34,29±0,35 | 53,03±0,30* | 34,71±0,25 | 46,90±0,30* | |
Примечание: здесь знаком* обозначены случаи достоверных отличий исследованных показателей подопытных животных, по сравнению с контрольными (при р≤0,05).
Анализируя данные полученные в ходе эксперимента, статистически обработаные, представленные в таблице 1, и сравнивая их с контрольными цифрами, видно, что:
- перед постановкой опыта количество миелобластов было 0,21±0,33, промиелоцитов Н 3,56±0,30, миелоцитов Н 1,37±0,01, метамиелоцитов Н 5,20±0,18, палочкоядерных Н 4,83±1,05, сегментоядерных Н 10,07±0,65, всего нейтрофилов 25,24±0,35, про-и миелоцитов Э 0,65±0,03; метамиелоцитов Э 1,26±0,30, палочкоядерных Э 1,95±015, сегментоядерных Э 1,95±0,15, всего эозинофилов 4,91±0,05, базофилов 1,75±0,08, итого клеток по миелобластическому ряду 31,90±0,35 %.
- на 3-и сутки эксперимента количество миелобластов у животных контрольной группы увеличилось до 0,22±0,25%, у телочек опытной группы до 0,37±0,05%; на 10-е сутки у животных контрольной группы понизилось до 0,20±0,30%, а у телочек опытной группы продолжало увеличиваться и было равным 0,57 ±0,55%, а к 30-м суткам у животных контрольной группы составляло 0,21±0,25%, а у телочек опытной группы уменьшилось до 0,45 ±0,03%;
- на 3-и сутки эксперимента количество промиелоцитов Н у животных контрольной группы было равным 3,54±0,30%, у телочек опытной группы повысилось до 3,64±0,25% (изменения достоверны); на 10-е сутки у животных контрольной группы почти не изменилось и было равным 3,56±0,25%, а у телочек опытной группы продолжало увеличиваться и было равным 4,47±0,03%, а к 30-м суткам у животных контрольной группы оставалось примерно на таком же уровне и составляло 3,55±0,30%, у телочек опытной группы немного уменьшилось до 4,33±0,25% (изменения достоверны);
- на 3-и сутки эксперимента количество миелоцитов Н у животных контрольной группы было равно 1,38±0,01%, у телочек опытной группы повысилось до 1,73±0,03%; на 10-е сутки у животных контрольной группы оставалось на прежнем уровне и было равным 1,37±0,35%, а у телочек опытной группы продолжало увеличиваться и было равным 2,50±0,03%, а к 30-м суткам у животных контрольной группы немного повысилось до 1,42±0,01%, а у телочек опытной группы уменьшилось до 2,07±0,15% причем данные, полученные на 3-и и 30-е сутки исследований у животных опытной группы были достоверны;
- на 3-и сутки эксперимента количество метамиелоцитов Н у животных контрольной группы было равно 5,20±0,25%, у телочек опытной группы повысилось до 5,35±0,20%; на 10-е сутки у животных контрольной группы оставалось на прежнем уровне и было равным 5,20±0,20%, а у телочек опытной группы продолжало увеличиваться и было равным 5,67±0,20%, а к 30-м суткам у животных контрольной группы понизилось до 4,80±0,18%, и у телочек опытной группы уменьшилось до 5,07±0,16% причем данные, полученные на 3-и, 10-е и 30-е сутки исследований у животных опытной группы были достоверны;
- на 3-и сутки эксперимента количество палочкоядерных Н у животных контрольной группы было равно 4,83±1,01%, у телочек опытной группы повысилось до 5,03±1,05%; на 10-е сутки у животных контрольной группы немного повысилось и было равным 4,92±1,05%, и у телочек опытной группы продолжало увеличиваться и было равным 6,65±0,03%, а к 30-м суткам у животных контрольной группы немного повысилось до 5,01±0,75%, а у телочек опытной группы уменьшилось до 5,53±0,06% причем данные, полученные на 3-и сутки исследований у животных опытной группы были достоверны;
- на 3-и сутки эксперимента количество сегментоядерных Н у животных контрольной группы было равно 10,10±0,75%, у телочек опытной группы повысилось до 12,96±0,70%; на 10-е сутки у животных контрольной группы было равно 10,12±0,65%, а у телочек опытной группы продолжало увеличиваться и было равным 13,45±0,60%, а к 30-м суткам у животных контрольной группы немного повысилось до 10,40±0,65%, а у телочек опытной группы немного понизилось до 13,0±0,62% причем данные, полученные на 3-и и 30-е сутки исследований у животных опытной группы были достоверны;
- общее количество клеток нейтрофильного ряда миелобластическтго ростка кроветворения после воздействия на БАТ магнитными и электромагнитными полями квантового излучения и инфракрасного диапазона волн прибором «Эдма» контактным методом на 3-и сутки исследований у животных контрольной группы было равно 25,27±0,25%, у телочек опытной группы повысилось до 29,08±0,30%; на 10-е сутки у животных контрольной группы оставалось на прежнем уровне и было равным 25,37±0,35%, а у телочек опытной группы продолжало увеличиваться и было равным 33,31±0,40%, а к 30-м суткам у животных контрольной группы оставалось на прежнем уровне и было равным 25,39±0,35%, а у телочек опытной группы немного понизилось от прежних значений и составляло 30,45±0,40% причем данные, полученные на 3-и, 10-е и 30-е сутки исследований у животных опытной группы были достоверны;
- на 3-и сутки эксперимента количество про- и миелоцитов Э у животных контрольной группы было равно 0,65±0,75%, у телочек опытной группы повысилось до 0,72±0,03%; на 10-е сутки у животных контрольной группы оставалось на прежнем уровне и было равным 0,64±0,35%, а у телочек опытной группы продолжало увеличиваться и было равным 0,85±0,04%, а к 30-м суткам у животных контрольной группы оставалось практически на прежнем уровне и составляло 0,65±0,22%, а у телочек опытной группы уменьшилось до 0,70±0,15%;
- на 3-и сутки эксперимента количество метамиелоцитов Э у животных контрольной группы было равно 1,26±0,75%, у телочек опытной группы повысилось до 2,75±0,05%; на 10-е сутки у животных контрольной группы немного повысилось и было равным 1,34±0,30%, а у телочек опытной группы продолжало увеличиваться и было равным 3,37±0,25%, к 30-м суткам у животных контрольной группы процент этих клеток немного повысился до 1,36±0,30%, а у телочек опытной группы уменьшился до 2,77±0,30% причем данные, полученные на 10-е и 30-е сутки исследований у животных опытной группы были достоверны;
- на 3-и сутки эксперимента количество палочкоядерных Э у животных контрольной группы было равно 1,10±0,86%, у телочек опытной группы повысилось до 1,90±0,90%; на 10-е сутки у животных контрольной группы немного повысилось до1,25±0,95%, а у телочек опытной группы продолжало увеличиваться и было равным 2,45±0,92%, а к 30-м суткам у животных контрольной группы немного повысилось до 1,34±0,75%, а у телочек опытной группы уменьшилось до 1,83±0,80% причем данные, полученные на 3-и, 10-е и 30-е сутки исследований у животных опытной группы были достоверны;
- на 3-и сутки эксперимента количество сегментоядерных Э у животных контрольной группы было равно 1,90±0,15%, у телочек опытной группы повысилось до 2,80±0,03%; на 10-е сутки у животных контрольной группы повысилось до 1,94±0,25%, а у телочек опытной группы продолжало увеличиваться и было равным 3,12±0,20%, а к 30-м суткам у животных контрольной группы немного повысилось до 1,95±0,75%, а у телочек опытной группы уменьшилось до 2,65±0,01% причем данные, полученные на 10-е сутки исследований у животных опытной группы были достоверны;
- общее количество клеток эозинофильного ряда миелобластическтго ростка кроветворения после воздействия на БАТ магнитными и электромагнитными полями квантового излучения и инфракрасного диапазона волн прибором «Эдма» контактным методом на 3-и сутки исследований у животных контрольной группы было равно 4,91±0,07%, у телочек опытной группы повысилось до 8,17±0,10%; на 10-е сутки у животных контрольной группы повысилось до 5,17±0,05%, а у телочек опытной группы увеличилось до 9,79±0,07%, а к 30-м суткам у животных контрольной группы немного повысилось до 5,30±0,33%, а у телочек опытной группы уменьшилось до 7,95±0,58% причем данные, полученные на 10-е сутки исследований у животных опытной группы были достоверны;
- на 3-и сутки эксперимента количество базофилов у животных контрольной группы было равно 1,82±0,02%, у телочек опытной группы повысилось до 9,15±0,06%; на 10-е сутки у животных контрольной группы повысилось до 3,75±0,08%, а у телочек опытной группы продолжало увеличиваться и было равным 9,93±0,12%, а к 30-м суткам у животных контрольной группы повысилось до 4,02±0,04%, а у телочек опытной группы уменьшилось до 8,50±0,06% причем данные, полученные на 3-и, 10-е и 30-е сутки исследований у животных опытной группы были достоверны.
Таким образом, общее количество клеток миелобластического ростка кроветворения красного костного мозга у животных контрольной группы составляло на 3-и сутки исследований 32,0±0,42%, на 10-е 34,29±0,35%, на 30-е 34,71±0,25%, после воздействия на БАТ магнитными и электромагнитными полями квантового излучения и инфракрасного диапазона волн прибором «Эдма» контактным методом у животных опытной группы на 3-и сутки исследований увеличилось до 46,40±0,40%, на 10-е до 53,03±0,30%, к 30 суткам уменьшилось до 46,90 ±0,30%, причем данные, полученные во все сроки исследований были достоверны.
4. Обсуждение
Кроветворение подчиняется сложной регуляции, которое обеспечивает изменение количества и качества кровяных клеток в соответствии с потребностями организма , , , .
В процессе течения реакций, обусловленных воздействием на БАТ, большую роль играет высвобождение депонированных биологически активных веществ в организме и воздействие на них обусловлено действием на экстро- и интеррецепторы сосудов и оболочек нервов, коррелирующих системы внутренних органов. Эффекты, вызванные воздействием на БАТ, приводят к сложным рефлекторным ответам, которые могут проявляться в виде стимуляции, торможении и усиления собственных защитных механизмов (принцип работы: БАТ↔орган-мишень). Возможность БАТ воспринимать электромагнитные виды энергии объясняется наличием в точках сенсорных окончаний .
Для активации гематологических и гемопоэтических показателей у животных рекомендовано воздействовать на БАТ меридиана почек , .
В ходе проведения эксперимента установлено, что локальное облучение магнитными и электромагнитных полями инфракрасного диапазона волн прибором «Эдма» зоны биологически активных точек, отвечающих за кроветворение оказывает сильное стимулирующее воздействие на миелобластический росток кроветворения у крупного рогатого скота. У животных после воздействия в красном костном мозге происходило выраженное увеличение цитоза всех направлений дифференцировки клеток миелобластического ростка кроветворения, которое наиболее отчетливо было выражено на 10 сутки исследования. Далее клеточная реакция миелобластического ростка красного костного мозга на воздействующий фактор несколько снижается.
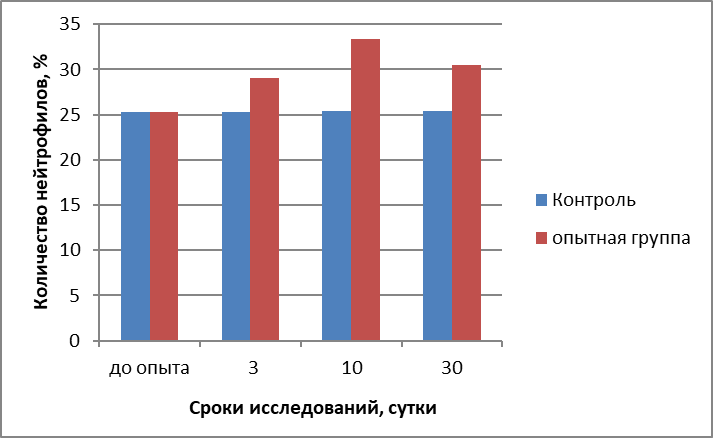
Рисунок 1 - Изменение количества клеток нейтрофильного ряда миелобластического ростка кроветворения красного костного мозга у телочек
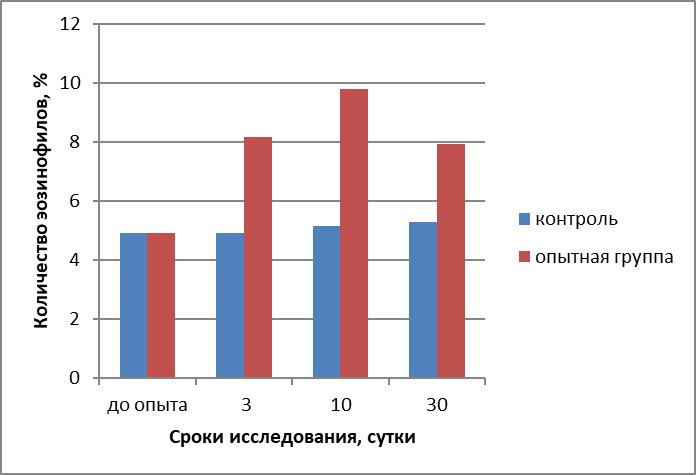
Рисунок 2 - Изменение количества клеток эозинофильного ряда миелобластическтго ростка кроветворения красного костного мозга у телочек
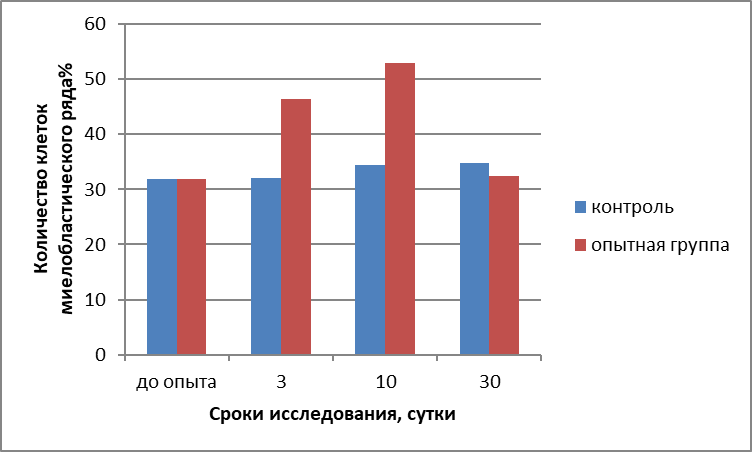
Рисунок 3 - Изменение количества клеток миелобластическтго ростка кроветворения красного костного мозга у телочек
Таким образом, общее количество клеток миелобластического ростка кроветворения красного костного мозга у животных контрольной группы на 3-и сутки исследований было на 0,3% выше, чем у животных до опыта, на 10-е на 7,5%, на 30-е на 8,7%, что объясняется интенсивным онтогенезом, учитывая возраст телочек. После воздействия на БАТ магнитными и электромагнитными полями квантового излучения и инфракрасного диапазона волн прибором «Эдма» контактным методом общее количество клеток миелобластического ростка кроветворения красного костного мозга у животных опытной группы на 3-и сутки исследований было на 45%, на 10-е на 55%, на 30-е на 35,2%, выше, чем у животных контрольной группы в данные сроки исследований, что свидетельствует о стимулирующим воздействии магнитных и электромагнитных полей инфракрасного диапазона волн через зону БАТ, отвечающих за кроветворение на миелобластический росток кроветворения у крупного рогатого скота. Однако к 30 суткам после сеансов фотоэлектротерапии активирующее действие магнитных и электромагнитных полей квантового излучения инфракрасного диапазона волн аппарата «Эдма» через БАТ на миелопоэз животных снижается.
Это приводит к повышению их иммунного статуса и естественной реактивности организма, следовательно, повышается продуктивность таких животных, уменьшается процент выбраковки после переболевания, что согласуется с данными полученными учеными, работавших в этом направлении , , , .
5. Заключение
Проведенные исследования позволили установить, что после локального воздействия магнитных и электромагнитных полей инфракрасного диапазона волн через зону биологически активных точек, отвечающих за кроветворение у крупного рогатого скота в красном костном мозге происходила выраженная стимуляция цитоза всех направлений дифференцировки клеток миелобластического ростка кроветворения особенно выраженная на 10-е сутки эксперимента, что свидетельствует о стимулирующем воздействии магнитных и электромагнитных полей квантового излучения инфракрасного диапазона волн на миелопоэз животных, что приводит к повышению иммунного статуса животных и естественной реактивности организма.
