"THE MALE PILL", INNOVATIVE MALE CONTRACEPTION DRUG PRODUCTS
“THE MALE PILL” – ИННОВАЦИОННЫЕ ЛЕКАРСТВЕННЫЕ СРЕДCТВА МУЖСКОЙ КОНТРАЦЕПЦИИ
Обзорная статья
Гречина А.Г.1, Юсифова А.2, Яшин Д.С.3, Сорокина Ю.А.4, *, Занозина О.В.5, Ловцова Л.В.6
1 ORCID: 0000-0002-8501-2646;
2 ORCID: 0000-0003-2242-9820;
3 ORCID: 0000-0002-7114-8833;
4 ORCID: 0000-0001-8430-237X;
5 ORCID: 0000-0003-1830-3600;
6 ORCID: 0000-0003-1480-183X;
1-6 Приволжский Исследовательский Медицинский Университет, Нижний Новгород, Россия
* Корреспондирующий автор (zwx[at]inbox.ru)
АннотацияВ данной статье обобщены данные различных видах гормональной мужской контрацепции. Авторами проведено сравнение методов доставки препаратов, а также рассмотрен революционный комбинированный пероральный контрацептив для мужчин, представленный в 2018 году и вызвавший колоссальный интерес. Описаны механизмы действия контрацептивных препаратов, сформулирован вывод об эффективности и безопасности инновационного контрацептива и перспективности дальнейших исследований в данной области. Рассмотрен вопрос безопасности, обратимости и эффективности гормональной мужской контрацепции, продемонстрировать целесообразность дальнейших исследований и разработок в данном направлении, а также отметить уже достигнутую эффективность некоторых из них. Обзор имеющихся данных позволяет говорить о значимости вопроса мужской контрацепции на фоне возрастающего запроса соответствующей части популяции фертильного возраста. Как демонстрируют некоторые исследования, беспокойство о возможных побочных эффектах может приводить к их проявлениям в группах испытуемых, получающих плацебо. Это может говорить о сохраняющихся настороженности и недоверии общества к гормональным мужским контрацептивам на фоне неудач предыдущих образцов. Последние разработки демонстрируют многообещающие результаты и находятся на различных стадиях клинических исследований. В частности, рассматриваемый препарат Диметандролона ундеканоат (ДМАУ) успешно проходит все испытания и характеризуется эффективностью, безопасностью, а также полной и быстрой обратимостью действия при прекращении терапии. Такие эффекты достигаются за счет двойного оказываемого действия: андрогенного и прогестагенного эффектов, опосредованных агонистическим действием на рецепторы андрогена и прогестерона, и ассоциированных с откликом соответствующих биологических мишеней. Также ДМАУ имеет дополнительные показания к применению в виде заместительной андрогенной терапии в случаях низких уровней тестостерона у мужчин. На данный момент за счет сохраняющихся сомнений в безопасности и эффективности гормональной контрацепции у мужчин исследования в данном направлении проводятся в ограниченном количестве. Тем не менее наблюдается и рост интереса к данной группе препаратов, все больше мужчин заявляют о своей готовности и заинтересованности в контексте использования препаратов.
Ключевые слова: мужская контрацепция, пероральные контрацептивы, диметандролон ундеканоат, тестостерон, прогестин.
"THE MALE PILL", INNOVATIVE MALE CONTRACEPTION DRUG PRODUCTS
Review article
Grechina A.G.1, Yusifova A.2, Yashin D.S.3, Sorokina Yu.A.4, *, Zanozina O.V.5, Lovtsova L.V.6
1 ORCID: 0000-0002-8501-2646;
2 ORCID: 0000-0003-2242-9820;
3 ORCID: 0000-0002-7114-8833;
4 ORCID: 0000-0001-8430-237X;
5 ORCID: 0000-0003-1830-3600;
6 ORCID: 0000-0003-1480-183X;
1-6 Privolzhsky Research Medical University, Nizhny Novgorod, Russia
* Corresponding author (zwx[at]inbox.ru)
AbstractThe current article summarizes the data on various types of hormonal male contraception. The authors of the study compare the drug delivery methods and consider a revolutionary male combined oral contraceptive, presented in 2018 and met with great interest. The study describes the effect mechanisms of the drugs and formulates the conclusion about its effectiveness and safety as well as the prospects for further research in this area. The authors examine the issue of safety, reversibility, and effectiveness of hormonal male contraception and demonstrate the feasibility of further research and development in this trajectory as well as note the already achieved effectiveness of some of the drugs under study. A review of the available data allows for discussing the importance of the issue of male contraception against the background of increasing demand for the corresponding part of the population of fertile age. As some studies demonstrate, the concern about possible side effects can lead to their manifestations in groups of subjects receiving a placebo. This may indicate that the public remains wary and distrustful of hormonal male contraceptives against based on the failures of previous samples. The latest developments show promising results and are at various stages of clinical research. In particular, the drug in question, Dimethandrolone undecanoate (DMAU), successfully passes all tests and is characterized by efficacy, safety as well as complete and rapid reversibility upon discontinuation of therapy. Such effects are achieved due to the dual androgen and progestogen effects mediated by an agonistic effect on androgen and progesterone receptors and associated with the response of the corresponding biological targets. DMAU also has additional indications for use in the form of androgen replacement therapy in cases of low testosterone levels in men. At the moment, due to the continuing doubts about the safety and effectiveness of hormonal contraception in men, research is still being conducted on limited scale. Nevertheless, there is also a high interest in this group of drugs, more and more men express their readiness and interest in the context of using the drugs.
Keywords: male contraception, oral contraceptives, dimethandrolone undecanoate, testosterone, progestin.
Введение
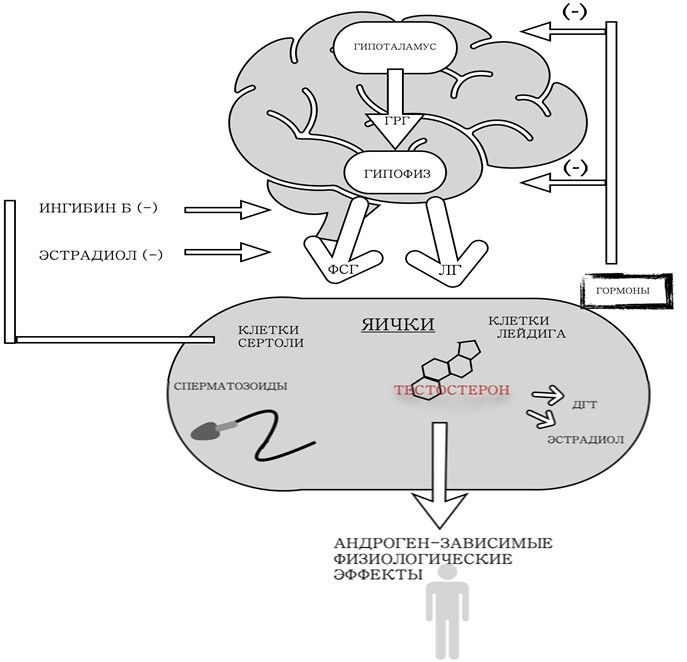
В современном мире, несмотря на доступность средств женской контрацепции, 40-45% беременностей по всему миру оказываются незапланированными [1]. Многие мужчины, вопреки распространенному заблуждению, готовы участвовать в контроле над рождаемостью посредством использования средств и препаратов мужской контрацепции. К сожалению, на данный момент ряд многообещающих перспективных методов находятся на первых этапах тестирования или же исследования по их разработке оказались невостребованными. Контрацептивный эффект гормональных препаратов достигается за счет действия на компоненты гипоталамо-гипофизарно-гонадной оси. Прежде чем рассматривать механизм действия, стоит поговорить об анатомической и физиологической составляющих.
В организме взрослого здорового фертильного мужчины новые сперматозоиды постоянно продуцируются в яичках. Регулируется сперматогенез гонадотропными гормонами гипофиза и стероидными гормонами яичка, в частности, тестостероном, и находится под контролем гипоталамо-гипофизарно-гонадной оси. То есть производство тестостерона яичками необходимо для сперматогенеза и фертильности у мужчин. Целью исследований гормональной контрацепции является поиск пути временного блокирования эффектов тестостерона таким образом, чтобы тестикулы перестали продуцировать сперматозоиды. В то же время эта задача должна быть выполнена без понижения уровня тестостерона до того предела, который бы привел к появлению побочных эффектов.
Андрогены — это стероидные половые гормоны, производимые половыми железами: яичками (клетками Лейдига) у мужчин и яичниками у женщин [2]. Также у обоих полов синтез андрогенов может происходить в клетках сетчатого слоя коры надпочечников. Тестостерон – главный андрогенный стероидный гормон, синтез которого происходит из холестерина. В норме у мужчины (с 16 лет) вырабатывается 4-8 мг/сут тестостерона, из которых примерно 95% синтезируются яичками и 5% — корой надпочечников, причем наибольшее количество вырабатывается в утренние часы, а наименьшее — в вечерние [3].
Метаболизм тестостерона подразумевает участие изоформ фермента 5-α-редуктазы, находящегося в цитоплазме. Под действием данного энзима происходит превращение тестостерона в активный внутриклеточный метаболит - ДГТ- 5-α- дигидротестостерон [2], [4]. Дигидротестостерон, как и тестостерон, оказывает свои биологические эффект через связь с внутриклеточными рецепторами [5].
Тестостерон обладает широким спектром физиологических эффектов, оказывая влияние на различные органы и системы. В эмбриональном периоде тестостерон определяет дифференцировку половых органов- у эмбриона под действием андрогенов из Вольфова протока образуются придаток яичка (эпидидимис), семявыносящий проток и семенной пузырек. В то же время тестостерон способствует маскулинизация мозга.
Позднее в препубертатном периоде тестостерон за счет анаболического эффекта и стимуляции клеточного деления приводит к резкому увеличению линейных размеров тела, массы скелетных мышц, росту костей (в то же время, однако, стимулирует сращение эпифизов длинных костей с их стволами) [6].
К эффектам тестостерона относят влияние на репродуктивную систему, на созревание сперматозоидов, влияние на мужские половые органы, формирование вторичных половых признаков, а также формирование и поддержание либидо [6], [7]. В частности, ДГТ как активная форма тестостерона оказывает воздействие на придатки яичка, семявыносящий проток, семенные пузырьки и предстательную железу. Для роста предстательной железы важна ароматизация тестостерона с образованием эстрогенов. При доброкачественной гиперплазии предстательной железы (ДГПЖ) концентрация эстрогенов в ее строме отчетливо возрастает.
Андрогены независимо от типа ткани проявляют анаболические эффекты, связанные со стимуляцией процессов транскрипции и увеличения скорости синтеза белка. Наибольшее количество клеток-мишеней андрогена отмечается в скелетных мышцах, под его действием происходит наращивание мышечной массы посредством увеличения мышечных белков. Значительная стимуляция белок-синтетических процессов под действием андрогенов наблюдается в почках, а также в сердечной мышце, костной ткани [8], что способствует итоге развитию скелета и мышц по мужскому типу. Поддержание нормальной концентрации половых гормонов является ключевым для достижения пиковой костной массы и ее поддержания в течение всей жизни мужчины [9]. При гипогонадизме демонстрируется четкая прямая зависимость между сниженным уровнем тестостерона и минеральной плотностью костной ткани. Применение же терапии препаратами тестостерона способствует восстановлению как костной массы, так и минеральной плотности кости (МПК) [10].
К числу функций тестостерона относятся также влияние на сердечно-сосудистую систему и психотропные эффекты. Воздействие на первую неоднозначно. С одной стороны, считалось, что тестостерон оказывает неблагоприятное влияние на частоту развития и течение сердечно-сосудистых заболеваний у мужчин, что связывали с большей статистической встречаемостью сердечно-сосудистых заболеваний у мужчин: склероз коронарных артерий -одна из основных причин смертности, и что риск развития ишемической болезни сердца у мужчин вдвое превышает таковой у женщин. Связь данных различий с действием половых гормонов подтверждают данные о резком повышении концентрации липопротеинов высокой плотности при снижении уровня тестостерона в сыворотке [7]. В пользу этой позиции говорит и тот факт, что эстрогены, считающиеся антагонистами андрогенов, снижают риск развития сердечно-сосудистых заболеваний у женщин [11]. С другой стороны, отдельными исследованиями продемонстрировано, что высокие концентрации тестостерона могут обладать благоприятным протективным эффектом [12]. Morgentaler и соавт. демонстрируется корреляция между снижением концентрации тестостерона и возрастающим по мере этого риском смертности от атеросклероза и ишемической болезни сердца, увеличением толщины КИМ (комплекса интима-медиа) в сонных артериях, более частым развитием ожирения и сахарного диабета (СД) [13], [14]. Более того, увеличение уровня тестостерона, как утверждается, обратно пропорционально смертности [15]. Демонстрируется благоприятное влияние терапии тестостероном у мужчин с дефицитом последнего и связанное с ней снижение смертности приблизительно на 50% [16], [17], уменьшение вероятности развития инфаркта миокарда у мужчин, относящихся к категории наиболее высокого риска [18], [19], [20], возможность снижения частоты сердечно-сосудистых осложнении у мужчин с метаболическими нарушениями [21] и в целом уменьшение риска сердечно-сосудистых заболеваний и СД, сочетающееся с уменьшением жировой и увеличением мышечной тканей [22], [23], [24]. Также опровергается пагубное влияние терапии тестостерона в контексте увеличения риска венозных тромбоэмболических осложнении [25]. Однако ряд исследований (например, D.E. Laaksonen и соавт.) вовсе опровергает взаимосвязь между риском развития сердечно-сосудистых заболеваний и уровнем тестостерона в крови у мужчин [26]. Психотропные эффекты тестостерона заключаются в обеспечении поддержания функций нервных клеток при влиянии как на головной мозг, так и на периферические нервы [7].
В ряде случаев уровень тестостерона в организме может быть сниженным. Причин этого может быть множество, в частности, нарушения гипоталамо-гипофизарно-гонадной оси возможны на любом из ее уровней. Первичный гипогонадизм обусловлен нарушением функции яичек и может быть результатом как генетических (синдром Клайнфельтера, синдром Нунан, миотоническая дистрофия, мужчины с кариотипом ХХ), так и анатомических нарушений (анорхия, крипторхизм, дисгенезия гонад, опухоли яичек, варикоцеле, синдром клеток Сертоли, вирусный орхит, облучение, снижение чувствительности к андрогенам, угнетение функции ферментов, участвующих в синтезе тестостерона, действие препаратов). Вторичный гипогонадизм может быть наследственным (синдром Каллмана) или приобретенным (опухоли гипофиза, саркоидоз, гемохроматоз, травмы гипофиза, действия ряда медикаментов (глюкокортикоиды, опиаты, анаболические стероиды)) [27], употребления алкоголя, курения; сами гонады при этом не повреждены. Отдельное важное место в этом списке причин занимает возрастной дефицит тестостерона. Клинические проявления дефицита тестостерона у мужчин, как и биологические эффекты данного гормона, весьма разнообразны. Среди них снижение полового влечения, ухудшение эректильной функции, расстройство эякуляции и снижение удовольствия от полового контакта [28], [29], регрессия секреторного эпителия в придатках яичка, семявыносящих протоках и семенных пузырьках, приводящая к аспермии [7], ухудшение общего состояния, настроения, сонливость, усталость. Отдельно стоит выделить снижение плотности костной ткани, потерю мышечной массы и мышечной силы, появление общей выносливости [24], дислипидемию, метаболический синдром [26], [12], [30]. Также к возможным последствиям относятся регрессия вторичных половых признаков, появление вазомоторных нарушений. Помимо вышеупомянутого отмечается корреляционная зависимость между дефицитом тестостерона и инсулинорезистентностью.
Важно отметить, что к патогенетической терапии дефицита тестостерона существует несколько подходов, последний из которых будет иметь связь с рассмотренными впоследствии контрацептивами:
а) стимулирующая терапия хорионическим гонадотропином, с целью выработки собственного (эндогенного) тестостерона и
б) заместительная терапия тестостероном [31], [32].
К сожалению, до сих пор существуют заблуждения о пагубном влиянии терапии тестостероном в контексте повышения риска развития рака предстательной железы или же быстрого роста уже существующего рака [33]. Современные же исследования как минимум не подтверждают данную корреляцию между высокой эндогенной концентрацией андрогенов или экзогенной терапией тестостероном и большим риском развития рака предстательной железы [34], [35], а как максимум, и вовсе доказывают обратную зависимость - именно низкие концентрации тестостерона ассоциированы с неблагоприятными прогностическими признаками рака предстательной железы [36].
В настоящее время применение пероральных моно-препаратов тестостерона по-прежнему сильно ограничено из-за значительного количества побочных эффектов (в частности, поражений печени, холестаза), а также существенной вариабельности их фармакокинетических показателей [31], [32].
Требования к оральной мужской контрацепции
Используемые лекарственный препарат не должен иметь кратковременных или долговременных побочных эффектов, отрицательно сказываться на либидо. Он должен быть обратимым, быстродействующим, простым в применении, а также не должен оказывать влияния на будущее потомство [37], [38]. В попытках достичь этой цели за последние годы было испытано множество комбинаций препаратов и методов их введения. Одним из вариантов явилась терапия прогестинами, которые являются синтетическими аналогами женских гормонов и входят в контрацептивные женские препараты, например, в чисто гестагенные препараты- Мини-Пили. Рассматривается несколько вариантов механизма действия прогестинов:
1) отрицательная обратная связь на оси гипофиз-гонад;
2) угнетение экспрессии рецептора ЛГ;
3) прямое воздействие на сперму.
В целом их действие предотвращает продукцию тестостерона яичками, что предотвращает нормальную продукцию сперматозоидов. В то же время он не позволяет поддерживать концентрацию тестостерона в сыворотке на уровне нормы, что предотвращает развитие побочных эффектов, ассоциированных с низким содержанием указанного андрогена.
Однако подобные комплексы, содержащие только прогестины, не давали должных результатов - одни прогестины не могут подавлять сперматогенез в дозировках, приемлемых для введения. Вероятно, у некоторых испытуемых организм продолжал продуцировать тестостерон в нормальных количествах и, соответственно, продолжался синтез сперматозоидов. Также такой вариант терапии ассоциирован со значительными побочными эффектами, среди которых колоссальное снижение либидо и эректильная дисфункция.
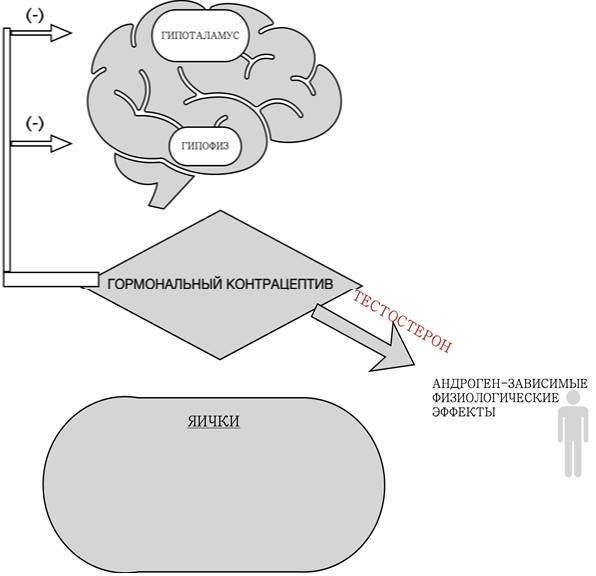
Другим вариантом явилась сингулярно-андрогенная терапия. Прежде чем переходить к ее описанию, стоит сказать пару слов о том, на что может быть направлено действие гормональных контрацептивов для достижения контрацептивного эффекта. Основу механизма их действия составляет подавление ЛГ и ФСГ и последующее обратимое ингибирование функции тестикул, а именно сперматогенеза и продукции тестостерона (рисунок 1). Как уменьшение тестостерона, так и подавление ФСГ приводят к снижению функционирования клеток Сертоли, необходимых для созревания клеток зародышевой линии. Чтобы поддерживать андроген-зависимые физиологические функции, андроген, обычно тестостерон, должен являться обязательным компонентом контрацептивного состава [39], [40] (рисунок 2).
Рис. 1 – «Обратная связь» гормонов
Рис. 2 – Механизм действия гормональной контрацепции
Landmark World Health Organization исследованиям продемонстрировано подавление сперматогенеза и предотвращение наступления беременности при использовании препаратов с тестостероном [41], [42]; Аналогичные результаты наблюдались позднее в случае с новыми разработками [43]. Однако значительные побочные эффекты, ассоциированные с действием высоких доз тестостерона, в испытаниях с сингулярно-андрогенной терапией (акне, измененное либидо, ночная потливость, увеличение массы тела и изменчивость настроения) и отсутствие достаточной эффективности подтолкнули исследователей к разработке комбинированной терапии. Целью комбинированной терапии является эффективное создание стерильности при использовании тестостерона в более низких дозах для поддержания физиологического уровня и уменьшения побочных эффектов.
Тестостерон-прогестиновые лекарственные препараты
Терапия комбинацией андроген-прогестин показала себя не только более безопасной, но и более эффективной в подавлении сперматогенеза [44]. Эти два стероида обладают синергическим и аддитивным (добавочным) действием на гипоталами-гипофизарно-гонадную ось, что обеспечивает более быстрое и глубокое достижение подавляющего эффекта на сперматогенез и гонадотропины по сравнению с моно-терапией любым из этих составляющих. Добавление прогестина позволяет сделать препарат безопаснее посредством уменьшения дозировки вводимого тестостерона, тем самым снизив риск возникновения побочных эффектов, ассоциированных с концентрациями тестостерона, превышающими физиологичные [45]. В итоге подобной комбинацией достигается эффективность, сопоставимая с таковой в случае женской гормональной контрацепцией.
В случае комбинированной терапии побочные эффекты, как правило, коррелируют с соответствующим типом используемого прогестина. Прогестины нортестостеронового происхождения сохраняют андрогенную активность и их применение нередко приводит к андроген-ассоциированным негативным эффектам, как, например, набор веса, акне и снижение уровня ЛПВП. Результаты плацебо-контролируемых испытаний терапии этоногестрела и тестостерона ундеканоата (ТУ) оказались многообещающими [46]. В данном исследовании наиболее распространенными осложнениями являлись нестабильность и изменчивость настроения, снижение либидо, акне, набор веса, ночная потливость. В то время как среди испытуемых, получавших реальную терапию, 93% заявили о наличии побочных эффектов, среди мужчин, получавших плацебо, с такими же заявлениями выступил 81%, что говорит о чрезвычайной субъективности в оценке негативного влияния мужской контрацепции на организм. Показатели выкидышей были сходны с таковыми в общей популяции (6–11% и 8–20% соответственно), врожденных пороков - 0.9–1.8%, что является крайне небольшим показателем [47].
Различные прогестины показали разную степень своей эффективности. Комбинация ТУ с этоногестрелом (активным метаболитом дезогестрела) была изучена в 2008 году в обширном исследовании, включающем группу из 354 мужчин [46]. В испытаниях сочетанное действие этоногестрел-подкожного импланта с 750 мг или 1000 мг ТУ каждые 10-12 недель было ассоциировано с подавлением сперматогенеза и достижением значений 1 миллион/мл. Подобная терапия была обратима и хорошо перенесена.
В другом небольшом исследовании рассматривалась комбинация гранул тестостерона - четыре 200 мг импланта каждые 4-6 месяцев, с 300 мг медроксипрогестерона ацетата (МПА), вводимых каждые 3 месяца. Терапия показала свою контрацептивную эффективность, обратимость и краткосрочную безопасность [48]. Среди побочных эффектов отмечались типичные симптомы андрогенной недостаточности, изменчивость настроения, а также в ряде случаев наблюдались проблемы с самими имплантами- гранулами.
В 2001 была испытана комбинация инъекционного депо 1000 мг TU в сочетании с энантатом норэтистерона (NETE), иначе называемым энантат норэтиндрона - формой моно-прогестоген-контрацептива, в дозировке 200 мг. Размер интервала между введениями составил 6 недель. В результате было достигнуто глубокое подавление сперматогенеза без появления серьезных побочных эффектов [49]. В последующем исследовании, проводившемся 48 недель, интервал между повторными инъекциями составил уже 8 недель. В 9 из 10 случаев была достигнута азооспермия, во всех случаях наблюдалась олигозооспермия (<1 миллиона/мл) [50]. Дальнейшее увеличение интервала между повторными инъекциями уже не позволяло достичь желаемой эффективности, что было продемонстрировано уже при промежутке в 12 недель.
Впоследствии появилась идея о том, что TU and NETE можно растворять в касторовом масле с возможностью последующего одномоментного совместного их введения раз в 8 недель. Было проведено обширное мультинациональное исследование с целью подтвердить безопасность и эффективность комбинации 1000 мг TU с 200 мг NETE. Через 24 недели у 274 из 320 участников были достигнуты показатели 1 миллион спермиев на мл или менее [51]. За 56 недель в группе из 266 мужчин было установлено 4 беременности у их партнеров. За восстановительный период в 52 недели у 95% испытуемых был восстановлен сперматогенез (не менее 15 миллионов/мл и 39 миллионов в эякуляте). Что касается побочных эффектов, наблюдались следующие: акне, боли в области инъекции, миалгия, изменчивость настроения, повышение либидо. Также отмечено, что 6% мужчин отказались от участия из-за возникших осложнений. Комитет по безопасности даже предложил прекратить введение препарата и завершить исследование раньше назначенных сроков из-за сообщений об увеличении изменчивости настроения.
Подводя итог данного блока об общих моментах комбинированной гормональной мужской контрацепции, отметим несколько моментов. Именно в начале 2000-х было продемонстрировано, что комбинация андроген-прогестин терапии обеспечивала более физиологичные андрогеновые дозировки, устойчивое и стабильное подавление сперматогенеза и предотвращение беременности [52]. Позднее International Hormonal Male Contraception Summit Group составила обзор имеющихся данных с целью продемонстрировать, что андроген-прогестин комбинированная терапия:
1) может быть широко применена среди мужчин разных возрастов, этнических принадлежностей и других основополагающих характеристик [53], [54];
2) превосходит сингулярную андроген-терапию и опережает вазектомию по срокам начала достижения контрацептивного эффекта [54], [55];
3) а также обеспечивает полное восстановление сперматогенеза у всех мужчин до прежних уровней в рамках нормы фертильности в случае прекращения терапии [53].
Важно помнить, что на успешность фармакологического препарата во многом влияет и выбор лекарственной формы. Инъекционный, трансдермальный и пероральный- основные методы доставки разрабатываемых контрацептивных гормональных препаратов для мужчин.
Инъекционные методы, как правило, находят большую поддержку среди респондентов, чем, например, трансдермальный, что, вероятно, связано с большей уверенностью в гарантированности результата. Так, например, в итальянском исследовании 79% испытуемых отметили, что стали бы использовать данный метод при выходе его на рынок [56]. В Китае также сочли данный метод подходящим [57]. В то же время инъекционный метод введения может быть дискомфортным для каждого в разной степени. Для многих предпочтительной является оральная или трансдермальная форма приема, потому как она обеспечивает независимость от медицинской организации и не требует участие медицинского персонала [58]. Однако, что касается трансдермального метода, он имеет свои недостатки и не всегда удобен в применении. Данные опросов показывают, что лишь 56% испытуемых удовлетворены и довольны исследуемым гелевым методом трансдермальной доставки контрацептива и еще меньше стали бы рекомендовать его [59].
Согласно словам ведущего исследователя, доктора медицинских наук, профессора медицины в Вашингтонском университете Стефании Пейдж [60], мужчины более склонны предпочесть каждодневную таблетку трансдермальным составам и инъекциям в качестве обратимого метода контрацепции. Однако, к несчастью, нередко реализация методов перорального поступления препарата сталкивается с проблемой гепатотоксичности, связанной с метилтестостероном или с необходимостью приема препарата несколько раз в день в случае с TU [61].
Революционная комбинация метода доставки и состава мужских гормональных контрацептивов - Диметандролона Ундеканоат - ДМАУ.
Одной из последних разработок является препарат, имеющий в составе ДМАУ - CDB-4521 - эфир диметандролона. Это дериват (производное) 19-нортестостерона - 7-α, 11-β-диметил 19-нортестостерон ундеканоат. Предыдущие разработки для перорального приема имели побочные эффекты, связанные с печеночной токсичностью из-за потребности в многократном приеме ежедневно ввиду быстрого выведения из организма. Рассматриваемый же препарат за счет составляющей части “ундеканоат” - компонента длинноцепочечной жирной кислоты, препятствует быстрому выведению из организма.
Метаболизм. ДМАУ превращается в свой активный метаболит — диметиландролон (ДМА) посредством реакции гидролиза.
ДМАУ является экспериментальным анаболическим андрогенным стероидом (ААС) и прогестагенным препаратом, который в настоящее время еще не одобрен для медицинского применения [62], [63]. То есть вещество обладает двойной активностью- андрогенной и прогестагенной, согласно преклиническим исследованиям.
История появления и применения. Впервые ДМАУ был описан в 2002 году. Он был разработан Отделением разработки противозачаточных средств Национального института здоровья детей и человеческого развития, агентства при правительстве Соединенных Штатов. Форма препарата подразумевает пероральный прием.
Действие. Как уже было сказано, ДМАУ относится к группе ААС. Представители данной фармакологической группы препаратов имитируют действие собственных гормонов человека, в частности тестостерона. Соответственно, ДМАУ является агонистом рецептора андрогена, приводя, при взаимодействии с рецепторами, к отклику биологических мишеней андрогенов, например, тестостерона. ДМАУ также является прогестином - синтетическим прогестагеном и, следовательно, является агонистом рецептора прогестерона и вызывает отклик биологических мишеней таких прогестагенов, как прогестерон. ДМАУ не обладает эстрогенным действием.
Благодаря своей андрогенной и прогестагенной активности ДМАУ и обладает антигонадотропным действием. Итогом действия является обратимое снижение уровня эндогенного тестостерона, антигонадотропное действие, подавление сперматогенеза и контрацептивный эффект у мужчин.
Препарат с ДМАУ глубоко и быстро обратимо подавляют выработку тестостерона в яичках при приеме внутрь один раз в день в течение месяца. Уровни циркулирующего тестостерона, достигаемые в течение тест-периода перорального приема ДМАУ, эквивалентны тем, которые наблюдались в среднем при хирургической кастрации (13,4 нг/дл для ДМАУ, 15 нг/дл для кастрации; нормальный уровень тестостерона в среднем у здорового взрослого мужчины составляет 315-1000 нг/дл [64]. При этом важное значение имеет то, что после прекращения приема Диметандролона ундеканоата уровень тестостерона начинает восстанавливаться в течение нескольких дней и достигает нормального уровня в течение месяца.
Отмечается, что ДМАУ не снижает активность и количество 5-α-редуктазы. Стероидная 5-α-редуктаза относится к группе 5-α-редуктаз (3-оксо-5α-стероид-4-дегидрогеназ), участвующих в метаболизме стероидов. Они участвуют в трех метаболических процессах: биосинтезе желчных кислот, метаболизме андрогенов и эстрогенов. Данный фермент имеет 3 изоформы: стероидная 5-α-редуктаза 1, 2 и 3 (SRD5A1 , SRD5A2 и SRD5A3), содержание которых варьируется в зависимости от ткани и от возраста. 5-α-редуктаза локализуется в ядрах стромальных клеток простаты и катализирует необратимую трансформацию тестостерона в дигидротестостерон.
Дигидротестостерон связывается с ядерным андрогенным рецептором в простатических стромальных клетках и приводит к секреции паракринных факторов роста, которые диффундируют из стромы в эпителий простаты, стимулируя рост и дифференцировку клеток. В здоровой предстательной железе поддерживается гомеостаз пролиферативных и апоптотических процессов в эпителиальных и стромальных клетках. Избыточная же продукция дигидротестостерона может привести к таким андроген-зависимым состояниям, как доброкачественная гиперплазия простаты (ДГПЖ), рак простаты, акне, алопеция и др. Поэтому для лечения этих состояний патогенетически оправданным является назначение ингибиторов 5-α-редуктазы [65]. Блокируя 5-α-редуктазу, они снижают концентрацию ДГТ, индуцируют апоптоз простатических эпителиальных клеток, при длительном применении уменьшают объем простаты в среднем на 15–25% и увеличивают пиковую скорость мочеиспускания, таким образом устраняя механический компонент обструкции при ДГПЖ.
ДМАУ же не является субстратом для 5-α-редуктазы и, следовательно, не потенцируется и не инактивируется в тканях, которые экспрессируют 5α-редуктазу, как кожа, волосяные фолликулы и предстательная железа. Таким образом, учитывая снижение выработки естественного тестостерона организмом, ДМАУ может иметь пониженный риск андрогенных побочных эффектов и андроген-зависимых состояний, таких как акне, алопеция, рост волос на теле, доброкачественная гиперплазия простаты и рак простаты по сравнению с тестостероном и некоторыми другими ААС.
Доказанная ЭффективностьВ 2018 году на 100-й Ежегодной встрече общества эндокринологов в Чикаго (ENDO 2018) была представлена инновационная разработка - противозачаточная пилюля для мужчин - диметандролон ундеканоат или ДМАУ [62, 63], принимается один раз в день, подобно своим женским аналогам. Новое средство контрацепции было протестировано на 83 из 100 участвовавших здоровых мужчинах в возрасте 18-50 лет в Медицинском центре Университета Вашингтона и в медицинском центре Harbour-UCLA в калифорнийском Торрансе [63]. Было несколько групп: по суточным дозировкам (100, 200 и 400 миллиграммов средства в день) и по формам в капсулах (касторовое масло или порошки). В каждой доз-группе было по 5 испытуемых, выбранных случайным образом, которые получали плацебо. Тест-период приема препарата составлял 28 дней; прием осуществлялся с пищей (что обеспечивало большую эффективность). В первый и последний дни исследования у испытуемых брались анализы крови для определения уровней гормонов и холестерина.
Препарат успешно прошел испытания, продемонстрировав эффективность, безопасность и отсутствие влияния на либидо. Результаты показали, что наибольшей дозировке в 400 миллиграмм/сут наблюдалось выраженное снижение уровня тестостерона и других гормонов, необходимых для производства сперматозоидов. Уровень сывороточного тестостерона в организме был ожидаемо низок. За месяц испытуемыми почти не ощущались изменения гормонального фона и симптомы, традиционно связываемые с дефицитом или избытком этого гормона. Из нежелательных эффектов у всех мужчин наблюдались незначительные увеличение массы тела и снижение ЛПВП, защищающего кровеносные сосуды от разрушения и снижающего риск инфарктов и инсультов. Все испытуемые успешно прошли испытания на безопасность, включая маркеры на функции печени и почек - у всех испытуемых они были в норме. Стоит также отметить, что у женских оральных контрацептивов гораздо больше побочных эффектов (например, межменструальные и обильные менструальные кровотечения, дурнота, рвота, диарея, головные боли, значительная абдоминальная боль, являющаяся симптомом более серьезных осложнений).
В данный момент проводятся долгосрочные исследования для подтверждения безопасности и эффективности ДМАУ в качестве ежедневно принимаемого контрацептива.
Дополнительные показания. Помимо мужской контрацепции, ДМАУ представляет интерес в качестве потенциального препарата для заместительной андрогенной терапии в случаях низких уровней тестостерона у мужчин.
Возможными побочными эффектами ДМАУ являются незначительное увеличение веса, умеренное снижение уровня ЛПВП, повышенный гематокрит, низкий уровень эстрогена и связанные с ним симптомы (снижение либидо, сниженная эректильная функция, снижение минеральной плотности костей, результирующееся в остеопорозе и др). Отдельно выделяют печеночную токсичность (вариативность в зависимости от дозировок и схемы приема): было обнаружено, что ДМАУ оказывает некоторые эффекты, указывающие на потенциальную токсичность для печени, при пероральном введении животным. При сравнении действия и метаболизма ДМАУ с некоторыми другими веществами (трестолон (7-α-метил-19-нортестостерон, который используется в том числе для лечения низкого уровня тестостерона у мужчин) (+), 11-β-метил-19-нортестостерон 17-β-додецил карбонат (-)) были выявлены потенциальные признаки токсического действия на печень, что позволяет предположить, что метильная группа C7α ДМАУ может способствовать печеночной токсичности. В то же время, в клиническом исследовании при оценке действия ДМАУ в течение месяца, результаты говорят о безопасности для функции печени и почек.
ВыводыТаким образом, был рассмотрен вопрос гормональной мужской контрацепции. В частности, инновационный препарат ДМАУ в краткосрочных клинических испытаниях показал свою безопасность, обратимость и эффективность. Соответствующие исследования были сопоставлены авторами с данными об иных лекарственных составах, а также о других формах доставки препаратов. К сожалению, на данный момент ряд многообещающих перспективных методов находятся на первых этапах тестирования, в то время как другая часть исследований по их разработке оказалась прекращена. Данным анализом, основанным на рассмотрении имеющихся литературных источников, была продемонстрирована целесообразность дальнейших исследований и разработок в данном направлении, обусловленная возросшим спросом.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Bearak J. Global, regional, and subregional trends in unintended pregnancy and its outcomes from 1990 to 2014: estimates from a Bayesian hierarchical model / Bearak J, Popinchalk A, Alkema L, et al. //Lancet Glob Health 2018; 6: e380–e389.
- Sizar O. Androgen Replacement / Sizar O, Pico J. 2020 May 24. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan–. PMID: 30521274..
- Basaria S. Hypogonadism and androgen replacement therapy in elderly men / Basaria S., Dobs A.S. // Am JMed 2001; 110: 563-572. DOI: dx.doi.org/10.1016/S0002-9343(01)00663-5.
- Hammes S.R. Impact of estrogens in males and androgens in females / Hammes S.R., Levin E.R. // J Clin Invest. 2019;129(5):1818-1826. DOI:10.1172/JCI125755
- Mooradian A.D. Biological actions of androgens / Mooradian A.D., Morey J.E., Korenman S.G. // Endocrinol Rev 1987; 8: 1-28. DOI: dx.DOI.org/10.1210/edrv-8-1-1.
- Kirby M. Testosterone and the Heart / Kirby M, Hackett G, Ramachandran S. // Eur Cardiol. 2019;14(2):103-110. Published 2019 Jul 11. DOI:10.15420/ecr.2019.13.1
- / Eds. E. Nieschlag, H.M. Behre. 2nd Edition Male Reproductive Health and Disfunction, 2001: 52-70.
- Behre H.M. Potential of testosterone buciclate for male contraception: endocrine differences between responders and nonresponders / Behre H.M., Baus S., Kliesch S., et al. // J Clin Endocrinol Metab. 1995;80(8):2394-2403. DOI:10.1210/jcem.80.8.7543113
- Harvey N.C. Measures of Physical Performance and Muscle Strength as Predictors of Fracture Risk Independent of FRAX, Falls, and aBMD: A Meta-Analysis of the Osteoporotic Fractures in Men (MrOS) Study / Harvey NC, Odén A, Orwoll E, et al. // J Bone Miner Res. 2018;33(12):2150-2157. DOI:10.1002/jbmr.3556
- Finkelstein J.S. Increases in bone density during treatment of men with idiopathic hypogonadotropic hypogonadism / Finkelstein J.S., Klibanski A. Neer R.M., et al. // J Clin Endocrinol Metab 1989;69:776-83. DOI: dx.DOI.org/10.1210/jcem-69-4-776#sthash.nUyUDKxi.dpuf.
- Elliott J. Testosterone therapy in hypogonadal men: a systematic review and network meta-analysis / Elliott J, Kelly SE, Millar AC, et al. // BMJ Open. 2017;7(11):e015284. Published 2017 Nov 16. DOI:10.1136/bmjopen-2016-015284
- Antonio L. Associations between sex steroids and the development of metabolic syndrome: a longitudinal study in European men / Antonio L., Wu F.C.W., O’Neill T.W. et al. //J Clin Endocrinol Metab 2015; 100(4):1396-1404. DOI: 10.1210/jc.2014-4184.
- Morgentaler A. Testosterone therapy and cardiovascular risk: advances and controversies / Morgentaler A., Miner M.M., Caliber M., et al. // Mayo Clin Proc 2015; 90(2):224-251. DOI: 10.1016/j.mayocp.2014.10.011.
- Ullah M.I. Testosterone deficiency as a risk factor for cardiovascular disease. Testosterone deficiency as a risk factor for cardiovascular disease / Ullah M.I., Washington T., Kazi M. // Horm Metab Res 2011; 43(03):153-164. DOI: 10.1055/s-0030-1270521.
- Khaw K.T. Endogenous testosterone and mortality due to all causes, cardiovascular disease, and cancer in men: European prospective investigation into cancer in Norfolk (EPIC-Norfolk) / Khaw KT., Dowsett M., Folkerd E, et al. // Prospective Population Study. Circulation 2007; 116(23):2694-7012007.
- Muraleedharan V. Testosterone deficiency is associated with increased risk of mortality and testosterone replacement improves survival in men with type 2 diabetes / Muraleedharan V., Marsh H., Kapoor D., et al. // Eur J Endocrinol 2013; 169(6):725-733. DOI: 10.1530/eje-13-0321.
- Shores M.M. Testosterone treatment and mortality in men with low testosterone levels / Shores M.M., Smith N.L., Forsberg C.W. et al. // J Clin Endocrinol Metab 2012; 97(6):2050-2058. DOI: 10.1210/jc.2011 -2591.
- Baillargeon J. Risk of myocardial infarction in older men receiving testosterone therapy / Baillargeon J., Urban R.J., Kuo Y.F., et al. //Ann Pharmacother 2014;48(9): 1138-1144. DOI: 10.1177/1060028014539918.
- Sharma R. Normalization of testosterone level is associated with reduced incidence of myocardial infarction and mortality in men / Sharma R., Oni O.A., Gupta K., et al. // Eur Heart J 2015; 36(40):2706-2715. DOI: 10.1093/eurheartj/ehv346.
- Anderson J.L. Impact of testosterone replacement therapy on myocardial infarction, stroke, and death in men with low testosterone concentrations in an integrated health care system / Anderson J.L., May H.T., Lappe D.L., et al. // Am J Cardiol 2016; 117(5):794-799. DOI: 10.1016/j.amjcard.2015.11.063.
- Corona G. Cardiovascular risk associated with testos- terone-boosting medications: a systematic review and meta-analysis / Corona G., Maseroli E., Rastrelli G., et al. // Expert Opin Drug Saf 2014;13(10):1327-1351. DOI: 10.1517/14740338.2014.950653.
- Dhindsa S. Insulin resistance and inflammation in hypogonadotropic hypogonadism and their reduction after testosterone replacement in men with type 2 diabetes / Dhindsa S., Ghanim H., Batra M., et al. // Diabetes Care 2016; 39(1):82-91. DOI: 10.2337/dc15-1518.
- Allan C.A. Testosterone therapy prevents gain in visceral adipose tissue and loss of skeletal muscle in nonobese aging men / Allan C.A., Strauss B.J.G., Burger H.G., et al. // J Clin Endocrinol Metab 2008; 93(1):139-146. DOI: 10.1210/jc.2007-1291.
- Traish A.M. Outcomes of testosterone therapy in men with testosterone deficiency (TD): Part II. Steroids 2014 / Traish A.M.; 88:117-126. DOI: 10.1016/j.steroids.2014.05.004.
- Baillargeon J. Risk of venous thromboembolism in men receiving testosterone therapy / Baillargeon J., Urban R.J., Morgentaler A., et al. // Mayo Clin Proc. 2015; 90(8): 1038-1045. DOI: 10.1016/j.mayocp.2015.05.012.
- Laaksonen D.E. Testosterone and sex hormone- binding globulin predict the metabolic syndrome and diabetes in middle-aged men / Laaksonen D.E., Niskanen L., Punnonen K., et al. // Diabetes Care 2004; 27(5):1036-1041. DOI: 10.2337/diacare.27.5.1036.
- Nieschlag E. Classification of andrological disorders. In Andrology: Male reproductive health and dysfunction. [Nieschlag E and Behre HM eds]. 2nd ed 2000; Berlin, Springer/ P. 83-88. DOI: DOI.org/10.1007/978-3-662-04491-9_5.
- Wu F.C.W. Identification oflate-onset hypogonadism in middle-aged and elderly men / Wu F.C.W. Tajar A., Beynon J.M., et al. // N Engl J Med 2010; 363(2):123-135. DOI: 10.1056/NEJMoa0911101.
- Finkelstein J.S. Gonadal steroid-dependent effects on bone turnover and bone mineral density in men / Finkelstein J.S., Lee H., Leder B.Z., et al. //J Clin Invest. 2016;126(3):1114-1125. DOI:10.1172/JCI84137
- Ohlsson C. High serum testosterone is associated with reduced risk of cardiovascular events in elderly men / Ohlsson C, Barrett-Connor E, Bhasin S, et al. // J Am Coll Cardiol 2011; 58(16):1674-1681. DOI: 10.1016/j.jacc.2011.07.019.
- Shcheplev P. A. Andrology. Clinical recommendations / P. A. Shcheplev. 2nd edition, supplemented and revised. Moscow: Medpraktika — M Publishing House, 2012, p. 103.
- Bagatell C.J. Androgens in men — uses and abuses / Bagatell C.J., Bremner W.J. // N Engl J Med 1996; 334: 707-714.
- Morgentaler A. Testosterone and prostate cancer: an historical perspective on a modern myth / Morgentaler A. // Eur Urol 2006; 50(5):935-939. DOI: 10.1016/j.eururo.2006.06.034.
- Cui Y. The effect of testosterone replacement therapy on prostate cancer: a systematic review and meta-analysis / Cui Y., Zong H., Yan H., et al. // Prostate Cancer Prostatic Dis 2014; 17(2):132-143. DOI: 10.1038/pcan.2013.60.
- Hormones E. Endogenous sex hormones and prostate cancer: a collaborative analysis of 18 prospective studies / Hormones E. // J Natl Cancer Inst 2008; 100(3):170-183. DOI: 10.1093/jnci/djm323.
- Khera M. A new era of testosterone and prostate cancer: from physiology to clinical implications / Khera M., Crawford D., Morales A., et al. // Eur Urol 2014; 65(1):115-123. DOI: 10.1016/j.eururo.2013.08.015.
- Wang C. Hormonal approaches to male contraception / Wang C., Swerdloff R.S. // Curr Opin Urol 2010; 20: 520–524.
- Nieschlag E. The struggle for male hormonal contraception / Nieschlag E. // Best Pract Res Clin Endocrinol Metab 2011; 25: 369–375.
- Ilani N. Male hormonal contraception: potential risks and benefits / Ilani N., Swerdloff R.S., Wang C. // Rev Endocr Metab Disord 2011; 12: 107–117.
- Amory J.K. Progress and prospects in male hormonal contraception / Amory J.K. // Curr Opin Endocrinol Diabetes Obes 2008; 15: 255–260.
- WHO Task Force on Methods for the Regulation of Male Fertility 1990 Contraceptive efficacy of testosterone-induced azoospermia in normal men. Lancet 336:955–959.
- WHO Task Force on Methods for the Regulation of Male Fertility 1996 Contraceptive efficacy of testosterone-induced azoospermia and oligozoospermia in normal men. Fertil Steril 65:821– 829.
- Gu Y.Q. A multicenter contraceptive efficacy study of injectable testosterone undecanoate in healthy chinese men / Gu Y.Q., Wang X.H., Xu D., et al.// J Clin Endocrinol Metab 88:562–568.
- Liu P.Y. Male hormonal contraception: so near and yet so far / Liu P.Y., McLachlan R.I. // J Clin Endocrinol Metab 2008; 93: 2474–2476
- Meriggiola M.C. A review of androgen-progestin regimens for male contraception / Meriggiola M.C., Farley T.M.M., Mbizvo M.T. // J Androl 2003; 24: 466–483.
- Mommers E. Male hormonal contraception: a double-blind, placebo-controlled study / Mommers E., Kersemaekers W.M., Elliesen J., et al. // J Clin Endocrinol Metab 2008; 93: 2572–2580.
- Piotrowska K. Male hormonal contraception: hope and promise / Piotrowska K., Wang C., Swerdloff R.S., et al. // Lancet Diabetes Endocrinol 2017; 5: 214–223.
- Turner L. Contraceptive efficacy of a depot progestin and androgen combination in men / Turner L., Conway A.J., Jimenez M., et al. // J Clin Endocrinol Metab 2003; 88: 4659–4667.
- Kamischke A. Intramuscular testosterone undecanoate and norethisterone enanthate in a clinical trial for male contraception / Kamischke A., Venherm S., Plöger D., et al. // J Clin Endocrinol Metab 2001; 86: 303–309
- Meriggiola M.C. Norethisterone enanthate plus testosterone undecanoate for male contraception: effects of various injection intervals on spermatogenesis, reproductive hormones, testis, and prostate / Meriggiola M.C., Costantino A., Saad F., et al. // J Clin Endocrinol Metab 2005; 90: 2005–2014
- Behre H.M. Efficacy and safety of an injectable combination hormonal contraceptive for men / Behre H.M., Zitzmann M., Anderson R.A., et al. // J Clin Endocrinol Metab 2016; 101: 4779–4788.
- Turner L. Contraceptive efficacy of a depot progestin and androgen combination in men / Turner L., Conway A.J., Jimenez M., et al. // J Clin Endocrinol Metab 88:4659 – 4667.
- Liu P.Y. Hormonal Male Contraception Summit Group 2006 Rate, extent and modifiers of spermatogenic recovery after hormonal male contraception: an integrated analysis / Liu P.Y., Swerdloff R.S., Christenson P.D., et al. // Lancet 367:1412–1420.
- Liu P.Y. 2008 Determinants of the rate and extent of spermatogenic suppression during hormonal male contraception: an integrated analysis / Liu P.Y., Swerdloff R.S., Anawalt B.D., et al. // J Clin Endocrinol Metab 93:1774 –1783.
- Marwood R.P. Disappearance of spermatozoa from the ejaculate after vasectomy / Marwood R.P., Beral V. // Br J Med 1:87.
- Meriggiola M.C. Acceptability of an injectable male contraceptive regimen of norethisterone enanthate and testosterone undecanoate for men / Meriggiola M.C., Cerpolini S., Bremner W.J., et al. // Hum Reprod Oxf Engl 2006; 21: 2033–2040.
- Zhang L. The acceptability of an injectable, once-a-month male contraceptive in China / Zhang L., Shah I.H., Liu Y., et al. // Contraception 2006; 73: 548–553. [PubMed] [Google Scholar].
- Martin C.W. Potential impact of hormonal male contraception: cross-cultural implications for development of novel preparations / Martin C.W., Anderson R.A., Cheng L., et al. // Hum Reprod Oxf Engl 2000; 15: 637–645.
- Roth M.Y. Characteristics associated with suppression of spermatogenesis in a male hormonal contraceptive trial using testosterone and Nestorone(®) gels / Roth M.Y., Ilani N., Wang C., et al. // Andrology 2013; 1: 899–905.
- Dimethandrolone undecanoate shows promise as a male birth control pill. – [Electronic resource]. – UrL: https://www.endocrine.org/news-and-advocacy/news-room/2018/dimethandrolone-undecanoate-shows-promise-as-a-male-birth-control-pill .(accessed: 12.03.2021)
- Meriggiola M.C. An oral regimen of cyproterone acetate and testosterone undecanoate for spermatogenic suppression in men / Meriggiola M.C., Bremner W.J., Costantino A., et al. // Fertil Steril 1997; 68: 844–850.
- Phase 1 Study of Dimethandrolone Undecanoate in Healthy Men (ДМАУPhase1) // clinicaltrials.gov [Electronic resource]. – URL: https://clinicaltrials.gov/ct2/show/NCT01382069?term=ДМАУ&draw=2&rank=3 (accessed: 20.12.2020)
- Thirumalai A, Ceponis J, Amory JK, et al. Effects of 28 days of oral dimethandrolone undecanoate in healthy men: a prototype male pill. // The Journal of Clinical Endocrinology & Metabolism. February 2019. №Volume 104, Issue 2. С. Pages 423–432.
- Kaufman J.M., Vermeulen A. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocr Rev. 2005;26(6):833–876.
- Alpha-reductase inhibitors: what's new? // http://journals.lww.com [Electronic resource]. – URL: https://journals.lww.com/co-urology/Abstract/2003/01000/5_Alpha_reductase_inhibitors__what_s_new_.6.aspx (accessed: 03.02.2021).