METHODOLOGY OF DETERMINATION OF 2-DIMETHYLAMINO-1,3-BIS- (PHENYLSULPHONYLTHIO) PROPANE IN BLOOD AND ITS VALIDATION
Баранов Ю.Н.1, Шорманов В.К.2, Коваленко Е.А.3
1ORCID: 0000-0002-7999-7709, Аспирант, 2ORCID: 0000-0001-8872-0691, Доктор фармацевтических наук, профессор, 3ORCID: 0000-0002-7492-9598, Кандидат фармацевтических наук,
1,2,3Курский государственный медицинский университет
МЕТОДИКА ОПРЕДЕЛЕНИЯ 2-ДИМЕТИЛАМИНО-1,3-БИС-(ФЕНИЛСУЛЬФОНИЛТИО)ПРОПАНА В КРОВИ И ЕЁ ВАЛИДАЦИЯ
Аннотация
Изучены особенности изолирования 2-Диметиламино-1,3-бис-(фенилсульфонилтио)пропан (бенсултап) из его модельных смесей с кровью этилацетатом в режиме настаивания. Для достаточно полного извлечения 2-диметиламино-1,3-бис-(фенилсульфонилтио)пропана этилацетатом из крови необходимо двукратное настаивание биологической матрицы с этилацетатом, если массовое соотношение изолирующего агента и биоматериала составляет как минимум 2:1, а продолжительность каждого настаивания – не менее 30 минут. Очистка анализируемого вещества от эндогенных веществ биожидкости проводится в колонке силикагеля L 40/100 мкм при элюировании гексаном, а затем – смесью гексан-диоксан-пропанол-2 (8:3:0,6). Разработана методика определения 2-диметиламино-1,3-бис-(фенилсульфонилтио)пропана в крови на основе применения метода ВЭЖХ, которая валидирована по критериям линейности, правильности, прецизионности, стабильности. Пределы обнаружения и количественного определения аналита составляют соответственно 1,75 мкг/г и 2,25 мкг/г.
Ключевые слова: 2-диметиламино-1,3-бис-(фенилсульфонилтио)пропан (бенсултап), изолирование, очистка, идентификация и определение, валидация.
Baranov Yu.N.1, Shormanov V.K.2, Kovalenko E.A.3
1ORCID: 0000-0002-7999-7709, Postgraduate student, 2ORCID: 0000-0001-8872-0691, PhD in Pharmaceutics, Professor, 3ORCID: 0000-0002-7492-9598, PhD in Pharmaceutics,
1,2,3Kursk State Medical University
METHODOLOGY OF DETERMINATION OF 2-DIMETHYLAMINO-1,3-BIS- (PHENYLSULPHONYLTHIO) PROPANE IN BLOOD AND ITS VALIDATION
Abstract
The features of the isolation of 2-dimethylamino-1,3-bis-(phenylsulfonylthio) propane (bensultap) from its model mixtures with blood ethyl acetate in the infusion regime were studied. To sufficiently extract 2-dimethylamino-1,3-bis (phenylsulfonylthio) propane ethyl acetate from the blood, it is necessary to insult the biological matrix with ethyl acetate twice if the weight ratio of the isolating agent and the biomaterial is at least 2:1, and the duration of each infusion is not less than 30 minutes. The purification of the analyte from the endogenous substances of the biofluid is carried out in a column of silica gel L 40/100 μm, eluting with hexane, and then with a mixture of hexane-dioxane-propanol-2 (8:3:0.6). A procedure for the determination of 2-dimethylamino-1,3-bis (phenylsulfonylthio) propane in the blood was developed based on the HELC method, validated according to the criteria of linearity, accuracy, precision, and stability. The limits of detection and quantitation of the analyte are 1.75 μg/g and 2.25 μg/g, respectively.
Keywords: 2-dimethylamino-1,3-bis (phenylsulfonylthio) propane (bensultap), isolation, purification, identification and determination, validation.
2-Диметиламино-1,3-бис-(фенилсульфонилтио)пропан (название по ИЮПАК 1,3бис (бензолсульфонилсульфанил)-N,N-диметилпропан-2-amin; тривиальное название бенсултап; торговые названия: банкол, 17606-31-4, виктенон, дибензолсульфонат нереистоксина, BRN 2228033, Z-дорицид) (далее по тексту – 2-ДМА-1,3-бис-(ФСТ)П) – соединение, проявляющее биологическую активность антихолинэстеразной направленности и продолжительное время находящее применение в растениеводстве в качестве инсектицида [1, С. 2], [2, C. 236], [3, C. 10].
2-ДМА-1,3-бис-(ФСТ)П, перекристаллизованный из ацетона в смеси с гексаном, имеет вид белых с незначительным коричневатым оттенком кристаллов, плавящихся от 84 до 85оС. Известна малая растворимость 2-ДМА-1,3-бис-(ФСТ)П в воде (0,0007-0,0008 г/л; 30оС) и водных растворах кислот. Значительная растворимость (˃1,0 кг/кг; 25 оС) этого вещества отмечается в трихлорметане, ацетонитриле и диметилкетоне. Уровень растворимости (кг/кг; 25 оС) 2-ДМА-1,3-бис-(ФСТ)П в низших алифатических спиртах составляет: 0,025 (для метанола) и 0,013 (для этанола), в гексане – 0,00017. [4, С. 2], [5, C. 722], [6, C. 523].
Теплокровные организмы чувствительны к 2-ДМА-1,3-бис-(ФСТ)П, который оказывает на них токсическое действие. Установленное значение половинной летальной дозы при введении данного токсического агента в желудок лабораторным крысам немного превышает 1 г на кг массы. За время применения 2-ДМА-1,3-бис-(ФСТ)П в сельскохозяйственной практике во многих странах мира регулярно наблюдались довольно многочисленные случаи отравления людей данным токсикантом и некоторыми близкими к нему по химической природе и свойствам веществ (например, тиосултапом натрия или картапом) [7, C. 91], [8, 233].
Среди подобных отравлений регулярно регистрировались и такие, которые заканчивались летальным исходом. Много случаев летальных исходов от отравления 2-ДМА-1,3-бис-(ФСТ)П отмечены в странах Центральной и Юго-Восточной Азии, Центральной и Восточной Европы [9, С. 153], [10, С. 231], [11, С. 144], [12, С. 121].
На территории России 4 летальных случая от отравления данным соединением зарегистрировано в Курской и Белгородской областях, 2 случая со смертельным исходом имели место на территории Украины. По данным Киевского городского токсикологического центра среди отравлений пестицидами за период наблюдений с 1993 по 2013 год на отравления 2-ДМА-1,3-бис-(ФСТ)П приходится в среднем около 20% [13, С. 30], [14, С. 53], [15, С. 41].
Многообразие случаев отравления 2-ДМА-1,3-бис-(ФСТ)П, отмечаемых в Российской Федерации, многих странах Дальнего и Ближнего Зарубежья с полным основанием позволяют считать данный инсектицид важным объектом судебно-химического анализа и определяет необходимость изучения особенностей его извлечения из биоматериала, очистки и определения.
На сегодняшний день продолжают оставаться недостаточно изученными некоторые аспекты судебно-химического анализа 2-ДМА-1,3-бис-(ФСТ)П, состоящие в разработке методик его определения в биожидкостях и валидации этих методик.
Экспериментальная часть
Целью данного научного исследования явилась разработка методики определения 2-ДМА-1,3-бис-(ФСТ)П в крови и её валидация.
В качестве объекта исследованию был подвергнут (2-диметиламино-1,3-бис-(фенилсульфонилтио)пропан) (2-ДМА-1,3-бис-(ФСТ)П), ч., СОП 342-034-2003, с содержанием основного компонента не менее 97%). Его структурная формула:
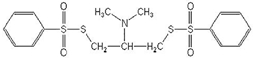
Рис. 1 – Брутто-формула: C17H21NO4S4, молярная масса: 431,6
Основываясь на результатах ранее проведённых исследований, как изолирующий агент был выбран этилацетат, преимуществами которого являются высокая извлекающая способность в отношении веществ нейтрального характера, в частности, 2-ДМА-1,3-бис-(ФСТ)П, и достаточный уровень чистоты получаемых извлечений [16, С. 205], [17, С. 354], [18, С. 47].
Для экспериментов формировали модельные смеси 2-ДМА-1,3-бис-(ФСТ)П с кровью человека (концентрация аналита 0,1%) и оставляли их на 90 мин при 18–22оС.
2-ДМА-1,3-бис-(ФСТ)П дважды по 3/4 часа извлекали из сформированных смесей этилацетатом при соотношении 2:1 между массами изолирующего агента и биожидкости. Оба извлечения объединяли, после чего определённый объём общего извлечения помещали на линию старта пластины «Сорбфил» ПТСХ-АФ-А-УФ и хроматографировали, элюируя смесью гексан-диоксан-пропанол-2-ацетон (8:3:0,8:0,8).
В потоке УФ-света (λ = 254 нм) на хроматограммах выявляли пятна с Rf=0,56±0,03, соответствующие 2-ДМА-1,3-бис-(ФСТ)П. Аналит вымывали из сорбента, помещая вырезанный фрагмент пластины с пятном в 95% этанол на ¼ часа, затем оценивали поглощение получаемого элюата (λ = 255 нм, прибор СФ-46, толщина рабочего слоя 10 мм). Количество извлечённого из биоматрицы 2-ДМА-1,3-бис-(ФСТ)П определяли по уравнению градуировочного графика. Придерживаясь указанной выше последовательности операций, исследовали влияние на полноту извлечения аналита из модельных композиций с кровью различных факторов.
В выявленных оптимальных условиях изучалась зависимость степени извлечения 2-ДМА-1,3-бис-(ФСТ)П от его содержания в биологической матрице. Исследовали модельные композиции 0,005- 0,2%-ной концентрации.
Осуществляли поиск приемлемых условий очистки 2-ДМА-1,3-бис-(ФСТ)П, выделенного из биожидкости, в макроколонке силикагеля L (160×10 мм, дисперсность частиц 0,040-0,100 мм) путём элюирования мало- и среднеполярными элюентами. Обнаруживали присутствие 2-ДМА-1,3-бис-(ФСТ)П во фракциях методом ТСХ (условия указаны выше).
Как метод идентификации и количественного определения 2-ДМА-1,3-бис-(ФСТ)П применена ВЭЖХ (прибор «Милихром»; УФ- детектор; колонка КАХ-1 62×2 мм с гидроксилированной неподвижной фазой «Силасорб - 600»).
Результаты предварительных исследований послужили основой для разработки методики определения 2-ДМА-1,3-бис-(ФСТ)П в цельной крови, которая валидировалась по известным принципам [19, С. 877], [20, С. 4], [21, С. 5].
Результаты и их обсуждение
Выявлено, что в значительной мере 2-ДМА-1,3-бис-(ФСТ)П извлекается из крови этилацетатом уже при условии, что настаивание биоматериала с изолирующим агентом проводится дважды, на каждом этапе выдерживается минимальное соотношение массы изолирующей жидкости и биоматрицы 2:1, а каждый этап длится как минимум 30 мин.
В оптимизированном варианте хроматографирования аналита в колонке силикагеля элюирование вначале осуществляется гексаном, после выхода 20 мл элюата слой растворителя над поверхностью сорбента удаляется, а элюирование продолжается смесью гексан – диоксан – пропанол-2 (8:3:0,6). С момента начала подачи второго элюента начинается сбор элюата фракциями по 2 мл. 2-ДМА-1,3-бис-(ФСТ)П обнаруживается во фракциях №№ 11-14 (21-28 мл).
Предложено определять 2-ДМА-1,3-бис-(ФСТ)П методом ВЭЖХ, элюируя аналит смесью трёх разнополярных растворителей гексан-диоксан-пропанол-2 (15:5:1), подаваемой со скоростью 6 мл/час при скорости ленты самописца - 720 мм/час и масштабе регистрации-0,8 ед.о.п. Интенсивность экстинкции элюата регистрируется при 256 нм.
Время удерживания аналита в приведённых условиях составляет 6,36 мин. Рассчитанные величины относительного удерживания, коэффициента ёмкости, и числа теоретических тарелок соответственно равны 1,53, 3,04 и 2257.
По результатам предварительных исследований была разработана методика определения 2-ДМА-1,3-бис-(ФСТ)П в крови на основе нормальнофазовой ВЭЖХ.
Методика определения 2-ДМА-1,3-бис-(ФСТ)П в крови. 10 г крови с исследуемым веществом полчаса подвергали обработке 20 г этилацетата, постоянно перемешивая смесь. Раствор сливали с твёрдых частиц, а твёрдый остаток повторно подвергали обработке тем же экстрагентом. Оба извлечения объединяли, пропускали через слой безводного сульфата натрия (высота слоя 1-1,5 см) в стеклянном фильтре, фильтрующий слой промывали 10 г этилацетата. Фильтраты сливали в выпарительную чашку, растворитель удаляли в токе воздуха (интервал температур 18-22оС). Остаток растворяли в 4 мл трихлорметана, 2 мл раствора вводили в 1 г силикагеля L 40/100 мкм и испаряли остатки трихлорметана из сорбента в токе воздуха.
В колонку размером 490×10 мм вносили вначале 9 г силикагеля типа L 40/100 мкм, после чего ещё 1 г силикагеля L 40/100 мкм, содержащего 2-ДМА-1,3-бис-(ФСТ)П, добавленный в виде трихлорметанового раствора. Вначале элюировали гексаном, а после выхода из колонки 20 мл элюата и удаления остатков гексана, находящегося над поверхностью сорбента, – системой гексан - диоксан – пропанол-2 (8:3:0,6 по объему). С момента начала подачи элюирующей системы выходящий из колонки элюат собирали 2 мл в отдельные мерные цилиндры. Фракции №№ 11-14 объединяли в выпарительной чашке и удаляли элюент в токе воздуха (режим комнатной температуры). Остаток обрабатывали 5 мл диоксана. 2,0 мл полученного раствора упаривали, поместив в выпарительную чашку, в токе воздуха при комнатной температуре. Остаток растворяли в смеси 1,0 мл диоксана и 0,2 мл пропанола-2, раствор разбавляли 3 мл гексана, переносили в мерную колбу внутренним объёмом 5 мл, после чего доводили содержимое колбы до метки смесью гексан-диоксан-пропанол-2 (15:5:1). 2-16 мкл содержимого колбы брали для хроматографирования.
Критерием для идентификации 2-ДМА-1,3-бис-(ФСТ)П явилось время удерживания (6,36±0,05). Вид хроматограммы 2-ДМА-1,3-бис-(ФСТ)П, извлечённого из крови, в присутствии внутреннего стандарта представлен на рис. 2.
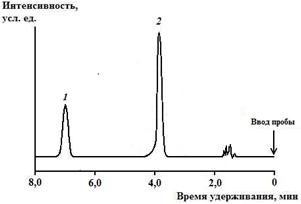
Рис. 2 – Хроматограмма (метод ВЭЖХ) 2-диметиламино-1,3-бис-(фенилсульфонилтио)пропана, извлечённого из крови (1), в присутствии внутреннего стандарта (тетраметилтиурамдисульфида) (2)
Оценку количественного содержания объекта исследования в биожидкости проводили, принимая во внимание площадь хроматографического пика и используя уравнение градуировочного графика.
Валидационные мероприятия
Осуществляли валидацию разработанной методики по критериям линейности, правильности, прецизионности, селективности, пределов обнаружения и определения.
Оценка линейности
В рамках каждого аналитического цикла готовили модельные композиции биожидкости (крови) и 2-ДМА-1,3-бис-(ФСТ)П с концентрацией аналита 3,125, 6,25, 10, 20, 40, 50, 70, 80 и 100 мкг/г, после чего оставляли их на 1,5 часа при 18-22оС. Затем изолировали 2-ДМА-1,3-бис-(ФСТ)П из данных модельных смесей, очищали, идентифицировали и количественно оценивали по приведённой выше схеме.
Для создания градуировочной модели принимали во внимание результаты 5 параллельных измерений каждой концентрации из 5 разных аналитических циклов. Рассчитанное уравнение регрессии (градуировочного графика) имеет вид: S= k·С+b = 0,064224·C+0,015659. В этом уравнении S – площадь пика, С – концентрация 2-ДМА-1,3-бис-(ФСТ)П в биожидкости, мкг/г. Градуировочный график изображён на рис. 3.
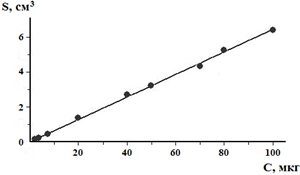
Рис. 3 – Градуировочный график зависимости площади хроматографического пика (S) от концентрации 2-диметиламино-1,3-бис-(фенилсульфонилтио)пропана в биожидкости (С, мкг/г)
Коэффициент корреляции (r) оказался равным 0,99918. Поэтому методика приемлема по критерию линейности.
Отклонения рассчитанных концентраций градуировочных смесей вещества с кровью от реального содержания в них 2-ДМА-1,3-бис-(ФСТ)П указаны в табл. 1.
Таблица 1 – Отклонения найденных концентраций градуировочных смесей с кровью от истинного содержания в них 2-диметиламино-1,3-бис-(фенилсульфонилтио)пропана
| Истинное содержание вещества, мкг/г | Найденное содержание вещества, мкг/г | Относительная погрешность, % |
| 2,25 | 1,9046 | -15,35 |
| 3,75 | 3,3254 | -11,32 |
| 7,50 | 6,5026 | -13,30 |
| 20 | 21,2611 | 6,31 |
| 40 | 41,9888 | 4,97 |
| 50 | 49,7327 | -0,54 |
| 70 | 67,4516 | -3,64 |
| 80 | 81,8245 | 2,28 |
| 100 | 99,5087 | -0,49 |
| Допустимые пределы: для наименьшей концентрации линейного диапазона – не более 20%, для остальных концентраций линейного диапазона – не более 15 % | ||
Оценка правильности и прецизионности
Правильность и прецизионность оценивали параллельно, используя объединенную выборку результатов анализа холостых образцов биоматрицы со стандартными добавками аналита.
При этом готовили модельные композиции биожидкости (кровь) и 2-ДМА-1,3-бис-(ФСТ)П с нижним, средним и высоким уровнями концентрации аналита (соответственно 10, 40 и 80 мкг/г).
Приготовленные модельные смеси выдерживали 1,5 часа при 18-22 оС. По прошествии данного промежутка времени образцы анализировали (проводили по пять параллельных измерений) в рамках двух аналитических циклов (исследование в первый день и исследование в последующий день) в соответствии с приводимой выше методикой.
Количество 2-ДМА-1,3-бис-(ФСТ)П в образцах находили по площади хроматографического пика, пользуясь уравнением регрессии, и делали пересчёт на навеску.
Результаты определения правильности и прецизионности разработанной методики отражены в таблице 2.
Таблица 2 – Оценка правильности и прецизионности методики определения 2-диметиламино-1,3-бис-(фенилсульфонилтио)-пропана в крови с использованием нормальнофазовой ВЭЖХ
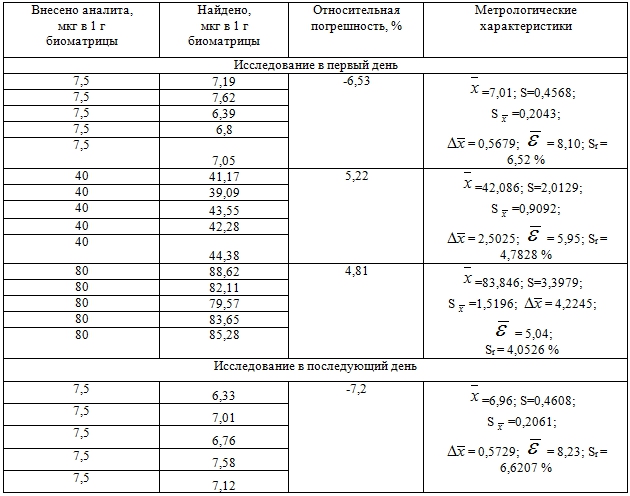
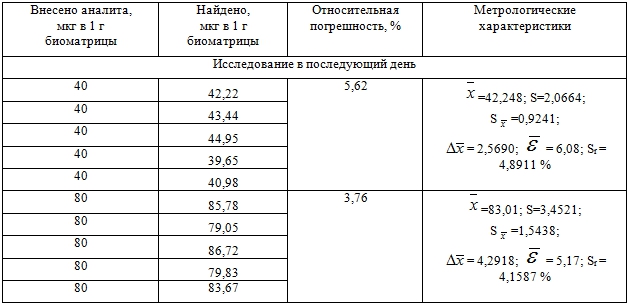
Цифровые данные таблицы свидетельствуют о соответствии методики оцениваемым параметрам.
Оценка селективности
По 6 чистых образцов крови и по 6 образцов крови с добавленным стандартом 2-ДМА-1,3-бис-(ФСТ)П в диапазоне концентраций 7,5∙10-6-8,0∙10-5 г/г. На хроматограммах извлечений из чистой крови отсутствовали пики со значениями времени удерживания, совпадающими с временем удерживания аналита или близких к этому значению. Это характеризует методику как селективную.
Предел обнаружения 2-ДМА-1,3-бис-(ФСТ)П в крови равен 1,75 мкг/г, предел количественного определения – 2,25 мкг/г.
Выводы
Для извлечения 2-диметиламино-1,3-бис-(фенилсульфонилтио)пропана из крови обосновано использование этилацетата. Установлены оптимальные параметры изолирования данным растворителем.
Предложен вариант исследования крови с целью подтверждения присутствия в ней вещества-объекта исследования на основе изолирования этилацетатом, очистки в колонке силикагеля L 40/100 мкм, идентификации и количественного определения методом ВЭЖХ.
Разработанная методика соответствует принятым критериям линейности, правильности, прецизионности, селективности. Величины пределов обнаружения и количественного определения составляют соответственно 1,75 мкг/г и 2,25 мкг/г биожидкости.
Список литературы / References
- Bensultap: Pub Chem. – URL: https://pubchem.ncbi.nlm.nih.gov/compound/Bensultap#section=Top (аccessed: 20.01.2018).
- Мельников Н.Н. Пестициды и регуляторы роста растений / Н.Н. Мельников, К.В. Новожилов, С.Р. Белан. – М.: Химия, 1995. – 575 с.
- Проскряков А.В. Эффективность банкола в борьбе с колорадским жуком / А.В. Проскряков, Д.В. Амирханов // Агрохимия. – 1991. – № 5. – С. 120-124.
- – URL: http://docbook.blog.163.com/blog/static/208326047201262412227365/ (аccessed: 20.01.2018).
- Civelek H.S. Effects of Some Plant Extracts and Bensultap on Trichoferus griseus (Fabricius, 1792) (Coleoptera: Cerambycidae) / H.S. Civelek, A.M. Çolak // World Journal of Agricultural Sciences. – 2008.– Vol. 4, N 6. – Р. 721-725.
- Summary of Toxity Studies on Bensultap. (Development Department, Plant Protection Research, AgroDivision, Taceda Chemical Industries, Ltd.) // J. Pesticide Sci. – 1989.– Vol. 14, N 4. – Р. 523-529.
- Kalyaniwala k. Cartap hydrochloride poisoning / K. Kalyaniwala, K. Abhilash, P.J. Victor // J assoc. Physicians. India. – 2016. – Vol.. 64, N 8. – Р. 91-92.
- Kumar A.S. Cartap poisoning: A rare case report / A.S. Kumar, D. Amalnath, T.K. Dutta // Indian J. Crit. Care Med. – 2011. – Vol.15, N 4. – Р. 233-235. doi:10.4103/0972-5229.92075
- Kurisaki E. Fatal human poisoning with PadanTM: a cartap-containing pesticide / Kurisaki, N. Kato, T. Ishida and others // Clinical Toxicology. – 2010. – Vol. 48, N 2. – Р. 153-155. doi:10.3109/15563650903505166
- Mikov M. Acute human poisoning with bensultap (Bancol) / M. Mikov, M. Jecez, J. Popovic // Arch. Toxicol. Kinet. Xenobiot. Metab. – 1997. – Vol. 5. – Р. 231-233.
- Park Y. Advanced analytical method of nereistoxin using mixed-mode cationic exchange solid-phase extraction and GC/MS / Y. Park, S. Choe, H. Lee and others // Forensic Sci. Int. – 2015. – Vol. 252. – Р. 143-149. doi: 10.1016/j.forsciint.2015.04.010
- Dasguptaa S. Pesticide poisoning of farm workers–implications of blood test results from Vietnam / S. Dasguptaa, C. Meisnera, D. Wheelera and others // International Journal of Hygiene and Environmental Health. – 2007. – Vol. 210, N 2. – Р. 121-132. doi:10.1016/j.ijheh.2006.08.006
- Григорьев А.М. Определение производных и метаболитов бенсультапа (банкола) хроматографическими методами / А.М. Григорьев, Г.В. Недовизина, М.В. Пирожков // Судебно-медицинская экспертиза. – – Т. 52, № 5. – С. 30-35.
- Курдиль Н.В. Особенности острых отравлений пестицидами в условиях города: карбаматы, пиретроиды, неоникотиноиды / Н.В. Курдиль, О.В. Иващенко, В.Ф. Струк и др. // Медицина неотложных состояний. – 2015. – № 4. – С. 51-57.
- Шорманов В.К. Судебно-химическое определение банкола / В.К. Шорманов, Ю.Н. Баранов, Е.П. Дурицын и др. // Судебно-медицинская экспертиза. – 2010. – Т. 53, № 6. – С. 39-41.
- Баранов Ю.Н. Определение банкола в крови / Ю.Н. Баранов, В.К. Шорманов, Е.А. Коваленко и др. // Перспективы развития современной медицины: материалы III Междунар. науч.-практ. конф. 11 декабря, 2016 г., Воронеж / Инновационный центр развития образования и науки. – Воронеж, 2016. – С. 204-208.
- Баранов Ю.Н. Изучение сохраняемости 2-диметиламино-1,3-бис-(фенилсульфонилтио) пропана в биологическом материале /Ю.Н. Баранов, В.К. Шорманов, А.П. Терских // Проблемы медицины в современных условиях: материалы Междунар. науч.-практ. конф. 10 июня 2014 г., Казань / Инновационный центр развития образования и науки. – Казань, 2014. – С. 353-356.
- Шорманов В.К. Особенности определения ТМТД в биологическом материале / В.К. Шорманов, А.В. Ким, Е.П. Дурицын // Судебно-медицинская экспертиза. – 2010. – Т. 53, № 2. – С. 45-49.
- Шорманов В.К. Применение методов обращенно-фазовой хроматографии для идентификации и количественного определения флутамида и близких по структуре веществ в биологических жидкостях / В.К. Шорманов, Ю.В. Андреева, Д.А. Герасимов и др. // Сорбционные и хроматографические процессы. – 2016. – Т. 16, № 6. – С. 868-879.
- Guidance for Industry: Bioanalytical method validation. Washington, DC: HHS/ FDA/ CDER, 2001. – 22 p.
- Guideline on validation of bioanalytical methods (draft). London: EMEA/CHMP/EWP, 2009. – 23 p.
Список литературы на английском языке / References in English
- Bensultap: Pub Chem. – URL: https://pubchem.ncbi.nlm.nih.gov/compound/Bensultap#section=Top (аccessed: 20.01.2018).
- Melnikov N.N. Pestitsidyi i regulyatoryi rosta rasteniy [Pesticides and plant growth regulators] / N.N. Melnikov, K.V. Novozhilov, S.R. Belan. – M.: Himiya, 1995. – 575 p. [in Russian]
- Proskryakov A.V. Effektivnost bankola v borbe s koloradskim zhukom [The effectiveness of the bancol in the fight against the Colorado potato beetle] / A.V. Proskryakov, D.V. Amirhanov // Agrohimiya. – 1991. – N 5. – P. 120-124. [in Russian]
- – URL: http://docbook.blog.163.com/blog/static/208326047201262412227365/ (аccessed: 20.01.2018).
- Civelek H.S. Effects of Some Plant Extracts and Bensultap on Trichoferus griseus (Fabricius, 1792) (Coleoptera: Cerambycidae) / H.S. Civelek, A.M. Çolak // World Journal of Agricultural Sciences. – 2008.– Vol. 4, N 6. – Р. 721-725.
- Summary of Toxity Studies on Bensultap. (Development Department, Plant Protection Research, AgroDivision, Taceda Chemical Industries, Ltd.) // J. Pesticide Sci. – 1989.– Vol. 14, N 4. – Р. 523-529.
- Kalyaniwala K. Cartap Hydrochloride Poisoning / К. Kalyaniwala, K. Abhilash, P.J. Victor // J Assoc. Physicians. India. – 2016. – Vol. 64, N 8. – Р. 91-92.
- Kumar A.S. Cartap poisoning: A rare case report / A.S. Kumar, D. Amalnath, T.K. Dutta // Indian J. Crit. Care Med. – 2011. – Vol.15, N 4. – Р. 233-235. doi:10.4103/0972-5229.92075
- Kurisaki E. Fatal human poisoning with PadanTM: a cartap-containing pesticide / Kurisaki, N. Kato, T. Ishida and others // Clinical Toxicology. – 2010. – Vol. 48, N 2. – Р. 153-155. doi:10.3109/15563650903505166
- Mikov M. Acute human poisoning with bensultap (Bancol) / M. Mikov, M. Jecez, J. Popovic // Arch. Toxicol. Kinet. Xenobiot. Metab. – 1997. – Vol. 5. – Р. 231-233.
- Park Y. Advanced analytical method of nereistoxin using mixed-mode cationic exchange solid-phase extraction and GC/MS / Y. Park, S. Choe, H. Lee and others // Forensic Sci. Int. – 2015. – Vol. 252. – Р.143-149. doi: 10.1016/j.forsciint.2015.04.010
- Dasguptaa S. Pesticide poisoning of farm workers–implications of blood test results from Vietnam / S. Dasguptaa, C. Meisnera, D. Wheelera and others // International Journal of Hygiene and Environmental Health. – 2007. – Vol. 210, N 2. – Р. 121-132. doi:10.1016/j.ijheh.2006.08.006
- Grigorev A.M. Opredelenie proizvodnyih i metabolitov bensultapa (bankola) hromatograficheskimi metodami [Determination of derivatives and metabolites of bensultap (bancol) by chromatographic methods] / A.M. Grigorev, G.V. Nedovizina, M.V. Pirozhkov // Sudebno-meditsinskaya ekspertiza. – 2009. – Vol. 52, N 5. – P. 30-35. [in Russian]
- Kurdil N.V. Osobennosti ostryih otravleniy pestitsidami v usloviyah goroda: karbamatyi, piretroidyi, neonikotinoidyi [Peculiarities of acute poisoning by pesticides in urban conditions: carbamates, pyrethroids, neonicotinoids] / N.V. Kurdil, O.V. Ivaschenko, V.F. Struk and others // Meditsina neotlozhnyih sostoyaniy. – 2015. – N 4. – P. 51-57. [in Russian]
- Shormanov V.K. Sudebno-himicheskoe opredelenie bankola [Forensic chemical definition of the bancol] / V.K. Shormanov, Yu.N. Baranov, E.P. Duritsyin and others // Sudebno-meditsinskaya ekspertiza. – 2010. – Vol. 53, N 6. – P. 39-41. [in Russian]
- Baranov Yu.N. Opredelenie bankola v krovi [Definition of Bankole in the blood] / Yu.N. Baranov, V.K. Shormanov, E.A. Kovalenko and others // Perspektivyi razvitiya sovremennoy meditsinyi: materialyi III Mezhdunar. nauch.-prakt. konf. 11 dekabrya, 2016 g., Voronezh [Prospects for the development of modern medicine: materials of the International Research Institute of Intern. scientific-practical. Conf. December 11, 2016, Voronezh] / Innovatsionnyiy tsentr razvitiya obrazovaniya i nauki [Innovative Center for the Development of Education and Science]. – Voronezh, 2016. – pp. 204-208. [in Russian]
- Baranov Yu.N. Izuchenie sohranyaemosti 2-dimetilamino-1,3-bis-(fenilsulfoniltio) propana v biologicheskom materiale / Yu.N. Baranov, V.K. Shormanov, A.P. Terskih [A study of the retention of 2-dimethylamino-1,3-bis (phenylsulfonylthio) propane in a biological material] // Problemyi meditsinyi v sovremennyih usloviyah: materialyi Mezhdunar. nauch.-prakt. konf. 10 iyunya 2014 g., Kazan [Problems of medicine in modern conditions: materials of Intern. scientific-practical. Conf. June 10, 2014, Kazan] / Innovatsionnyiy tsentr razvitiya obrazovaniya i nauki [Innovative Center for the Development of Education and Science]. – Kazan, 2014. – pp. 353-356. [in Russian]
- Shormanov V.K. Osobennosti opredeleniya TMTD v biologicheskom materiale [Features of TMTD determination in biological material] / V.K. Shormanov, A.V. Kim, E.P. Duritsyin // Sudebno-meditsinskaya ekspertiza. – 2010. – 53, N 2. – P. 45-49. [in Russian]
- Shormanov V.K. Primenenie metodov obraschenno-fazovoy hromatografii dlya identifikatsii i kolichestvennogo opredeleniya flutamida i blizkih po strukture veschestv v biologicheskih zhidkostyah [Application of reversed-phase chromatography methods for identification and quantitative determination of flutamide and structurally similar substances in biological fluids] / V.K. Shormanov, Yu.V. Andreeva, D.A. Gerasimov and others // Sorbtsionnyie i hromatograficheskie protsessyi. – 2016. – 16, N 6. – P. 868-879. [in Russian]
- Guidance for Industry: Bioanalytical method validation. Washington, DC: HHS/ FDA/ CDER, 2001. – 22 p.
- Guideline on validation of bioanalytical methods (draft). London: EMEA/CHMP/EWP, 2009. – 23 p.
