THE INFLUENCE OF DIFFERENT CONCENTRATIONS OF NITRIC OXIDE AT ACTYVITY OF ANTIOXIDANT ENZYMES IN THE BLOOD IN VITRO
Диденко Н.В.,1 Соловьева А.Г.2
1 ORCID: 0000-0001-6653-1267, 2 ОRCID: 0000-0001-6890-4530, Кандидат биологических наук, ФГБУ «Приволжский Медицинский Исследовательский Центр» Минздрава России
ВЛИЯНИЕ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ ОКСИДА АЗОТА НА АКТИВНОСТЬ АНТИОКСИДАНТНЫХ ФЕРМЕНТОВ В КРОВИ IN VITRO
Аннотация
В статье рассмотрено – воздействие газового потока, содержащего оксид азота (NO) в концентрациях 20, 50, 75 и 100 ррm на активность супероксиддисмутазы (СОД), каталазы, глутатионредуктазы (ГР) в крови в условиях in vitro. Показано, что при содержании NO в концентрации 100 ррm происходит защелачивание крови. При этом выявлено, что по сравнению с меньшими концентрациями NO (20, 50, 75 ррm) при использовании 100 ppm NO, происходит одновременное увеличение в крови активности всех перечисленных антиоксидантных ферментов.
Ключевые слова: оксид азота, супероксиддисмутаза, каталаза, глутатионредуктаза.
Didenko N.V.1, Soloveva A.G.2
1 ORCID: 0000-0001-6653-1267, 2 ОRCID: 0000-0001-6890-4530, PhD in Biology, Nizhny Novgorod Volga Medical Research Centre
THE INFLUENCE OF DIFFERENT CONCENTRATIONS OF NITRIC OXIDE AT ACTYVITY OF ANTIOXIDANT ENZYMES IN THE BLOOD IN VITRO
Abstract
The action of different nitric oxide concentrations (20, 50, 75 и 100 ррm) at actyvity superoxide dismutase, catalase, glutathione reductase in blood in vitro was considered in the article. It was stated, that at using of nitric oxide concentration 100 ppm alkalization of blood arise. We estimated actyvity of superoxide dismutase, catalase, glutathione reductase. It was stated, that blood processing with 100 ppm of NO leads to stimulation enzymes of antioxidant system.
Keywords: nitric oxide, superoxide dismutase, catalase, glutathione reductase.
Большой интерес к биологии оксида азота обусловлен широким спектром эффектов данной молекулы, являющийся важным для физиологии и жизнеспособности организма. NО представляет собой нейтральный радикал с неспаренным электроном, как межклеточный и внутриклеточный мессенджер, он участвует в регуляции дыхания, поддержании иммунного статуса, сердечно-сосудистом гомеостазе, мерцании ресничек эпителия бронхов, клеточном апоптозе [1]. Но в зависимости от своей концентрации, времени воздействия и условий обмена в различных типах клеток и тканях организма оксид азота также может участвовать и в патологических процессах. Несмотря на то, что NO является радикалом, он ингибирует опосредуемые Fe3+ оксидативные реакции и тем самым проявляет антиоксидантное действие [5]. В связи с чем, большой интерес представляет изучение активности ферментов антиоксидантной системы организма при воздействии на него оксида азота.
Целью работы явилось изучение воздействия различных концентраций оксида азота на активность супероксиддисмутазы, каталазы, глутатионредуктазы донорской крови в условиях in vitro.
Материал и методы
Эксперименты были проведены на консервированной крови от пациентов-доноров (n =15). Генерацию оксида азота производили с помощью специализированного аппарата, разработанного в РФЯЦ (Саров). Был произведен непосредственный барботаж образцов крови (5мл) газовой смесью в течение 2 минут. В качестве действующих концентраций использованы 20, 50, 75 и 100 ppm NO. Активность СОД определяли по ингибированию образования продукта аутокисления адреналина[7]. Активность каталазы оценивали спектрофотометрическим методом, основанным на определении скорости разложения перекиси водорода каталазой исследуемого образца с образованием воды и кислорода [6]. Активность ГР исследовали методом, основанным на изменении абсорбции раствора при образовании окисленной формы НАД⁺[6]. рН крови определяли с помощью рН-метра InoLab 7110 (Германия).
Результаты исследований подвергали статистической обработке с использованием t-критерия Стьюдента [2].
Результаты исследования и их обсуждение
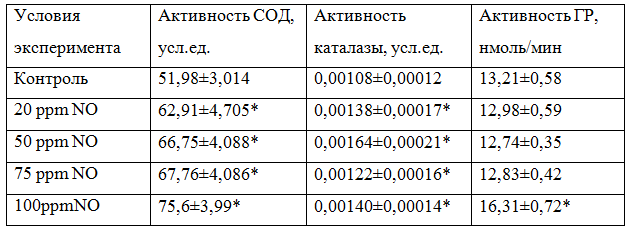
В результате эксперимента была прослежена прямая зависимость между концентрацией NO в газовой смеси, которой воздействовали на донорскую кровь и активностью СОД как общей, так и удельной. Так, общая активность фермента в крови, на которую воздействовали газовой смесью, содержащей 20 ррm NO статистически значимо возросла по сравнению с контролем в 1,21 раза, при 50ррm - в 1,28 раза (р=0,019), при 75 ррm - в 1,3 раза (р=0,021), а при 100 ppm - в 1,45 раза (р=0,029) (табл.1).
Таблица 1 - Общая активность супероксидисмутазы, каталазы, глутатионредуктазы в донорской крови при воздействии на нее оксида азота в условиях in vitro
Примечание: * - различия статистически значимы по сравнению с контролем (Р≤ 0,05)
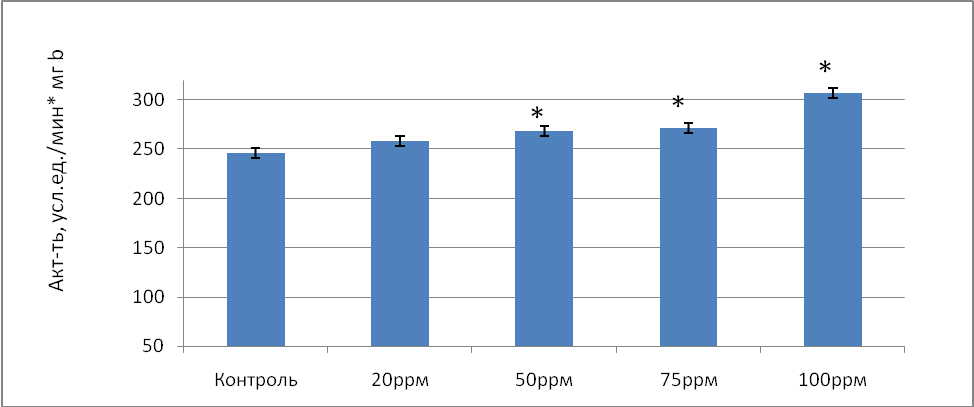
Ту же тенденцию можно проследить и по удельной активности СОД, с ростом исследуемых концентраций оксида азота от 20 до 100ppm в 1,05 раза (р=0,075), в 1,09 раза (р=0,031), в 1,1 раз (р=0,028), в 1,25 раз (р=0,034) соответственно по сравнению с контролем (рис.1).
Рис.1 Удельная активность супероксиддисмутазы (усл.ед./мин*мг b) в донорской крови при воздействии на нее оксида азота в условиях in vitro.
Примечание: * - различия статистически значимы по сравнению с контролем (Р≤ 0,05)
Такое увеличение активности супероксиддисмутазы как общей, так и удельной можно объяснить способностью фермента в присутствии высоких концентраций NO образовывать с супероксиданионом пероксинитрит ОNОO- [9]. Интересно, что при избытке NО относительно О2-, например, при увеличении активности СОД, пероксинитрит восстанавливается до NО2- ,который является менее реакционным метаболитом оксида азота и, таким образом, уменьшает токсичную нагрузку на организм [8].
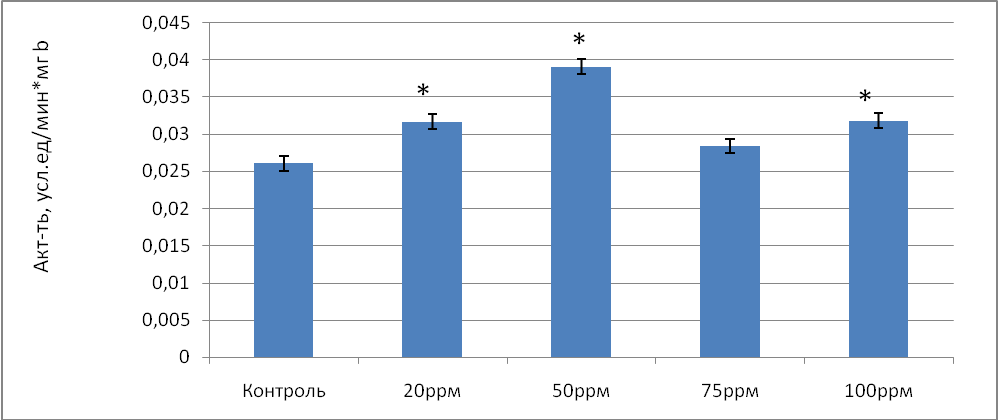
Общая активность каталазы в донорской крови, обработанной газовой смесью, содержащей 20 ррm NO возросла статистически значимо по сравнению с контролем в 1,28 раза, а удельная активность фермента в 1,21 раза. Однако максимальное увеличение общей активности каталазы отмечено при концентрации NO 50 ppm и составило 1,52 раза (р=0,024) по сравнению с контролем. Удельная активность фермента так же была максимальна при концентрации NO 50 ppm и составила 0,0318 усл.ед/мин*мгb (рис.2.) .
Рис.2 Удельная активность каталазы (усл.ед./мин*мг b) в донорской крови при воздействии на нее разных концентраций оксида азота в условиях in vitro.
Примечание: * - различия статистически значимы по сравнению с контролем (Р≤ 0,05)
Уменьшение общей активности каталазы происходит при содержании NO 75 ppm и составляет 1,09 раза (р=0,033) по сравнению с контролем. Такой спад активности энзима так же доказывает, что при высокой концентрации NO продуктом реакции СОД является уже не пероксид, как это должно быть в норме, а пероксинитрит [3]. Однако уже при 100 ppm NO общая и удельная активность каталазы статистически значимо возросла в 1,23 и в 1,22 соответственно по сравнению с контролем. Как известно, каталаза не только выполняет функции антирадикальной защиты, устраняя активные формы кислорода, но и принимает участие в инициации оксигенации гемоглобина [4]. В реакции с оксигемоглобином NO окисляется в нитрат и образует метгемоглобин, что нарушает кислородтранспортную функцию крови и приводит к гемической гипоксии. Возможно, чтобы предотвратить возникновение гипоксии, включается компенсаторный механизм посредствам увеличения активности каталазы.
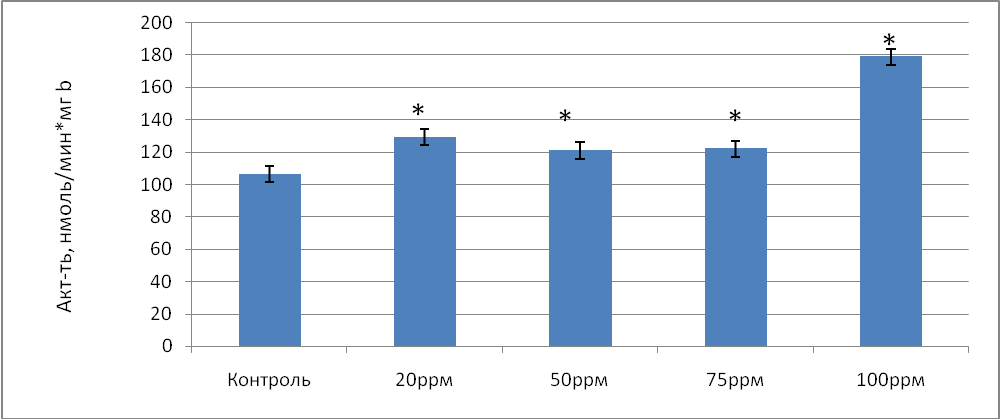
Общая активность глутатионредуктазы в донорской крови, обработанной газовой смесью, содержащей концентрацию NO 20 ррm уменьшилась по сравнению с контролем в 1,02 раза (р=0,063), при концентрации NO 50 ppm - в 1,04 раза ( р=0,054), при содержании NO 75 ррm - в 1,03 раза ( р=0,061). Таким образом, воздействие на кровь газовой смесью, содержащей NO в концентрации 20, 50 и 75 ррm не вызвало статистически значимых изменений ГР. Однако, при концентрации NO 100 ppm общая активность фермента возросла в 1,23 раза (р=0,035) по сравнению с контролем. Удельная же активность ГР, наоборот, возросла при концентрации NO 20 ppm в 1,21 раза (р=0,023), при концентрации NO 50 ррm - в 1,14 раза (р=0,037), при концентрации NO 75 ppm - в 1,15раза (р=0,029) по сравнению с контролем (рис.3).
Рис.3 Удельная активность глутатионредуктазы (нмоль/мин*мг b) в донорской крови при воздействии на нее концентраций оксида азота в условиях in vitro.
Примечание: * - различия статистически значимы по сравнению с контролем (Р≤ 0,05)
Максимальное увеличение удельной активности ГР наблюдалось при содержании NO 100 ppm и составило 1,67 раза (р=0,041) по сравнению с контролем. Полученные результаты изменения активности ГР вероятно связано с ростом рН при использовании NO в концентрации 100 ррm. Рост данного показателя приводит к увеличению количества восстановленной формы НАДН, являющейся в свою очередь коферментом для ГР. Проведенные исследования показали, что при 100 ррm NO рН в крови статистически значимо увеличивается в 1,03 раза (табл.2)
Таблица 2. - Изменение показателя рН крови при воздействии NO
Заключение
Таким образом показано, что при воздействии на кровь в условиях in vitro газового потока, содержащего NO в концентрации 100 ррm, происходит её защелачивание. При этом отмечено одновременное увеличение в крови таких антиоксидантных ферментов, как супероксиддисмутаза, каталаза, глутатионредуктаза при использовании 100 ppm NO по сравнению с меньшими концентрациями оксида азота (20, 50, 75 ррm).
Литература
- Ванин А.Ф. Оксид азота в биомедицинских исследованиях // Вестн. Росс. АМН. – 2000. – № 4. – С. 3-5.
- Гланц С. Медико-биологическая статистика. - М.: Практика, 1999. - 459с.
- Диденко Н.В., Соловьева А.Г. Активность и получение частично очищенного препарата митохондриальной супероксиддисмутазы печени при термической травме // Фундаментальные исследования. 2013.№7-2. С.305-309.
- Зинчук В.В., Борисюк М.В. Роль кислородсвязующих свойств крови в поддержании прооксидантно-антиоксидантного равновесия организма//Успехи физиол. наук. 1999. Т. 30. № 3. С. 38-48.
- Кульманова М.У., Касимова Г.З., Сабирова Р.А. Оксид азота и его роль в развитии патологических состояний. Ташкент: Ташкентская медицинская академия.-2014.-169с.
- Сибгатуллина Г.В., Хаертдинова Л.Р., Гумерова Е.А. и др. Методы определения редокс-статуса культивируемых клеток растений: учебно-методическое пособие,-Казань: Казанский (Приволжский) Федеральный Университет, 2011.-61с
- Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы// Вопросы медицинской химии. 1999. Т 45,№ 3. С.109-116.
- Fukai Т., Siegfried M. R., Ushio-Fukai M. et al. Regulation of the vascular extracellular superoxide dismutase by nitric oxide and exercise training. //J. Clin. Invest., 2000.№ 105. Р.1631 — 1639.
- Muijsers R.B.R., Folkets G., Henricks P.A.J. et al. Peroxynitrite: a two-faced metabolite of nitric oxide // Life Sci., 1997; 60:1833-1845.
References
- Vanin A.F.Oksid azota v biomedicinskih issledovanijh // Vestn. Ross.AMN. – 2000. – № 4. – S. 3-5.
- Glantc S. Mediko-biologicheskaja statistika.- Moscova, Praktika, 1999. 459s.
- Didenko N.V., Solov᾽eva A.G. Aktivnost᾽ i poluchenie chastichno ochishennogo preparata mitohondrial᾽noj superoksiddismutazy pecheni pri termicheskoj travme // Fundamental᾽nye issledovanija. 2013. №7-2. S. 305-309.
- Zinchuk V.V., Borisjuk M.V. Rol᾽ kislorodsvjazujushih svoistv krovi v podderzhanii prooksidantno-antioksidantnogo ravnovesija organizma //Uspehi fiziolog. nauk. 1999. Т. 30. № 3. S. 38-48.
- Kul᾽manova M.U., Kasimova G.Z., Sabirova R.A. Oksid azota i ego rol᾽ v razvitii patalogicheskih sostojanij. Tashkent: Tashkentskaja medicinskaja akademija-2014.-169s.
- Sibgatullina G.V., Haertdinova L.R., Gumerova E.A. I dr. Metody opredelenija redoks-statusa rul᾽tiviruemyh kletok rastenij: uchebno-metodicheskoe posobie,-Kazan᾽: Kazanskij (Privolzhskij) Federal᾽nyj Universitet, 2011.-61s.
- Sirota T.V. Novyj podhod v issledovanii processa autookislenija adrenalina I ego ispol᾽zovanie dlja izmerenija aktivnosti superoksiddismutazy // Voprosy medicinskoj himii. 1999. Т 45, № 3. S. 109-116.
- Fukai Т., Siegfried M. R., Ushio-Fukai M. et al. Regulation of the vascular extracellular superoxide dismutase by nitric oxide and exercise training. //J. Clin. Invest., 2000.№ 105. Р.1631 — 1639.
- Muijsers R.B.R., Folkets G., Henricks P.A.J. et al. Peroxynitrite: a two-faced metabolite of nitric oxide // Life Sci., 1997; 60:1833-1845.