PHYSIOLOGICAL RESPONSES OF MICE AFTER DIRECT EXPOSURE TO NANOSECOND REPETITIVELY-PULSED MICROWAVE RADIATION IN THE EPIDIDYMAL ADIPOSE TISSUE
Керея А.В.1, Большаков М.А.2, Кутенков О.П.3, Ростов В.В.4
1 ORCID: 0000-0003-4857-935X, Младший научный сотрудник, 2 Доктор биологических наук, профессор, 3 Ведущий инженер, 4 Доктор физико-математических наук, профессор, Институт сильноточной электроники Сибирского отделения Российской академии наук
ФИЗИОЛОГИЧЕСКИЕ РЕАКЦИИ МЫШЕЙ ПОСЛЕ ПРЯМОГО ВОЗДЕЙСТВИЯ НАНОСЕКУНДНЫМ ИМПУЛЬСНО-ПЕРИОДИЧЕСКИМ МИКРОВОЛНОВЫМ ИЗЛУЧЕНИЕМ НА ЭПИДИДИМАЛЬНУЮ ЖИРОВУЮ ТКАНЬ
Аннотация
Исследовано влияние на эпидидимальную жировую ткань мышей ежедневного в течение 10 дней воздействия 4000 импульсов наносекундного импульсно-периодического микроволнового излучения (ИПМИ) c частотами повторения 6, 13 и 22 имп./с, пиковой плотностью потока мощности (пППМ) 1500 Вт/см2. Реакции лабораторных мышей после прямого воздействия оценивались по поведению животных и уровню лептина и кортикостерона в крови. Установлено наличие физиологических реакций, зависящих от частоты повторения импульсов.
Ключевые слова: импульсное микроволновое излучение, двигательная активность, лептин.
Kereya A.V.1, Bolshakov M.A.2, Kutenkov O.P.3, Rostov V.V.4
1 ORCID: 0000-0003-4857-935X, Junior Researcher, 2 PhD in Biology, Professor, 3 Lead Engineer, 4 PhD in Physics and Mathematics, Professor, Institute of High Current Electronics of Siberian Branch of the Russian Academy of Sciences
PHYSIOLOGICAL RESPONSES OF MICE AFTER DIRECT EXPOSURE TO NANOSECOND REPETITIVELY-PULSED MICROWAVE RADIATION IN THE EPIDIDYMAL ADIPOSE TISSUE
Abstract
The purpose was to study the effect of 10-day daily exposure of epididymal adipose tissue of mice to repetitive pulsed microwaves (RPM) with a pulse repetition frequency of 6, 13, 22 Hz and peak power density of 1500 W/cm2. The RPM effect was judged from animal behavior and the level of leptin and corticosterone in the blood. Physiological responses depend on the pulse repetition frequency.
Keywords: repetitively-pulsed microwave radiation, physical activity of mice, leptin.
Результаты исследования биологического действия наносекундных импульсно-периодических электромагнитных излучений показали [1], что жировая ткань мышей после воздействия на головной мозг реагирует изменением массы эпидидимального жира. В связи с этим объективно возник вопрос о реакции жировой ткани на прямое импульсно-периодическое электромагнитное воздействие. Ранее было показано [2, 3], что прямое воздействие на эпидидимальную жировую ткань наносекундным импульсно-периодическим микроволновым излучением (ИПМИ) вызывает также изменение размеров адипоцитов. Результат влияния ИПМИ на жировую ткань должен проявиться в широком спектре реакций всего организма, исходя из того, что в недавних исследованиях выяснилось, что жировая ткань посредством синтеза большого количества сигнальных веществ, факторов и регуляторов метаболизма может выполнять функцию нейроэндокринного органа, оказывая влияние на весь организм, в том числе и на головной мозг [4, 5]. Считается, что передача нейроэндокринных сигналов, обусловленных состоянием жировой ткани или ее изменением, будет влиять на деятельность головного мозга [6]. Следовательно, реакция жировой ткани на воздействие наносекундного ИПМИ может обеспечивать соответствующее изменение состояния всего организма. Гормон лептин является связующим звеном в регуляции состояния жировой ткани и деятельности головного мозга. Играя сигнальную роль, лептин постоянно информирует центральную нервную систему о состоянии энергетического статуса в организме и может оказывать на него модулирующее влияние, в том числе способствующее снижению количества жировой ткани [7]. Он продуцируется адипоцитами и участвует в нейроэндокринных процессах посредством лептиновых рецепторов, присутствующих в аркуатном и вентромедиальном ядрах гипоталамуса, в которых локализованы центры голода и насыщения [8]. При этом лептин способен подавлять синтез нейропептида-Y, продуцируемого нейронами гипоталамуса, что приводит к снижению аппетита, повышению тонуса симпатической нервной системы и изменению обмена веществ в периферических органах и тканях, а также расходованию энергии [9]. Результаты предыдущих экспериментов показали, что после облучения головного мозга мышей наносекундным ИПМИ снижается потребление пищи у животных на фоне изменения концентрации лептина в крови [10], можно допустить, что воздействие ИПМИ способно вмешиваться в функциональную связь между мозгом и жировой тканью.
В связи с вышеизложенным было предположено, что облучение непосредственно эпидидимальной жировой ткани мышей ИПМИ должно сопровождаться изменением деятельности головного мозга или его отдельных структур, что может проявляться в изменении поведения животных, их двигательной активности, изменении уровня гормона лептина в сыворотке крови.
Материалы и методы
Эксперименты выполнены на 48 беспородных белых мышах-самцах массой 25–30 г. Животные содержались в стандартных условиях при постоянной температуре и влажности, в условиях светового режима 12:12, пища и вода были доступны в любое время суток. В ходе опытов во всех случаях соблюдались правила и рекомендации гуманного обращения с лабораторными животными [11]. Эксперименты проводились в одно и то же время суток (утренние часы с 9 до 11 часов утра). Для каждого из режимов воздействия формировались группы облученных и ложнооблученных (ЛО) животных. Последние подвергались всем манипуляциям, что и облученные, кроме процесса включения источника ИПМИ. Длительность разового облучения варьировала от 3 до 10 минут в зависимости от частоты повторения импульсов.
Источником ИПМИ служил лабораторный генератор на основе импульсного магнетрона МИ-505 (Россия, несущая частота 10 ГГц, длительность импульсов 100 нс). В ходе воздействия ИПМИ непосредственно на эпидидимальную жировую ткань животные в пластиковых контейнерах помещались над открытым концом волновода. Для обеспечения локального воздействия на ткань и устранения возможности облучения всего организма мышей тело на время экспозиции покрывалось радиопоглощающим материалом. В таком варианте жировая ткань животных подвергалась в течение 10 дней ежедневному однократному воздействию ИПМИ (4000 импульсов за ежедневный сеанс) с пиковой плотностью потока мощности (пППМ) 1500 Вт/см2 и частотами повторения 6, 13, 16 имп./с. Интенсивность воздействия оценивалась по методике, описанной в [12]. Выбор частот повторения импульсов был обусловлен результатами предыдущих экспериментов, в которых воздействие на мозг с этими частотами наиболее эффективно изменяло как поведенческие реакции в «открытом поле», так и динамику общей двигательной активности [10, 13]. Поэтому эффекты оценивались по изменению поведения мышей в «открытом поле», динамике общей двигательной активности, а также содержанию гормонов лептина и кортикостерона.
Поведенческая активность мышей в «открытом поле» фиксировалась с помощью модифицированной методики, описанной в [10]. Выявление динамики поведенческих эффектов ИПМИ, проведенное в работе, решалось на основе оценки общей двигательной активности лабораторных мышей, описанной в [13]. Содержание гормонов лептина и кортикостерона в сыворотке крови облученных и ложнооблученных мышей определялось с помощью твердофазного иммуноферментного «сэндвич» метода (ELISA) [14]. Процедура выполнения иммуноферментного анализа проводилась по инструкциям, предлагаемым производителями тест-систем («DRG», Германия, «IDS», Великобритания). Уровень гормонов определялся спектрофотометрически путем измерения оптической плотности проб с помощью планшетного фотометра «StatFax 303 Plus» (США) при длине волны 450 нм. Концентрация гормонов вычислялась по калибровочной кривой из набора.
Статистическая обработка полученных результатов проводилась с помощью пакета прикладных программ «Statistica 8.0». Статистическая значимость различий между анализируемыми показателями животных из облученных и ложнооблученных выборок определялась с помощью непараметрического U-критерия Манна-Уитни при уровне значимости p≤0.05.
Результаты исследования
Анализ поведения мышей в «открытом поле» после десятидневного воздействия на эпидидимальную жировую ткань мышей позволил установить наличие изменений в ряде поведенческих компонент у животных. После воздействия с частотами 6, 13 и 22 имп./с наблюдалось снижение горизонтальной активности у мышей (Рис. 1), что соответствовало аналогичному снижению после облучения головного мозга [10].
Рис. 1 - Горизонтальная активность мышей в «открытом поле» после облучения ИПМИ эпидидимальной жировой ткани. Примечание: представлены среднеарифметические значения показателя ± ошибка среднего; * – различия статистически значимы по отношению к показателям ЛО животных (р≤0,05)
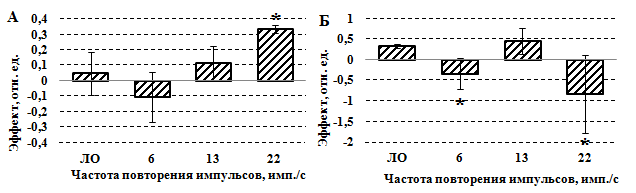
Однако изменения норковой активности и актов дефекации/уринации у мышей носили противоположный характер относительно аналогичных компонент в экспериментах с воздействием на головной мозг [10]. После облучения жировой ткани ИПМИ с частотой 22 имп./с наблюдалось увеличение норковой активности (Рисунок 2 А), а также снижение количества актов дефекаций/уринаций у мышей (Рисунок 2 Б). Последнее также снижалось после облучения с частотой повторения 6 имп./с.
Рис. 2 - Норковая активность (А) и акты дефекаций/уринаций (Б) у мышей в «открытом поле» после облучения ИПМИ эпидидимальной жировой ткани. Примечание: обозначения как на рисунке 1.
Вертикальная компонента поведения и акты груминга в «открытом поле» после облучения статистически значимо не изменялись.
Изменение динамики общей двигательной активности мышей в течение десятисуточного эксперимента имело менее выраженный характер в сравнении с эффектами воздействия на головной мозг. После облучения с частотой 6 имп./с происходило начиная с 5-х суток воздействия постепенное уменьшение количества актов движений у мышей (Рис. 3 А). Воздействие с частотой 13 имп./с вызывало снижение суточной динамики, которое наблюдалось только на 3 и 6 сутки (Рис. 3 Б). Однако при облучении с частотой 22 имп./с на 5, 9 и 10 день эксперимента, напротив, наблюдался противоположный эффект, то есть увеличение суммарной двигательной активности (Рис.3 В).
Рис. 3 - Динамики изменения общей двигательной активности мышей в течение 10 дней облучения эпидидимальной жировой ткани ИПМИ с пППМ 1500 Вт/см2 и частотами 6, 13 и 22 имп./с; * – различия статистически значимы по отношению к показателям ЛО животных (р≤0,05)
Поскольку, как уже отмечалось выше, лептин выступает ключевым агентом между жировой тканью и головным мозгом, был измерен его уровень в сыворотке крови мышей после непосредственного облучения эпидидимальной жировой ткани. Из литературы также известно, что на состояние жировой ткани влияет наличие или отсутствие стресса в организме [8], поэтому уточнялась возможность развития стресса у мышей при непосредственном воздействии на эпидидимальную жировую ткань. Для проверки этого предположения был измерен уровень кортикостерона в сыворотке крови животных, как общепринятого индикатора стресса у мелких грызунов (таб. 1).
Таблица 1. Влияние ИПМИ на соджержание кортикостерона и лептина в сыворотке крови мышей после облучения эпидидимальной жировой ткани
Оценка содержания гормонов лептина и кортикостерона в сыворотке крови мышей после десятидневного облучения эпидидимальной жировой ткани продемонстрировала изменение и зависимость эффектов от частоты повторения импульсов. При облучении с частотой 13 имп./с наблюдалось значимое снижение содержания лептина, но наблюдалась некоторая тенденция к увеличению его уровня после воздействия с частотами 6 и 22 имп./с. Воздействие с частотой повторения 22 имп./с значимо увеличивало уровень лептина в сыворотке крови. После воздействия с частотами 6 и 13 имп./с уровень кортикостерона также увеличивался, что указывало на развитие стресса в организме животных (таб. 1). После облучения с частотой 22 имп./с кортикостерон понижался. Причиной этого могло быть истощение естественного пула этого гормона в состоянии сильного стресса.
Обсуждение
Результаты изучения поведенческой активности животных в «открытом поле», общей двигательной активности и уровня гормонов лептина и кортикостерона в сыворотке крови после облучения эпидидимальной жировой ткани, в целом, подтвердили предположение об участии жировой ткани как нейроэндокринного органа в реализации нейрофизиологических эффектов наносекундного ИПМИ. Разнонаправленное изменение уровня лептина в сыворотке крови предполагает возможность формирования противоположных эффектов. Повышение уровня кортикостерона относительно ложнооблученных животных указало на возможность развития стресса в организме после воздействия на эпидидимальную жировую ткань. Противоположные эффекты реагирования в «открытом поле» после воздействия на мозг по сравнению с воздействием на жировую ткань, меньшая степень выраженности эффекта общей двигательной активности и сопоставимое изменение уровня кортикостерона и лептина – все это определяет характер влияния ИПМИ на процессы взаимодействия «головной мозг – жировая ткань», как сложный и неоднозначный. По-видимому, изменение состояния жировой ткани может оказать влияние на секрецию различных сигнальных веществ, которые связываясь с рецепторами в структурах головного мозга, информируют центральную нервную систему о состоянии энергетического статуса в организме и могут оказывать на него модулирующее влияние. Тем не менее, эффект такого взаимодействия выявляется, и это обстоятельство должно учитываться при исследовании физиологических реакций на воздействие наносекундным импульсно-периодическим микроволновым излучением как центральной нервной системы и головного мозга, так и жировой ткани.
Литература
- Материалы VI международной научно-практической конференции «Медицинские и экологические эффекты ионизирующего излучения (MEEIR-VI). Северск-Томск, 2013. С. 40–41
- Kereya A.V., Bolshakov M.A., Zharkova L.P., Ivanov V.V., Knyazeva I.R., Kutenkov O.P., Rostov V.V. Morphometry of the response of mice epididymal adipose tissue to nanosecond repetitive pulsed microwaves // Research Journal of International Studies. – 2014. №12 (31). – P. 32–36.
- Керея А.В., Большаков М.А., Жаркова Л.П., Иванов В.В., Князева И.Р., Кутенков О.П., Ростов В.В., Семенова Ю.Н. Эффект воздействия наносекундного импульсно-периодического микроволнового излучения на эпидидимальную жировую ткань мышей // Радиационная биология. Радиоэкология, 2014, Т. 54, № 6, С. 606–612
- Fruhbeck G., Gomes-Ambrosi J., Muruzabal F.J. et al. The adipocyte: a model for integration of endocrine and metabolic signaling in energy metabolism regulation // Amer. J. Physiol. Endocrin. Metab. 2001. V. 280. P. E827–E847.
- Шварц М.В. Жировая ткань как эндокринный орган // Проблемы эндокринологии. 2009. Т. 55, №1. С. 38–44.
- Чубриева С.Ю., Глухов Н.В., Зайчик А.М. Жировая ткань как эндокринный регулятор (обзор литературы) // Вестник Санкт-Петербургского университета. 2008. Сер. 11 вып. 1. С. 32–43.
- Романцова Т.И., Волкова Г.Е. Лептин и грелин: антагонизм и взаимодействие в регуляции энергетического обмена. Oбзор литературы // Ожирение и метаболизм. 2005. № 2. С. 1–9.
- Schwartz M. W., Seeley R. J., Campfield L. A. et al. Identification of targets of leptin action in rat hypothalamus // J. Clin. Invest. 1996. V. 98. P. 1101–1106.
- Leibowitz S. F. Specify city of hypothalamic peptides in the control of behavioral and physiological processes // Ann. N. Y. Acad. Sci. 1994. V. 739. P. 12–35.
- Керея А.В., Большаков М.А., Замощина Т.А., Князева И.Р., Кутенков О.П., Семенова Ю.Н. Поведенческие и метаболические реакции лабораторных мышей на воздействие наносекундного импульсно-периодического микроволнового излучения на головной мозг // Известия высших учебных заведений. Физика. – 2014. – Том 57, № 12/2. – С. 198–203.
- Euro guide on the accommodation and care of animals used for experimental and other scientific purposes. (Based on the revised Appendix A of the European Convention ETS 123) FELASA: Federation of European Laboratory Animal Science Associations, London, UK. 2007. 17 с. www.felasa.eu.
- Klimov A.I., Kovalchuk O.V., Rostov V.V., Sinyakov A. N. Measurement of Parameters of X-Band High-Power Microwave Superradiative Pulses. IEEE Trans. Plasma Science. 2008. Vol. 36, (no. 6). P. 1-4.
- Керея А.В., Большаков М.А., Замощина Т.А., Кутенков О.П., Ростов В.В., Светлик М.В., Ходанович М.Ю. Двигательная активность лабораторных мышей после воздействия наносекундными импульсно-периодическими микроволновым и рентгеновским излучениями // Международный научно-исследовательский журнал. – 2015. № 4 (35). – С. 14–19.
- Tijssen P. Practice and theory of enzyme immunoassays. Amsterdam; New York: Elsevier; New York, USA: Sole distributors for the USA and Canada, Elsevier Science Pub. 1985. Co. 502.
References
- Materialy VI mezhdunarodnoj nauchno-prakticheskoj konferencii «Medicinskie i jekologicheskie jeffekty ionizirujushhego izluchenija (MEEIR-VI). Seversk-Tomsk, 2013. S. 40–41
- Kereya A.V., Bolshakov M.A., Zharkova L.P., Ivanov V.V., Knyazeva I.R., Kutenkov O.P., Rostov V.V. Morphometry of the response of mice epididymal adipose tissue to nanosecond repetitive pulsed microwaves // Research Journal of International Studies. – 2014. №12 (31). – P. 32–36.
- Kereja A.V., Bol'shakov M.A., Zharkova L.P., Ivanov V.V., Knjazeva I.R., Kutenkov O.P., Rostov V.V., Semenova Ju.N. Jeffekt vozdejstvija nanosekundnogo impul'sno-periodicheskogo mikrovolnovogo izluchenija na jepididimal'nuju zhirovuju tkan' myshej // Radiacionnaja biologija. Radiojekologija, 2014, T. 54, № 6, S. 606–612
- Fruhbeck G., Gomes-Ambrosi J., Muruzabal F.J. et al. The adipocyte: a model for integration of endocrine and metabolic signaling in energy metabolism regulation // Amer. J. Physiol. Endocrin. Metab. 2001. V. 280. P. E827–E847.
- Shvarc M.V. Zhirovaja tkan' kak jendokrinnyj organ // Problemy jendokrinologii. 2009. T. 55, №1. S. 38–44.
- Chubrieva S.Ju., Gluhov N.V., Zajchik A.M. Zhirovaja tkan' kak jendokrinnyj reguljator (obzor literatury) // Vestnik Sankt-Peterburgskogo universiteta. 2008. Ser. 11 vyp. 1. S. 32–43.
- Romancova T.I., Volkova G.E. Leptin i grelin: antagonizm i vzaimodejstvie v reguljacii jenergeticheskogo obmena. Obzor literatury // Ozhirenie i metabolizm. 2005. № 2. S. 1–9.
- Schwartz M. W., Seeley R. J., Campfield L. A. et al. Identification of targets of leptin action in rat hypothalamus // J. Clin. Invest. 1996. V. 98. P. 1101–1106.
- Leibowitz S. F. Specify city of hypothalamic peptides in the control of behavioral and physiological processes // Ann. N. Y. Acad. Sci. 1994. V. 739. P. 12–35.
- Kereja A.V., Bol'shakov M.A., Zamoshhina T.A., Knjazeva I.R., Kutenkov O.P., Semenova Ju.N. Povedencheskie i metabolicheskie reakcii laboratornyh myshej na vozdejstvie nanosekundnogo impul'sno-periodicheskogo mikrovolnovogo izluchenija na golovnoj mozg // Izvestija vysshih uchebnyh zavedenij. Fizika. – 2014. – Tom 57, № 12/2. – S. 198–203.
- Euro guide on the accommodation and care of animals used for experimental and other scientific purposes. (Based on the revised Appendix A of the European Convention ETS 123) FELASA: Federation of European Laboratory Animal Science Associations, London, UK. 2007. 17 s. www.felasa.eu.
- Klimov A.I., Kovalchuk O.V., Rostov V.V., Sinyakov A. N. Measurement of Parameters of X-Band High-Power Microwave Superradiative Pulses. IEEE Trans. Plasma Science. 2008. Vol. 36, (no. 6). P. 1-4.
- Kereja A.V., Bol'shakov M.A., Zamoshhina T.A., Kutenkov O.P., Rostov V.V., Svetlik M.V., Hodanovich M.Ju. Dvigatel'naja aktivnost' laboratornyh myshej posle vozdejstvija nanosekundnymi impul'sno-periodicheskimi mikrovolnovym i rentgenovskim izluchenijami // Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. – 2015. № 4 (35). – S. 14–19.
- Tijssen P. Practice and theory of enzyme immunoassays. Amsterdam; New York: Elsevier; New York, USA: Sole distributors for the USA and Canada, Elsevier Science Pub. 1985. Co. 502.