ПОВРЕЖДАЮЩЕЕ ВОЗДЕЙСТВИЕ ТЕТРАХЛОРМЕТАНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ
Муфазалова Н.А.1, Муфазалова Л.Ф.2, Мухаметзянова А.Я.3, Батракова К.В.4
1 доктор медицинских наук, профессор; 2 кандидат медицинских наук, ассистент; 3 ординатор; 4 студент; Башкирский государственный медицинский университет
ПОВРЕЖДАЮЩЕЕ ВОЗДЕЙСТВИЕ ТЕТРАХЛОРМЕТАНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ
Аннотация
Цель. Изучить повреждающее влияние острой интоксикации тетрахлорметаном (ТХМ) на функциональное состояние мононуклеарных фагоцитов. Методы.Острую интоксикацию ТХМ воспроизводили внутрижелудочным введением токсиканта (1,25 мл/кг 50% раствора в оливковом масле) на протяжении 4 суток. Определяли интенсивность кислородзависимого метаболизма (НСТ-тест), поглотительную и антимикробную активность, содержание миелопероксидазы и катионных белков в мононуклеарных фагоцитах. Результаты регистрировали на 7, 14, 28, 46 и 60 сутки от окончания введения токсиканта. Результаты. Острая интоксикация тетрахлорметаном вызывает снижение кислородзависимого метаболизма, поглотительной и микробицидной способности клеток, что коррелирует с уменьшением в них активности миелопероксидазы и уровня катионных белков. Выводы. Острая интоксикация тетрахлорметаном приводит к глубоким нарушениям функционирования мононуклеарных фагоцитов, которые не устраняются даже к 60 суткам наблюдения. Ключевые слова: тетрахлорметан, мононуклеарные фагоциты, кислородзависимый метаболизм, поглотительная активность, микробицидностьMufazalova N.A.1, Mufazalova L.F.2, Muhametzjanova A.Ja.3, Batrakova K.V.4
1 doctor of Medicine, professor; 2 assistant; 3 ordinator; 4 student, Bashkirian State Medical University
THE DAMAGING IMPACT OF CARBON TETRACHLORIDE ON THE FUNCTIONAL CONDITION OF MONONUCLEAR PHAGOCYTES
Abstract
Objective. To study hazardous effects of acute carbon tetrachloride intoxication on the functional state of mononuclear phagocytes. Methods. Carbon tetrachloride mutagen (1.25 ml/kg of 50% olive oil solution) was injected for 4 days. The intensity of oxygen-dependent metabolism (NST-test), absorptive and microbicide activity, the content of mieloperoxidase and cation proteins in mononuclear phagocytes were identified. The results were registered by 7, 14, 28, 46 and 60 days from the discontinuation of toxicant administration. Results. Acute carbon tetrachloride intoxication results in the development of severe microbicide activity of mononuclear phagocytes that correlates with a decrease in their mieloperoxidase activity and the level of cation proteins. Conclusions. Acute carbon tetrachloride intoxication leads to mononuclear phagocytes activation disorders which are not resolved by 60 days of observation. Key words: carbon tetrachloride, mononuclear phagocytes, oxygen-dependent metabolism, absorptive activity, microbicide activity. Хлорированные углеводороды, в том числе четыреххлористый углерод (тетрахлорметан, ТХМ) широко применяются как в промышленности, так и в сельском хозяйстве [2, 6, 14]. Кроме того ТХМ является потенциальным канцерогеном (IARC группа 2В). ТХМ может поступать в организм через неповрежденную кожу, дыхательные пути, пищеварительный тракт. Особую опасность представляют острые отравления ТХМ, возникающие при аварийных ситуациях на производстве, летальность при этом составляет от 15% до 30% [2, 6]. ТХМ оказывает плейотропное повреждающее действие на организм, основным механизмом которого является активация процессов перекисного окисления липидов (ПОЛ) [14, 17, 28, 32, 34]. Известно, что основной мишенью токического действия ТХМ является печень [14, 25, 27, 30]. До 60% всех токсических поражений печени связано с отравлениями ТХМ [3]. Однако в последние годы появились сведения о том, что высокая смертность при острых интоксикациях ТХМ тесно связана и с его иммунотоксическим действием, формированием глубокого иммунодефицита [4, 8, 12, 15, 24]. С другой стороны, известно, что функциональное состояние печени и системы иммунитета тесно взаимосвязаны. Установленным фактом является и то, что состояние фагоцитов оказывает значительное влияние на процессы репаративной регенерации печени [7, 9, 10, 11, 22]. Более того, показано, что в патогенезе CCl4 – индуцированного фиброза печени большое значение имеют иммунные механизмы [26, 29, 31, 33]. Учитывая высокую вероятность повреждающего воздействия ТХМ на клетки фагоцитарного звена, взаимозависимость состояния иммунной и гепатобилиарной систем в поддержании гомеостаза, а также важную роль мононуклеарных фагоцитов в процессах репаративной регенерации печени, представляло интерес изучить состояние этих клеток в условиях острой интоксикации ТХМ. Эксперименты выполнены на 100 белых неинбредных крысах массой 180- 200 г. Животные были разделены на 2 группы (по 10 животных в группе): контроль, ТХМ. Животным на протяжении 4 суток (в -4, -3, -2 и -1 дни) вводили ТХМ внутрижелудочно в дозе 1,25 мл/кг 50% раствора в оливковом масле [18]. Животные содержались в стандартных условиях вивария с естественным световым режимом, на стандартной диете лабораторных животных (ГОСТР 50258-92), с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях, а также правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 51000.4-96) и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP). Определяли интенсивность кислородзависимого метаболизма (спонтанный и индуцированный НСТ-тест), поглотительную способность перитонеальных макрофагов (ПМФ), антимикробную активность ПМФ в условиях функционирования и блокады (азидом натрия) кислородзависимых факторов микробицидности в отношении грибов Candida albicans, активность миелопероксидазы (МП) и содержание катионных белков (КБ) в ПМФ [21, 23]. Результаты регистрировали на 7, 14, 28, 46 и 60 сутки. Статистическую обработку проводили с использованием методов вариационной статистики [5], пакета программ Statistica 8.0. Проверку на нормальность распределения данных выполняли с помощью критерия Шапиро-Вилка. Оценку значимости различий проводили, вычисляя медиану и межквартильный интервал. Дисперсионный анализ проводили с помощью Н-критерия Краскела-Уоллиса, для множественных сравнений использован Q-критерий Дана. Критический уровень значимости р для статистических критериев принимали равным 0,05. Данные в тексте представлены в процентах к контролю (неинбредные животные). Ранее нами было показано, что воздействие ТХМ приводит к формированию глубокой лейкопении во все сроки наблюдения, подавлению микробицидности нейтрофилов, особенно в условиях блокады оксидантного киллинга [1, 13]. Мононуклеарные фагоциты по сравнению с нейтрофилами оказались несколько более устойчивыми к повреждающему действию токсиканта. Так, на 7 сутки было отмечено угнетение только кислороднезависимых факторов микробицидности ПМФ (индекс инактивации (ИИ) составил 75,59%, p=0,0000001), что цитохимически подтверждалось снижением уровня КБ в них (табл. 1). При этом интенсивность кислородзависимого киллинга ПМФ не отличалась от таковой интактных животных (ИИ – 87,88%), что, вероятно достигалось за счет повышения интенсивности образования активных форм кислорода в условиях индукции (индуцированный НСТ-тест): процент активных (ПА лат) клеток составил – 157,89% (р=0,0419), а индекс активации (ИА) – 168,48% (р=0,0142). Изменений активности МП в ПМФ не наблюдалось (табл. 1). Гиперпродукция же активных форм кислорода в условиях спонтанного НСТ-теста, наблюдавшаяся в фагоцитах на 7 сутки в сочетании со снижением их антимикробной активности может свидетельствовать о несоответствии между продукцией свободных радикалов и антиоксидантными механизмами защиты, что способствует повреждению фагоцитов [11, 16, 19]. Снижение микробоцидного потенциала может служить одним из ранних признаков "функционального утомления", которое следует за любой стимуляцией фагоцитов. Это объясняет снижение бактерицидности при усилении окислительного метаболизма. Избыточная продукция оксидантов на фоне недостатка их инактиваторов повышает уровень внутриклеточных аутоокислительных процессов, ослабляя антимикробные свойства фагоцитов [10, 20].Таблица 1 - Влияние тетрахлорметана на активность миелопероксидазы и содержание катионных белков в ПМФ (СЦК, в % к контролю)
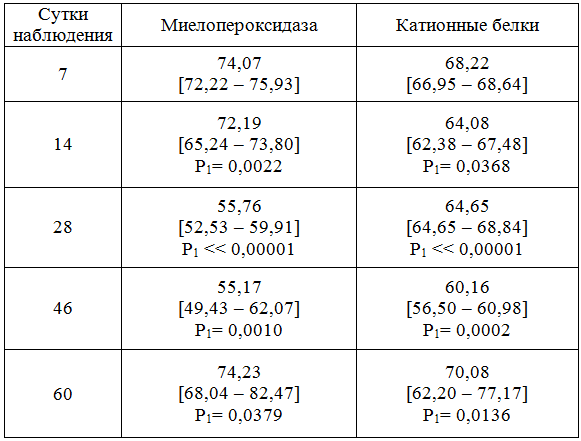
Примечание: достоверность отличий Р1 – от контроля
На 14-е сутки было отмечено угнетение ТХМ оксидантных факторов микробицидности ПМФ (ИИ – 86,93%). Это сопровождалось подавлением кислородзависимого метаболизма макрофагов как в спонтанном, так и в индуцированном НСТ – тесте: ПА лат – 68,0% (р=0,0383), ИА лат – 71,43% (р=0,1907), что свидетельствует о существенном истощении резервного потенциала ПМФ и способности к образованию активных форм кислорода, которым, как известно, принадлежит ведущая роль в механизмах оксидантного киллинга ПМФ. Цитохимически угнетение кислородзависимого киллинга сопровождалось снижением активности МП в ПМФ (табл. 1). В тоже время сохранялась депрессия ТХМ неоксидантного киллинга мононуклеаров (ИИ - 77,06%), что проявлялось и снижением содержания КБ в ПМФ: процент КБ – положительных клеток составил 59,69 (р=0,0082)%, а СЦК – 64,08% (р=0,0368) (табл. 1). В эти же сроки было отмечено увеличение как количества ПМФ, участвующих в фагоцитозе (ФЧ), так и их поглотительной способности (ФИ): ФЧ составило 127,94% (р=0,2698), а ФИ – 131,67% (р=0,0012). На 28-е сутки интенсивность кислородзависимого киллинга ПМФ несколько повышалась (ИИ – 76,99%), что обеспечивалось пероксидазонезависимыми микробицидными системами, в то время как пероксидазозависимые факторы киллинга были подавлены, о чем свидетельствовало глубокое снижение активности МП в ПМФ (табл. 1). При этом усугублялась депрессия токсикантом кислороднезависимой микробицидности ПМФ (ИИ - 60,52%), что подтверждалось снижением уровня КБ в них (табл. 1, рис. 1).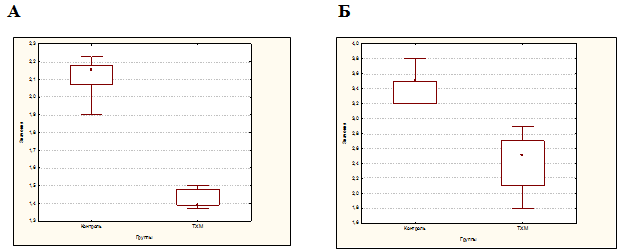
Рис. 1 - Влияние ТХМ на содержание КБ (СЦК) (А) и поглотительную способность (ФИ) (Б) в ПМФ (28 сутки наблюдения)
В эти сроки сохранялось увеличение числа ПМФ, участвующих в фагоцитозе (ФЧ – 123,53%, р=1,00) при значимом снижении их поглотительной способности (ФИ – 71,43%, р=0,0430), что может свидетельствовать о переходе ПМФ на экстенсивный путь функционирования (рис. 1). На 46-е сутки сохранялась депрессия оксидантных микробицидных систем ПМФ (ИИ – 72,92%) и дальнейшее падение неоксидантных механизмов киллинга мононуклеарных фагоцитов (ИИ – 56,96%). При этом было выявлено снижение кислородзависимого метаболизма ПМФ в условиях индукции: ПА лат – 76,0% (р=0,1107), ИА лат – 72,55% (р=1,00) и активности МП в ПМФ (табл. 1). Как и на предшествующие сроки наблюдения, сохранялся низкий уровень КБ в мононуклеарных фагоцитах, что коррелировало с угнетением кислороднезависимых микробицидных систем ПМФ (табл. 1). На 60-е сутки, как и на 46-е, сохранялась депрессия ТХМ кислородзависимых и кислороднезависимых механизмов микробицидности ПМФ (ИИ составил 80,09 и 69,63% соответственно), что сопровождалось глубоким подавлением оксидантного метаболизма ПМФ (индуцированный НСТ-тест: процент НСТ-позитивных клеток составил 66,67% (р=0,0550), а ИА лат – 55,24% (р=0,00005)) и снижением активности МП (табл. 1). Таким образом, полученные данные свидетельствуют о том, что острая интоксикация ТХМ приводит к глубоким нарушениям функциональной активности ПМФ. Это проявилось подавлением неоксидантных механизмов микробицидности ПМФ начиная с 7 суток и вплоть до 60 суток наблюдения, и цитохимически подтверждалось стойким снижением в них уровня КБ на все сроки наблюдения. Полученные данные могут свидетельствовать о нарушении процессов контактного взаимодействия мононуклеарных фагоцитов и нейтрофилов. Угнетение оксидантных факторов фунгицидности ПМФ регистрировалось с 14 суток наблюдения и не устранялось к 60 суткам. Причем на 14, 28 и 46 сутки отмечено большее подавление пероксидазозависимых механизмов киллинга, о чем свидетельствовало снижение активности МП, а на 60 сутки – пероксидазонезависимых микробицидных систем, что подтверждалось уменьшением продукции активных форм кислорода в мононуклеарных фагоцитах. Также воздействие токсиканта приводило к падению поглотительной способности клеток (начиная с 28 суток наблюдения) и сопровождалось увеличением числа ПМФ, участвующих в фагоцитозе. Полученные данные свидетельствуют о необходимости поиска возможных путей фармакологической коррекции иммунотоксического действия ТХМ.Литература
- Алёхин Е.К. Функциональное состояние нейтрофилов при интоксикации тетрахлорметаном у крыс / Е.К. Алёхин, Н.А. Муфазалова, Л.Ф. Муфазалова // Казанский медицинский журн.- 2012.- Т. 93, №3.- С. 502-504.
- Бушманова, А.Ю. Токсические профессиональные поражения печени: методические рекомендации / А.Ю. Бушманова. - М., 2006. – 45 с.
- Венгеровский, А.И. Гепатопротекторы, содержащие фосфолипиды, ослабляют иммунодепрессивный эффект преднизолона при экспериментальном хроническом гепатите / А.И. Венгеровский, Л.М. Огородова, Т.В. Перевозчикова // Экспериментальная и клиническая фармакология. – 2004. – Т. 64, № 4. – С. 50 - 53.
- Влияние пантенола и карнитина на ферменты обмена альдегидов в печени крыс, пораженных тетрахлорметаном / В.И. Сатановская, П.С. Пронько, А.В. Гайшманова, Д.А. Мискевич // Экспериментальная и клиническая фармакология. – 2009. – Т. 72, № 3. – С. 39.
- Гареев, Е.М. Основы математико-статистической обработки медико-биологической информации.- Уфа: Изд-во ГОУ ВПО «Башгосмедуниверситет Роздрава».- 2009.- 346 с.
- Изменение цитокинового профиля и редукция функции субпопуляций лимфоцитов при подостром отравлении тетрахлорметаном / П.Ф. Забродский, В.Ф. Киричук, В.Г. Лим [и др.] // Бюллетень экспериментальной биологии и медицины. – 2009. – Т. 147, № 1. – С. 55 - 57.
- Кутина, С.Н. Резистентность печени к повреждению ССl4 при стимуляции макрофагов препаратов разных классов / С.Н. Кутина, А.А. Зубахин // Бюллетень экспериментальной биологии и медицины. – 2000. – Т. 129, № 6. – С. 620 - 622.
- Лемза, С.В. Фармакотерапевтическая эффективность комплексного растительного средства «гепатон» при экспериментальном повреждении печени / С.В. Лемза, Т.А. Ажунова, А.Г. Мондодоев // Бюллетень ВСНЦ СО РАМН. - 2010. - Т. 72, № 2. - С. 181 - 184.
- Макарова, О.П. Перекисное окисление липидов в печени мышей при развитии гранулематозного воспаления после сочетанного инфицирования C. Albicans и M. Tuberculosis / О.П. Макарова, Д.Д. Цырендоржиев, В.А. Шкурупий // Бюллетень экспериментальной биологии и медицины. – 2008. – Т. 146, № 11. – С. 503 - 506.
- Маянский, А.Н. Клинические аспекты фагоцитоза / А.Н. Маянский, О.И. Пикуза. – Казань: Магариф, 1993. – 122 с.
- Маянский, А.Н. НАДФН - оксидаза нейтрофилов: активация и регуляция / А.Н. Маянский // Цитокины и воспалние. – 2007. – Т. 6, № 3. – С. 3 - 13.
- Михеева, О.М. Печень и лекарственный метаболизм / О.М. Михеева // Экспериментальная и клиническая гастроэнтерология. – 2011. – № 1. – С. 121 - 124.
- Муфазалова Л.Ф. Влияние оксиметилурацила на функциональное состояние нейтрофилов при интоксикации тетрахлорметаном / Л.Ф. Муфазалова, Н.А. Муфазалова // Фундаментальные исследования.- 2012.- №4.- С. 340-343.
- Мышкин, В.А. Поражения печени химическими веществами / В.А. Мышкин, Р.Б. Ибатуллина, А.Б. Бакиров. - Уфа, 2007. - 177 с.
- Орлова, Е.А. Коррекция нарушений иммунного гомеостаза производными 3-гидроксипиридина при патологии органов панкреатобилиарной области / Е.А. Орлова, В.А. Рагулина, А.Л. Локтионов, А.И. Конопля // Системный анализ и управление в биомедицинских системах. - 2010. - Т. 9, №4.- С. 759-763.
- Плескова, С.Н. Модуляция кислородзависимого и кислороднезависимого метаболизма нейтрофильных гранулоцитов квантовыми точками / С.Н. Плескова, Э.Р. Михеева // Бюллетень экспериментальной биологии и медицины. – 2011. – Т. 151, № 4. – С. 452 – 454.
- Про - и антиоксиданты в центральной лимфе при экспериментальном токсическом гепатите / Ю.И. Бородин, Ю.В. Башкирова, М.С. Любарский, М.А. Колпаков // Бюллетень экспериментальной биологии и медицины. – 2008. – Т. 146, № 11. – С. 499 - 502.
- Саратиков, А.С. Влияние гепатопротекторов, содержащих фосфолипиды, на зависимую от цитохрома Р-450 антитоксическую функцию печени при экспериментальном токсическом гепатите / А.С. Саратиков, А.И. Венгеровский // Бюлл. эксперим. биологии и медицины.– 1999.– Т. 127, № 4.– С. 392- 394.
- Степовая, Е.А. Роль тиолдисульфидной системы в механизмах изменений функциональных свойств нейтрофилов при окислительном стрессе / Е.А. Степовая, Г.В. Петина, Т.В. Жаворонок // Бюллетень экспериментальной биологии и медицины. – 2010. – Т. 150, № 8. – С. 161–165.
- Технологии определения и роль нейтрофильных внеклеточных ловушек в антимикробной защите / И.И. Долгушин, Ю.С. Шишкова, А.Ю. Савочкина [и др.] // Вестник РАМН. – 2010. - № 4. – С. 26 - 30.
- Фрейдлин, И.С. Система мононуклеарных фагоцитов.- М.: Медицина,- 272 с.
- Цырендоржиев, Д.Д. Резистентность печени к повреждению CCl4 при депрессии клеток Купфера хлоридом гадолиния / Д.Д. Цырендоржиев, С.Н. Кутина, А.А. Зубахин // Бюллетень экспериментальной биологии и медицины. – 2000. – Т. 129, № 6. – С. 709 - 711.
- Ягода, А.В., Локтева Н.А. Клиническая цитохимия. – Ставрополь: Изд-во СтГМА, 2005. – 485 с.
- Arshad, M.I. Deficiency of IL-33 sensitizes to severe liver injury induced by cona but not by CCL4 in mice / M.I. Arshad, A. Filliol, V. Genet, C. Lucas-Clerc // Journal of Hepatology. Conference: 49th Annual Meeting of the European Association for the Study of the Liver, International Liver Congress 2014 London United Kingdom. Conference Start: 20140409 Conference End: 20140413. Conference Publication: (var.pagings). 60 (1 SUPPL. 1) (P. S111), 2014.
- Bashandy, A.S. Alwasel SH. Carbon tetrachloride-induced hepatotoxicity and nephrotoxicity in rats: Protective role of vitamin C / A.S. Bashandy, S.H. Alwasel // J. Pharmacol. Toxicol. – 2011. –Vol. 6. - P. 283-292.
- Fan, X. Attenuation of CCl4-induced hepatic fibrosis in mice by vaccinating against TGF-beta1 / X. Fan, Q. Zhang, S. Li, Y. Lv // PLoS ONE. - 2013.- 8 (12), Article Number: e82190.
- Haretskaya, M.V. Hepatoprotective properties of taurine during carbon tetrachloride intoxication / M.V. Haretskaya, V.M. Sheibak // Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry. - 2014. - 8 (4).- P. 286-292. (оксидат стресс)
- Heeba, G.H. Therapeutic potential of morin against liver fibrosis in rats: Modulation of oxidative stress, cytokine production and nuclear factor kappa B / G.H. Heeba, M.E. Mahmoud // Environmental Toxicology and Pharmacology. 2014. - 37 (2).- P. 662-671. оксидат стресс)
- Ijiri, Y. Chronological changes in circulating levels of soluble tumor necrosis factor receptors 1 and 2 in rats with carbon tetrachloride-induced liver injury / Y. Ijiri, R. Kato, M. Sadamatsu, M. Takano // Toxicology. -2014. - 316 (1).- P. 55-60.
- Ishola, I.O. Hepatoprotective and antioxidant activities of hepacare, a herbal formulation against carbon tetrachloride-induced liver injury / I.O. Ishola, A.A. Akinyede, A.K. Robert, S.A. Omilabu // Drug Research. - 2015. - 65 (1).- P. 30-39.
- Jiang, Y. Mistletoe alkaloid fractions alleviates carbon tetrachloride-induced liver fibrosis through inhibition of hepatic stellate cell activation via TGF-beta/Smad interference / Y. Jiang, C. Wang, Y.-Y. Li, X.-C. Wang // Journal of Ethnopharmacology. - 2014. - 158 (PA).- P. 230-238.
- Kawano, Y. Effects of the dihydrolipoyl histidinate zinc complex against carbon tetrachloride-induced hepatic fibrosis in rats / Y. Kawano, M. Ohta, Y. Iwashita, Y. Komori // Surgery Today. 2014. - 44 (9).- P. 1744-1750. (оксидат стресс)
- Ma, J.-N. Anti-hepatic fibrosis effect of low molecular weight chitosan and its influence in TLR4 expression / J.-N. Ma, H.-F. Jing, C.-M. Zhang, Y.-J. Dong // Journal of Jilin University Medicine Edition. - 2014. - 40 (5).- P. 1013-1017.
- Shaaban, A.A. Modulation of carbon tetrachloride-induced hepatic oxidative stress, injury and fibrosis by olmesartan and omega-3 / A.A. Shaaban, M.E. Shaker, K.R. Zalata, H.A. El-Kashef // Chemico-Biological Interactions. - 2014. - 207 (1).- P. 81-91.
References
- Aljohin E.K. Funkcional'noe sostojanie nejtrofilov pri intoksikacii tetrahlormetanom u krys / E.K. Aljohin, N.A. Mufazalova, L.F. Mufazalova // Kazanskij medicinskij zhurn.- 2012.- T. 93, №3.- S. 502-504.
- Bushmanova, A.Ju. Toksicheskie professional'nye porazhenija pecheni: metodicheskie rekomendacii / A.Ju. Bushmanova. - M., 2006. – 45 s.
- Vengerovskij, A.I. Gepatoprotektory, soderzhashhie fosfolipidy, oslabljajut immunodepressivnyj jeffekt prednizolona pri jeksperimental'nom hronicheskom gepatite / A.I. Vengerovskij, L.M. Ogorodova, T.V. Perevozchikova // Jeksperimental'naja i klinicheskaja farmakologija. – 2004. – T. 64, № 4. – S. 50 - 53.
- Vlijanie pantenola i karnitina na fermenty obmena al'degidov v pecheni krys, porazhennyh tetrahlormetanom / V.I. Satanovskaja, P.S. Pron'ko, A.V. Gajshmanova, D.A. Miskevich // Jeksperimental'naja i klinicheskaja farmakologija. – 2009. – T. 72, № 3. – S. 39.
- Gareev, E.M. Osnovy matematiko-statisticheskoj obrabotki mediko-biologicheskoj informacii.- Ufa: Izd-vo GOU VPO «Bashgosmeduniversitet Rozdrava».- 2009.- 346 s.
- Izmenenie citokinovogo profilja i redukcija funkcii subpopuljacij limfocitov pri podostrom otravlenii tetrahlormetanom / P.F. Zabrodskij, V.F. Kirichuk, V.G. Lim [i dr.] // Bjulleten' jeksperimental'noj biologii i mediciny. – 2009. – T. 147, № 1. – S. 55 - 57.
- Kutina, S.N. Rezistentnost' pecheni k povrezhdeniju SSl4 pri stimuljacii makrofagov preparatov raznyh klassov / S.N. Kutina, A.A. Zubahin // Bjulleten' jeksperimental'noj biologii i mediciny. – 2000. – T. 129, № 6. – S. 620 - 622.
- Lemza, S.V. Farmakoterapevticheskaja jeffektivnost' kompleksnogo rastitel'nogo sredstva «gepaton» pri jeksperimental'nom povrezhdenii pecheni / S.V. Lemza, T.A. Azhunova, A.G. Mondodoev // Bjulleten' VSNC SO RAMN. - 2010. - T. 72, № 2. - S. 181 - 184.
- Makarova, O.P. Perekisnoe okislenie lipidov v pecheni myshej pri razvitii granulematoznogo vospalenija posle sochetannogo inficirovanija C. Albicans i M. Tuberculosis / O.P. Makarova, D.D. Cyrendorzhiev, V.A. Shkurupij // Bjulleten' jeksperimental'noj biologii i mediciny. – 2008. – T. 146, № 11. – S. 503 - 506.
- Majanskij, A.N. Klinicheskie aspekty fagocitoza / A.N. Majanskij, O.I. Pikuza. – Kazan': Magarif, 1993. – 122 s.
- Majanskij, A.N. NADFN - oksidaza nejtrofilov: aktivacija i reguljacija / A.N. Majanskij // Citokiny i vospalnie. – 2007. – T. 6, № 3. – S. 3 - 13.
- Miheeva, O.M. Pechen' i lekarstvennyj metabolizm / O.M. Miheeva // Jeksperimental'naja i klinicheskaja gastrojenterologija. – 2011. – № 1. – S. 121 - 124.
- Mufazalova L.F. Vlijanie oksimetiluracila na funkcional'noe sostojanie nejtrofilov pri intoksikacii tetrahlormetanom / L.F. Mufazalova, N.A. Mufazalova // Fundamental'nye issledovanija.- 2012.- №4.- S. 340-343.
- Myshkin, V.A. Porazhenija pecheni himicheskimi veshhestvami / V.A. Myshkin, R.B. Ibatullina, A.B. Bakirov. - Ufa, 2007. - 177 s.
- Orlova, E.A. Korrekcija narushenij immunnogo gomeostaza proizvodnymi 3-gidroksipiridina pri patologii organov pankreatobiliarnoj oblasti / E.A. Orlova, V.A. Ragulina, A.L. Loktionov, A.I. Konoplja // Sistemnyj analiz i upravlenie v biomedicinskih sistemah. - 2010. - T. 9, № 4.- S. 759-763.
- Pleskova, S.N. Moduljacija kislorodzavisimogo i kislorodnezavisimogo metabolizma nejtrofil'nyh granulocitov kvantovymi tochkami / S.N. Pleskova, Je.R. Miheeva // Bjulleten' jeksperimental'noj biologii i mediciny. – 2011. – T. 151, № 4. – S. 452 – 454.
- Pro - i antioksidanty v central'noj limfe pri jeksperimental'nom toksicheskom gepatite / Ju.I. Borodin, Ju.V. Bashkirova, M.S. Ljubarskij, M.A. Kolpakov // Bjulleten' jeksperimental'noj biologii i mediciny. – 2008. – T. 146, № 11. – S. 499 - 502.
- Saratikov, A.S. Vlijanie gepatoprotektorov, soderzhashhih fosfolipidy, na zavisimuju ot citohroma R-450 antitoksicheskuju funkciju pecheni pri jeksperimental'nom toksicheskom gepatite / A.S. Saratikov, A.I. Vengerovskij // Bjull. jeksperim. biologii i mediciny.– 1999.– T. 127, № 4.– S. 392- 394.
- Stepovaja, E.A. Rol' tioldisul'fidnoj sistemy v mehanizmah izmenenij funkcional'nyh svojstv nejtrofilov pri okislitel'nom stresse / E.A. Stepovaja, G.V. Petina, T.V. Zhavoronok // Bjulleten' jeksperimental'noj biologii i mediciny. – 2010. – T. 150, № 8. – S. 161–165.
- Tehnologii opredelenija i rol' nejtrofil'nyh vnekletochnyh lovushek v antimikrobnoj zashhite / I.I. Dolgushin, Ju.S. Shishkova, A.Ju. Savochkina [i dr.] // Vestnik RAMN. – 2010. - № 4. – S. 26 - 30.
- Frejdlin, I.S. Sistema mononuklearnyh fagocitov.- M.: Medicina, 1984.- 272 s.
- Cyrendorzhiev, D.D. Rezistentnost' pecheni k povrezhdeniju CCl4 pri depressii kletok Kupfera hloridom gadolinija / D.D. Cyrendorzhiev, S.N. Kutina, A.A. Zubahin // Bjulleten' jeksperimental'noj biologii i mediciny. – 2000. – T. 129, № 6. – S. 709 - 711.
- Jagoda, A.V., Lokteva N.A. Klinicheskaja citohimija. – Stavropol': Izd-vo StGMA, 2005. – 485 s.
