SPECIFICS OF THE IMMUNOHORMONAL PROFILE OF PATIENTS WITH A HISTORY OF RECURRENT MISCARRIAGE
SPECIFICS OF THE IMMUNOHORMONAL PROFILE OF PATIENTS WITH A HISTORY OF RECURRENT MISCARRIAGE
Abstract
This article presents a prospective study of the immunohormonal profile of women with a history of recurrent miscarriage, including the determination of antibody titre to the most important hormonal components of physiological pregnancy (progesterone, 17-b estradiol, human chorionic gonadotropin). The somatic and obstetric-gynaecological anamnesis of the women included in the research (including the control group) was analysed. The correlation between the titres of the antibodies determined and the number of undeveloped pregnancies and miscarriages in the anamnesis was evaluated. The possible role of the presence of infectious and inflammatory diseases of the female genital organs and allergic reactions as indirect indicators of the features of immunological reactions in women with habitual pregnancy failure was discussed.
1. Введение
Привычное невынашивание беременности (ПНБ) – одна из наиболее актуальных проблем современной гинекологии, которая имеет значительный удельный вес в структуре репродуктивных потерь. В настоящее время мнения большинства исследователей сходятся в том, что одним из важнейших патогенетических аспектов ПНБ является развитие аутоиммунных реакций к гормонам и рецепторам гормонов материнского организма , . Множество научных трудов в Российских и зарубежных базах данных сообщают о частом сочетании ПНБ с антифосфолипидным синдромом и другими аутоиммунными состояниями, однако данные материалы в большинстве своём освещают иммунологический компонент антителообразования на уровне межклеточных взаимодействий, не учитывая при этом влияние данных механизмов на динамику гормонального профиля при последующей беременности и в послеродовом периоде , , . Исходя из этого, комплексное изучение иммуно-гормонального профиля у пациенток с ПНБ в анамнезе остаётся малоизученным направлением, требующим детальных клинических исследований, что позволит в будущем сформировать новые подходы к профилактике и лечению привычного выкидыша при последующих гестациях.
Цель исследования: улучшить репродуктивный прогноз у женщин с ПНБ путем анализа их иммуно-гормонального профиля.
Для решения поставленной цели были определены следующие задачи:
1. Определить особенности общесоматического и акушерско-гинекологического анамнеза (АГА) женщин, сталкивающихся с привычным невынашиванием.
2. Установить уровни антител к прогестерону, 17-b эстрадиолу, хорионическому гонадотропину человека (ХГЧ) у пациенток с ПНБ в анамнезе методом иммуноферментного анализа (ИФА).
3. Оценить влияние иммуно-гормонального профиля женщин с привычным выкидышем в анамнезе на возникновение репродуктивных потерь.
4. Ознакомиться и проанализировать работы, приближенные по содержанию к данной теме, используя базы данных PubMed, Scopus и elibrary, проанализировать полученные результаты.
2. Результаты
Материалом для исследования послужили результаты обследования 100 женщин в возрасте 25–40 лет, находившихся под наблюдением в одном из перинатальных центров города Ставрополя.
Методом систематизации исходную выборку пациенток (n = 100) разделили на две группы:
I. Пациентки с установленным невынашиванием беременности в анамнезе (n = 50), составившие основную группу;
II. Пациентки с физиологической беременностью в анамнезе (n = 50), у которых отсутствуют анамнестические сведения, указывающие на наличие привычного выкидыша, составившие группу сравнения (контроля).
Данные были подвергнуты клинико-статистической оценке с использованием программы Microsoft Excel 2016. Достоверность полученных результатов определяли с помощью вычисления критерия Пирсона и линейного корреляционного анализа (r).
Средний возраст женщин сравниваемых групп составил 30,6 ± 1,05 лет, максимальный – 40, минимальный – 20, что, безусловно, говорит о том, что ПНБ может фигурировать у всех женщин репродуктивного возраста.
В структуре экстрагенитальных патологий (рис. 1) основной группы доминировали аллергические реакции (АР), заболевания пищеварительной системы и нарушения жирового обмена. Распределение контрольной группы имело схожий характер, однако отличалось значительно более низким удельным весом аллергий, а также отсутствием случаев болезней почек и мочевыводящих путей, заболеваний щитовидной железы.
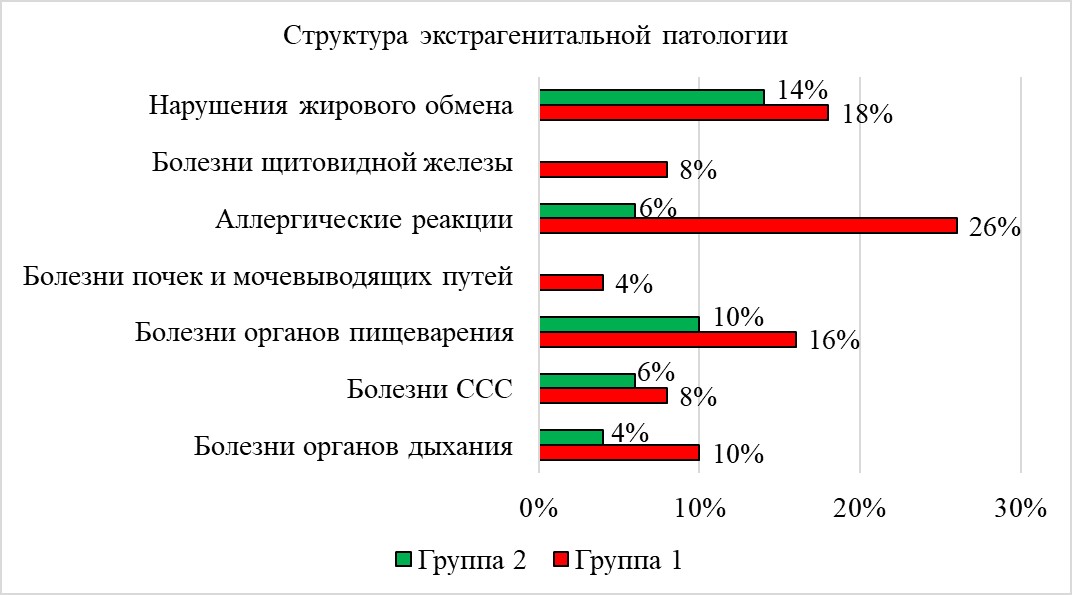
Рисунок 1 - Структура экстрагенитальной патологии
В контрольной группе 58% женщин сообщали о наличие одного полового партнера, тогда как в основной группе таковых было статистических значимо меньше – 20% (p < 0,01).
Общее количество беременностей в анамнезе (рис. 2) в первой группе составило 157, во второй – 88 (без учета настоящей беременности). В основной группе статистически значимо чаще отмечались случаи неразвивающейся беременности (НБ) и внематочной беременности (92% и 48%), а также хирургического и медикаментозного абортов (86% и 72%), чем в группе контроля (p < 0,001).
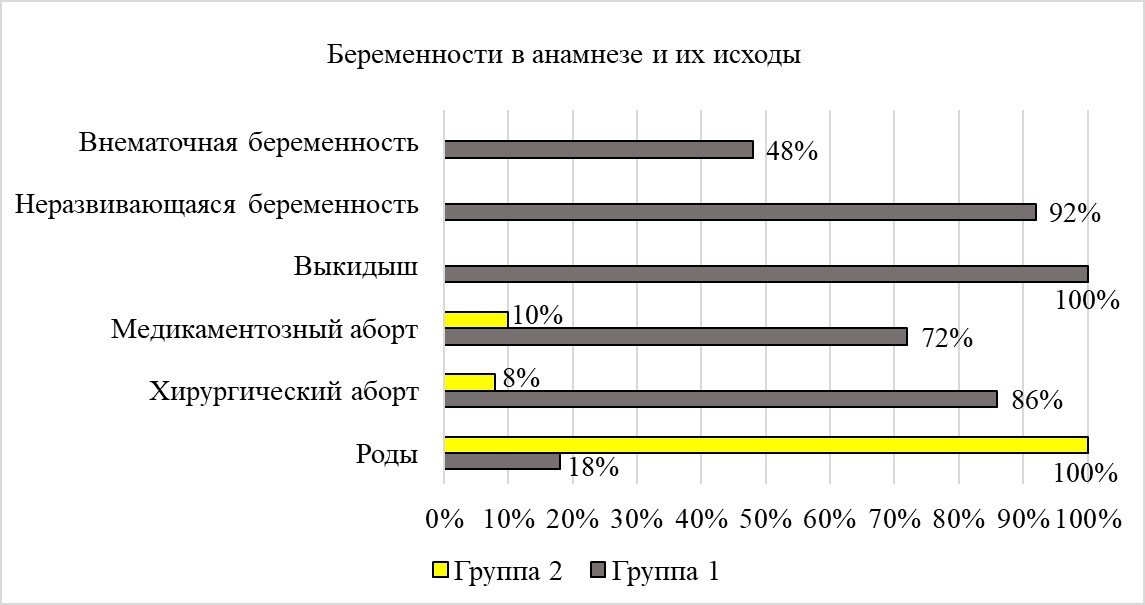
Рисунок 2 - Беременности в анамнезе и их исходы
Анализ сведений о перенесенных оперативных вмешательствах не показал значимых межгрупповых различий, однако стоит отметить, что в контрольной группе отсутствовали случаи резекции маточной трубы и удаления яичника (структура представлена на рисунке 3).
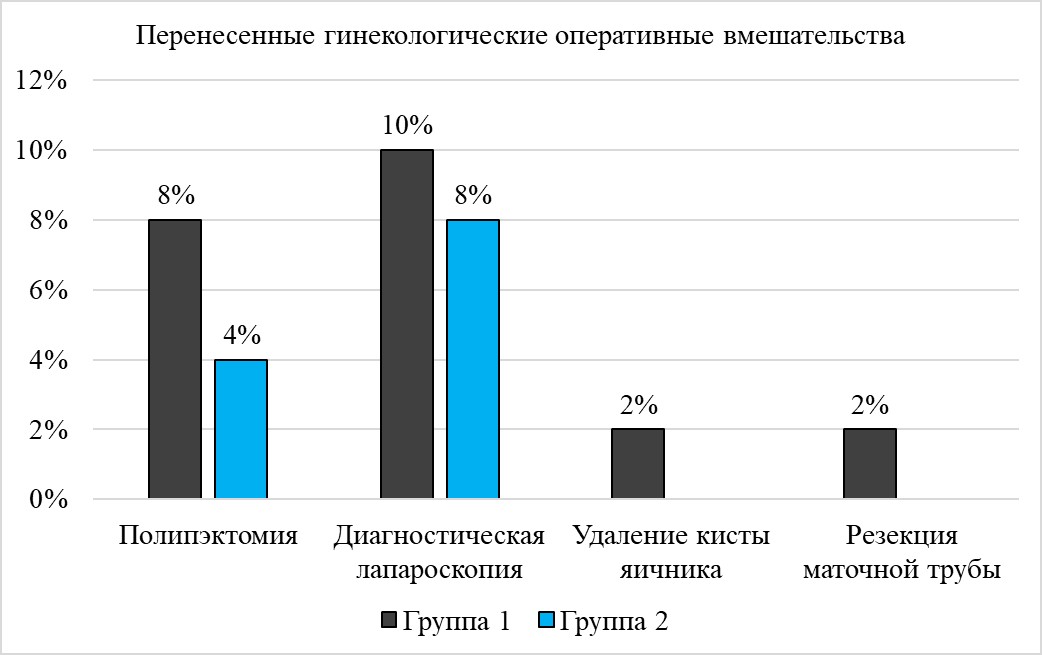
Рисунок 3 - Перенесенные гинекологические оперативные вмешательства
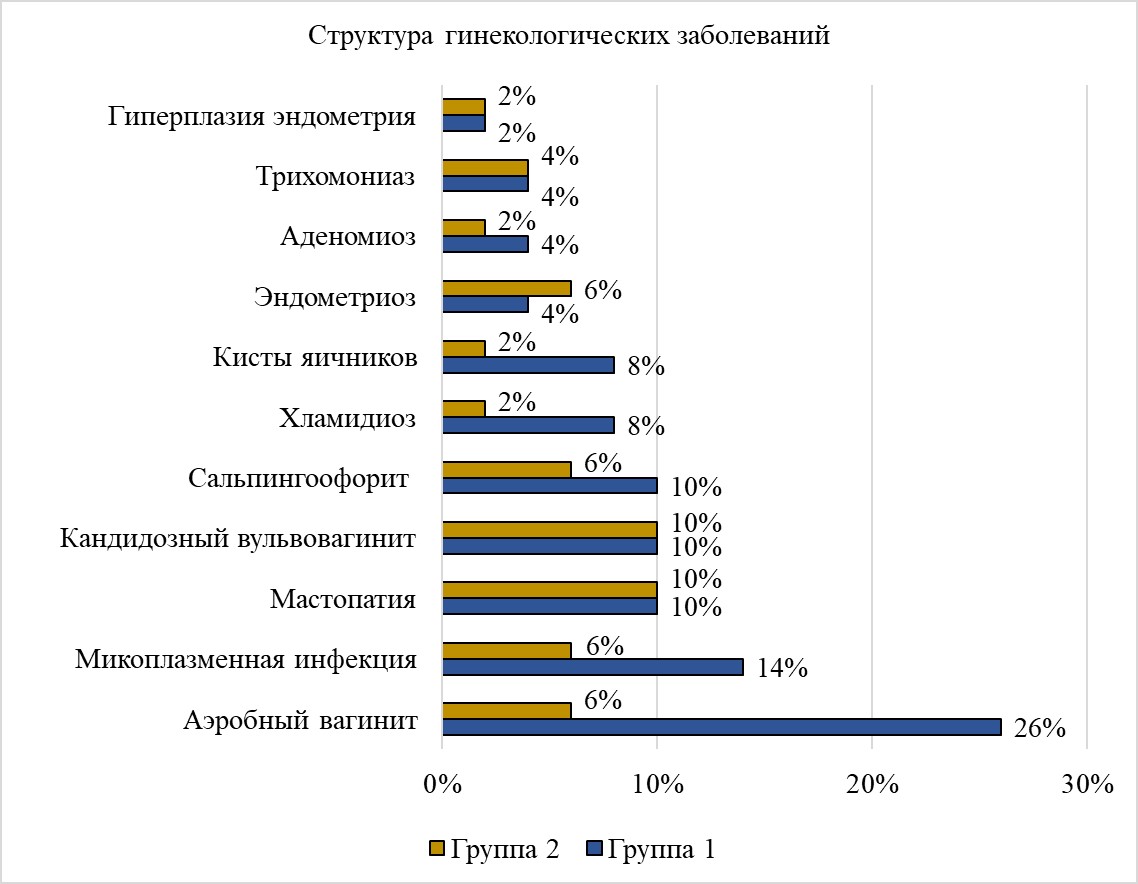
Рисунок 4 - Структура гинекологических заболеваний
Таблица 1 - Иммуно-гормональный профиль женщин основной группы
Показатели | Группа 1 (Основная) M ± m | σ (стандартное отклонение) |
Max. |
Min. |
АТ к прогестерону, мкг/мл (N < 6) | 13,77 ± 1,47 | 9,55 | 40,76 | 0,188 |
АТ к эстрадиолу, мкг/мл (N ≤ 20) | 41,28 ± 6,31 | 40,865 | 224,3 | 3,36 |
АТ к ХГЧ, мкг/мл (N ≤ 5) | 11,24 ± 1,32 | 8,575 | 37,31 | 0,203 |
В группе контроля диагностически значимого повышения уровня АТ не отмечалось, в целом они определялись в крови только у 11 женщин (22%). У 6 пациенток (14%) из первой группы (n=50) отмечались низкие титры всех исследуемых нами АТ, однако у остальной части группы (86%) они были высокими как минимум в одном из анализов, что указывает на статистическую значимость наличия повышенных титров антигормональных антител у пациенток с ПНБ (86% против 14%; p < 0,001). При этом изолированное превышение референсных значений одной из фракции антител регистрировалось в 5,7% случаев, двух – в 17,2%, трех – в 22,9%, всех – в 54,2% (рис. 5).
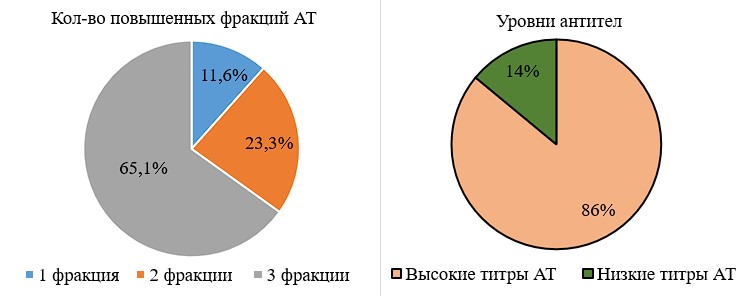
Рисунок 5 - Уровни антител и распределение по количеству единовременно повышенных фракций АТ
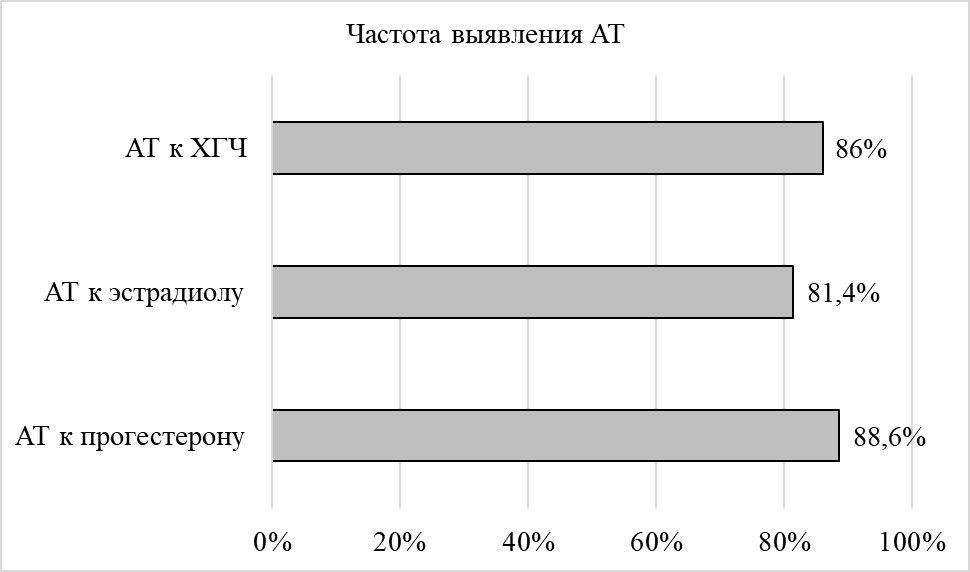
Рисунок 6 - Частота выявления АТ
Таблица 2 - Анализ линейной корреляции между количеством выкидышей/неразвивающихся беременностей и титром АТ
Теснота связи по Чэддоку | Корреляция (r) с кол-вом выкидышей |
АТ к: | Корреляция (r) с кол-вом неразвивающихся беременностей | Теснота связи по Чэддоку |
слабая (прямая) | 0,207486726 | прогестерону | 0,394313721 | умеренная (прямая) |
заметная (прямая) | 0,500955986 | эстрадиолу | 0,047782939 | слабая (прямая) |
слабая (прямая) | 0,196228201 | ХГЧ | 0,244517405 | слабая (прямая) |
Теснота корреляции между концентрацией АТ к эстрадиолу и количеством выкидышей в анамнезе была наиболее выраженной и расценивалась как «заметная».
В результате анализа линейной корреляции (r) между концентрациями различных фракций АТ у представительниц основной группы (см. табл. 3 и рис. 7) было установлено, что наибольшая корреляция титров со всеми разновидностями исследуемых антител отмечалась у АТ к ХГЧ, а наименьшая – у АТ к эстрадиолу («заметная» теснота связи), при этом в большинстве случаев связь оценивалась как «сильная» (тесная) или «средняя».
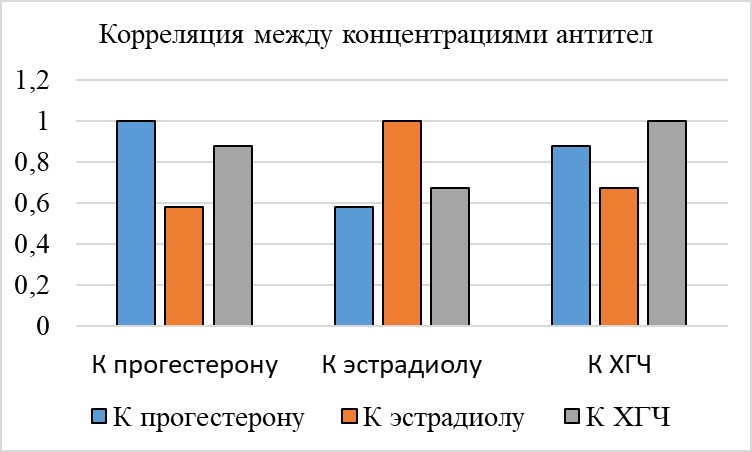
Рисунок 7 - Линейная корреляция (r) между фракциями АТ
Таблица 3 - Линейная корреляция (r) между фракциями АТ
АТ | К прогестерону | К эстрадиолу | К ХГЧ |
К прогестерону | 1 | 0,580369 | 0,877784 |
К эстрадиолу | 0,580369 | 1 | 0,672837 |
К ХГЧ | 0,877784 | 0,672837 | 1 |
3. Обсуждение
Нами была установлена умеренная корреляционная связь между наличием диагностического титра антител к прогестерону и количеством НБ в анамнезе, что косвенно может указывать на высокое значение иммуномодулирующих изменений в течение здоровой беременности. Концентрация АТ к эстрадиолу, напротив, имела наименьшую корреляцию со всеми видами антигормональных антител, но при этом «сильнее» других коррелировала с количеством выкидышей в анамнезе (прямая заметная связь).
Обращает на себя внимание и тот факт, что в исследуемой группе с большей частотой регистрировались инфекционно-воспалительные заболевания женских половых органов, при этом превалирование некоторых нозологий (аэробный вагинит) имеет статистическую значимость, что, вероятно, может указывать на их предрасполагающий характер к аутоиммунизации с вовлечением разных механизмов (потеря периферической толерантности, поликлональная лимфоцитарная активация и т.п.). Данный факт, по-видимому, также стоит рассматривать как возможную причину повышения титра антигормональных антител в исследовании.
Кроме того, стоит отметить высокую частоту встречаемости аллергических реакций в исследуемой группе, которая значительно превышала таковую в группе контроля. Данное повышение встречаемости гиперчувствительности косвенно подчеркивает особенности иммуннологических реакций у женщин с ПНБ, что в очередной раз подтверждает значительную роль патологических иммуно-гормональных изменений как компонента генеза привычного невынашивания.
В настоящее время помимо наличия определяемых в данном исследовании антител к гормонам, в качестве одного из потенциально перспективных индикаторов течения беременности рассматривается прогестерон-индуцированный блокирующий фактор-1 (PIBF1). Данный биохимический агент является белком, главная роль которого по мнению многих исследователей заключается в поддержании нормальной беременности . PIBF1 ингибирует активность естественных клеток-киллеров (NK), изменяет баланс цитокинов Th1/Th2 в пользу Т-хелперов второго типа, а также блокирует активность фосфолипазы А2, что в совокупности модулирует важнейшие эффекторные функции иммунной системы организма матери, обеспечивая возможность нормального течения гестации , . Кроме того, в настоящее время известно о существовании положительной корреляционной связи между уровнями PIBF1 и прогестерона во время беременности, которая отмечается во всех триместрах и, по-видимому, указывает на высокое значение прогестерон-индуцируемого блокирующего фактора-1, как биомаркера течения беременности , .
4. Заключение
Результаты нашего исследования подтверждают существующую в настоящее время концепцию иммунологических нарушений при ПНБ. Установленные титры АТ к некоторым гормонам не имели сильной прямой корреляции с количеством неразвивающихся беременностей и выкидышей в анамнезе, однако превышение их допустимой концентрации практически у всех исследуемых женщин указывает на безусловную роль этих молекул в патогенезе ПНБ.
Помимо высоких титров антител к гормонам для исследуемых женщин было характерно наличие высокого удельного веса аллергий в анамнезе, а также воспалительных заболеваний женских половых органов, которые, вероятно, также вносят свою лепту в развитие иммунологических нарушений или являются их следствием.
Данный факт в очередной раз подтверждает необходимость дальнейшего изучения механизмов антителообразования и аутоиммунизации при беременности, как одних из ведущих факторов возникновения репродуктивных потерь в настоящее время, что позволит в дальнейшем сформировать эффективные схемы патогенетической терапии данных нарушений.
