Experience of Treatment of Patients with Complicated Gastric Cancer in an Emergency Inpatient Unit
Experience of Treatment of Patients with Complicated Gastric Cancer in an Emergency Inpatient Unit
Abstract
Gastric cancer ranks fifth in the structure of global cancer morbidity and fourth in the structure of causes of cancer mortality. Almost half of primary hospitalizations occur at the stage of already complicated course of the oncological process. The aim of the study is to improve the results of treatment of patients with complicated forms of gastric cancer through the use of laparoscopic technologies in surgery. 103 patients with gastric cancer complicated by bleeding and stenosis were included in the retrospective monocentric study. All patients were operated in the scope of gastrectomy, proximal or distal subtotal gastric resection. In the main group (n=51) patients were operated from laparoscopic access, in the control group (n=52) laparotomy was performed. The incidence of postoperative complications was lower in the main group compared to the control group: 29.4% and 71.2%. Early postoperative mortality was 3.9% in the main group and 17.3% in the control group (p=0.009). The odds of developing lethality in the control group were 10.3 times increased (95% CI: 1.25-84.27). The recurrence of gastric cancer was observed in the main group in 9.8% of patients, in the control group – 32.6% of patients (p=0,004), two-year recurrence-free survival rate – 75.4% and 41.6% respectively, lethality as a result of gastric cancer recurrence in the main group was 5.8%, in the control group – 9.6% (p>0,05), two-year overall survival rate in the main and control groups was 87% and 74.2% respectively. The obtained results suggest that the use of laparoscopic technologies in radical surgical treatment of patients with complicated forms of gastric cancer contributes to the improvement of treatment quality by reducing the incidence of postoperative complications, lethality, recurrence and increasing the overall and recurrence-free survival rate.
1. Введение
Рак желудка занимает пятое место в структуре общемировой онкологической заболеваемости и четвертое место в структуре причин онкологической смертности
. Несмотря на развитие программ скрининга на выявление ранних форм рака желудка в ряде стран Азии, у 75% пациентов рак желудка диагностируется на III-IV стадии, а у 14- 43% обнаруживается метастатическая диссеминация по брюшине на момент первичной диагностики , .Из общего числа пациентов с раком желудка, 40% госпитализаций происходят в результате осложнений рака желудка
. Наиболее частыми осложнениями рака желудка являются кровотечение (22-80%) , , , прогрессирующий опухолевый стеноз (26-60%) , и перфорация (менее 5%) .Алгоритм лечения пациентов с раком желудка, осложненным кровотечением сводится в первую очередь к устранению жизнеугрожающего состояния – выполнению эндоскопического гемостаза или трансартериальной эмболизации
, , . В случае неэффективности минимально-инвазивных методов необходимо выполнение экстренного хирургического вмешательства в объеме паллиативной резекции или гастрэктомии , , . Частота послеоперационных осложнений после экстренных или отсроченных хирургических вмешательств у пациентов с кровотечением в результате рака желудка составляет 23-46%, послеоперационная летальность – 5-35%, частота R1 резекций желудка – 33-45% , . Таким образом, на сегодняшний день остается до конца не стандартизированным хирургический подход у пациентов с раком желудка, осложненным кровотечением.При развитии такого осложнения рака желудка как злокачественная обструкция выходного отдела, основным принципом лечения является выполнение декомпрессии желудка с помощью либо эндоскопического стентирования или формирования паллиативного гастроэнтероанастомоза
, . В современных публикациях рассматриваются вопросы эффективности радикального хирургического лечения в условиях злокачественного стеноза выходного отдела желудка, в объеме гастрэктомии из лапароскопического и открытого доступов, а также проксимальной и дистальной резекции желудка, в зависимости от локализации опухоли . До сих пор отсутствует единый стандарт хирургического лечения пациентов со злокачественным стенозом выходного отдела желудка, что делает данную группу пациентов крайне сложной , , , .На сегодняшний день в национальных и зарубежных рекомендациях по лечению рака желудка четко определены стратегии для неосложненных форм рака желудка. Однако в отношении осложненных форм рака желудка до сих пор в рекомендациях отсутствует единый алгоритм лечения
.Это явилось обоснованием для проведения нами клинического исследования, целью которого стало систематизированное понимание существующих методов хирургического лечения и осуществление шага к созданию стандартизированного алгоритма.
Целью исследования являлось улучшение результатов лечения пациентов с осложненными формами рака желудка за счет использования лапароскопических технологий в хирургии.
Задачами исследования являлись оценка непосредственных результатов хирургического радикального лечения пациентов с осложненным раком желудка в зависимости от операционного доступа, анализ отдаленных результатов радикального хирургического лечения пациентов, которым были выполнены операции по срочным показаниям, общая и безрецидивная двухлетняя выживаемость, анализ влияния факторов на риск рецидива и летальности в результате рецидива рака желудка у пациентов после радикального вмешательства.
2. Методы и принципы исследования
С целью изучения эффективности применения лапароскопии в лечении пациентов с раком желудка, осложненным кровотечением и стенозом в период с 2013 г. по 2022 г. в ГБУЗ «НИИ СП им. Н. В. Склифосовского ДЗМ» было проведено моноцентровое сравнительное ретроспективное исследование, в которое был включен 141 пациент с осложненными формами рака желудка: 72,3% пациентов с раком желудка, осложненным кровотечением; 16,3% пациентов с комбинированным осложнением рака желудка – стенозом кардиального/антрального отделов желудка и кровотечением; 11,4% пациентов со стенозом кардиального или антрального отделов желудка.
Хирургическое лечение при осложненном раке желудка подразделяется на паллиативное и радикальное. Паллиативное хирургическое лечение было выполнено 38 пациентам с раком желудка, осложненным кровотечением (n=24) или стенозом опухолевого канала (n=13), которым были выполнены минимально-инвазивные вмешательства: эндоскопический гемостаз (n=6; 15,8%), трансартериальная эмболизация питающих опухоль сосудов (n=19; 50%) и эндоскопическая установка саморасширяющегося стента в опухолевый канал (n=13; 34,2%).
Радикальное хирургическое вмешательство было выполнено 103 (73,1%) пациентам с осложнениями рака желудка, в первую очередь в силу высокого риска рецидива кровотечения.
Пациенты, которым было выполнено радикальное хирургическое вмешательство, были распределены на две группы. В основной (n=51; 36,2%) пациенты оперированы из лапароскопического доступа, в контрольной группе (n=52; 36,9%) – из лапаротомного: гастрэктомия с резекцией абдоминального отдела пищевода (основная группа – 62,7%, контрольная группа – 67,3%); проксимальная резекция желудка (основная группа – 7,8%, контрольная группа – 9,6%), субтотальная дистальная резекция желудка (основная группа – 29,4%, контрольная группа – 23,1%).
В основной группе было 62,7% мужчин и 37,3% женщин, в контрольной – 61,5% и 38,5% соответственно. Средний возраст пациентов в основной группе составил 57,2±9,4 лет, в контрольной – 63,6±11 лет (p>0,05). Сопутствующие заболевания были диагностированы у 49% пациентов основной и 69,2% пациентов контрольной группы. Проведение исследования было одобрено этическим комитетом по биомедицинской этике ГБУЗ «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского Департамента здравоохранения г. Москвы», протокол № 5-21 от 25.05.2021 г. При госпитализации всем пациентам выполняли общие анализы крови и мочи, эзофагогастродуоденоскопию с последующей множественной биопсией ткани опухоли (6–8 образцов с разных зон опухоли) и подозрительных участков слизистой оболочки желудка для морфологического исследования с целью окончательного подтверждения диагноза.
Всем пациентам, у которых по данным первичной диагностики были выявлены клинические стадии IB-III и установлен высокий риск рецидива кровотечения, выполнено радикальное хирургическое лечение в отсроченном порядке или плановом порядке.
Объем вмешательства определялся в соответствии с локализацией опухоли и распространенностью опухолевого процесса за пределы стенки желудка на междисциплинарном онкологическом консилиуме.
При локализации опухоли в проксимальных отделах желудка (кардиоэзофагеальный переход, кардия) выполнялась проксимальная резекция желудка с резекцией нижней трети пищевода, формированием двухрядного эзофагоэнтероанастомоза (ручным или аппаратным методами) на изолированной по Ру петле (7,8% в основной группе и 9,6% в контрольной группе, p > 0,05).
В случае поражения тела желудка, нескольких отделов, субтотального или тотального поражения пациентам выполняли гастрэктомию с резекцией абдоминального отдела пищевода, формированием двухрядного эзофагоэнтероанастомоза на отключенной по Ру петле тонкой кишки (62,7% в основной группе, 67,3% - в контрольной группе, р > 0,05).
При локализации опухоли изолированно в антральном отделе желудка пациентам была выполнена субтотальная дистальная резекция желудка с формированием гастроэнтероанастомоза по Бильрот I (29,4% в основной группе, 23,1% - в контрольной группе, р > 0,05).
Медиана длительности операции в основной группе составила 365 минут (Q1-Q3: 306-450), в контрольной группе – 287,5 минут (245-407,5) (р=0,0005). Медиана объема кровопотери в основной группе составила 150 мл (100-200 мл), в контрольной группе – 300 мл (200-500 мл) (р<0,05).
В обеих группах пациентам была выполнена лимфодиссекция D2. Медиана количества лимфатических узлов в препарате составила 46 (36,5-48) в основной группе, в контрольной – 35,5 (30,5-40) (р=0,003). Медиана количества лимфатических узлов, пораженных метастазами (N1 и выше) в основной группе составила 2 (1-5,5), в контрольной группе – 1 (0-5) (р<0,001).
У 43,1% пациентов основной группы наблюдалась инвазия опухоли в субсерозную соединительную ткань без распространения на висцеральную брюшину и другие органы (pT3). В контрольной группе наблюдалась подобная тенденция: у большинства пациентов (32,7%) была выявлена патоморфологическая стадия pT3.
У 43,1% пациентов основной группы после патоморфологического исследования метастазы были обнаружены в 1-2 лимфатических узлах (pN1). В контрольной группе у 36,5% пациентов метастазы в регионарных лимфатических узлах не были обнаружены – pN0. Таким образом, пациентов с поражением более 7 регионарных лимфатических узлов меньше всего (9,8% в основной группе и 9,6% в контрольной группе) в обеих группах, а пациентов с поражением более 15 лимфатических узлов ни в одной из групп не наблюдалось. M1 были выявлены у 3,9% пациентов в основной группе и у 13,5% пациентов в контрольной группе.
У наибольшего числа пациентов в основной группе была диагностирована стадия IIB, а в контрольной группе чаще встречались пациенты со стадией IIIA (таблица №1).
Таблица 1 - Распределение пациентов в зависимости от стадии рака желудка
Основная группа | Контрольная группа | |||
Абс. число | % | Абс. число | % | |
IA | 2 | 3,9 | 2 | 3,9 |
IB | 8 | 15,7 | 9 | 17,3 |
IIA | 8 | 15,7 | 8 | 15,4 |
IIB | 18 | 35,3 | 9 | 17,3 |
IIIA | 10 | 19,6 | 12 | 23,1 |
IIIB | 2 | 3,9 | 4 | 7,7 |
IIIC | 1 | 2 | 1 | 1,9 |
IV | 2 | 3,9 | 7 | 13,5 |
Обработка и анализ полученных данных выполнялись с помощью программы IBM SPSS Statistics 26 Version. Первично выполняли оценку нормальности распределения (критерий Колмогорова–Смирнова), для последующего применения параметрических или непараметрических методов. Для выявления зависимости бинарных переменных от количественных переменных применялся дискриминантный анализ. Анализ возможного влияния факторов на частоту рецидива от объема лимфодиссекции проводился с помощью ANOVA. Для выявления зависимости бинарных показателей от категориальных показателей применяли метод бинарной логистической регрессии. Взаимосвязь между количественными и порядковыми переменными проверялась посредством корреляционного анализа с применением коэффициентов Спирмена или Пирсона. Анализ безрецидивной и общей выживаемости проведен с помощью метода Каплана–Мейера.
3. Основные результаты
Результаты исследования были разделены на непосредственные и отдаленные. К непосредственным относились длительность госпитализации, послеоперационные осложнения, послеоперационная летальность и сроки начала адъювантной химиотерапии.
Медиана общего койко-дня в основной группе составила 18 койко-дней (Q1-Q3: 15- 21,5 койко-дней), в контрольной группе – 26,5 койко-дней (Q1-Q3: 19-36 койко-дней) (р < 0,01).
Частота послеоперационных осложнений была ниже в основной группе по сравнению с контрольной: 29,4% и 71,2% соответственно (таблица № 2).
Таблица 2 - Общее распределение пациентов в зависимости от класса осложнений по Clavien-Dindo
Основная группа | Контрольная группа | |||
Абс. число | % | Абс. число | % | |
I | 6 | 11,8 | 20 | 38,5 |
II | 1 | 2 | 4 | 7,7 |
IIIa | 4 | 7,8 | 1 | 1,9 |
IIIb | 3 | 5,9 | 2 | 3,9 |
IVa | 0 | 0 | 1 | 1,9 |
IVb | 0 | 0 | 0 | 0 |
V | 2 | 3,9 | 9 | 17,3 |
Шансы развития послеоперационных осложнений увеличивались в 5,92 раза у пациентов, перенесших радикальное оперативное вмешательство из лапаротомного доступа (95% ДИ: 2,53-13,85; р<0,001).
В основной группе ранняя послеоперационная летальность составила 3,9%, в контрольной группе – 17,3% (р=0,009). Шансы развития летального исхода в контрольной группе увеличивались в 10,3 раза (95% ДИ: 1,25–84,27).
Была разработана прогностическая модель для определения вероятности развития послеоперационных осложнений в зависимости от разных факторов методом бинарной логистической регрессии. У пациентов мужского пола шансы развития послеоперационных осложнений снижались в 0,36 раз (95% ДИ: 0,12-1,08), при увеличении возраста на 1 год шансы развития послеоперационных осложнений увеличивались в 1,09 раз (95% ДИ: 1,03-1,16), при увеличении класса анестезиологического риска на 1 единицу шанс развития послеоперационных осложнений увеличивались в 1,99 раз (95% ДИ: 0,89-4,44), при снижении уровня гемоглобина на 1 г/л шансы развития послеоперационных осложнений увеличивались в 1,03 раза (95% ДИ: 1,00-1,06), при увеличении степени тяжести анемии на 1 ступень отмечалось увеличение шансов развития осложнений в 13,82 раз (95% ДИ: 1,92-99,69). При увеличении типа операционного доступа на 1 единицу (0 – лапароскопия, 1 – лапаротомия) шансы развития осложнений увеличивались в 3,09 раз (95% ДИ: 1,02-9,38). Наконец, при увеличении объема операции до гастрэктомии с резекцией абдоминального отдела пищевода также отмечалось увеличение шансов развития осложнений в 2,08 раз (95% ДИ: 0,89-4,83) (рисунок 1).
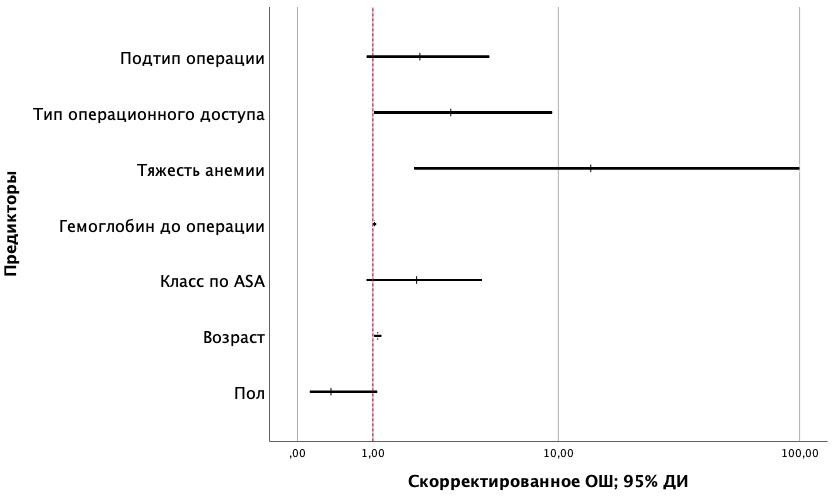
Рисунок 1 - Оценки отношения шансов с 95% ДИ для изучаемых предикторов развития послеоперационных осложнений
К изучаемым отдаленным результатам радикального хирургического лечения относились частота рецидива рака желудка, летальность в результате рецидива, безрецидивная и общая двухлетняя выживаемость.
В основной группе после выписки мониторинг проводился у 64,7% пациентов, в контрольной группе – у 71,2% (р=0,53). Медиана периода наблюдения в основной группе составила 38 месяцев (Q1-Q3: 0-61,5 месяц), в контрольной группе также 38 месяцев (Q1- Q3: 14-64,5 месяцев).
Рецидив рака желудка наблюдался в основной группе у 9,8% пациентов, в контрольной группе – 32,6% пациентов (р=0,004).
Однолетняя безрецидивная выживаемость в основной и контрольной группах составила 96,8% и 91,8% соответственно, двухлетняя безрецидивная выживаемость – 75,4% и 41,6% соответственно (рисунок 2).
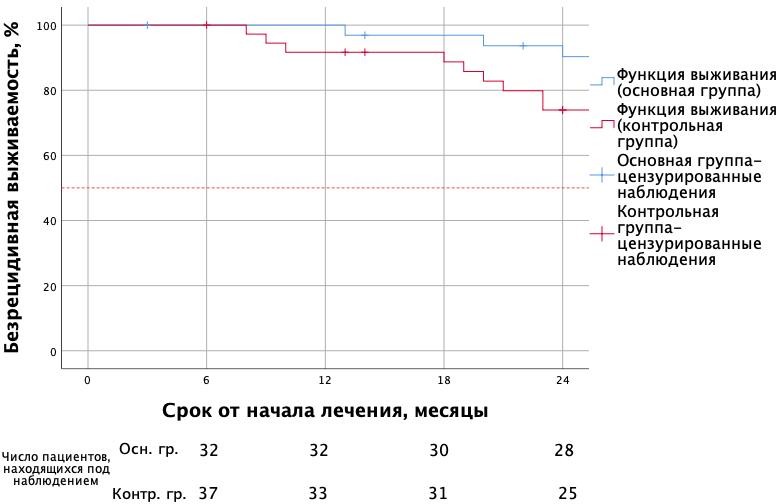
Рисунок 2 - Соотношение безрецидивной выживаемости в основной и контрольной группах
С помощью дискриминантного анализа мы проверили зависимость частоты рецидива рака желудка от различных факторов. Отмечалось статистически значимое увеличение риска развития рецидива при уменьшении количества удаленных лимфоузлов в препарате в 0,912 раз (р=0,014) и при увеличении стадии рака желудка на 1 уровень в 1,922 раза (р=0,003).
Летальность в результате рецидива рака желудка в основной группе составила 5,8%, в контрольной группе – 9,6%, что не выявило статистической значимости разницы (р>0,05). Двухлетняя общая выживаемость в основной и контрольной группах составила 87% и 74,2% соответственно (рисунок 3).
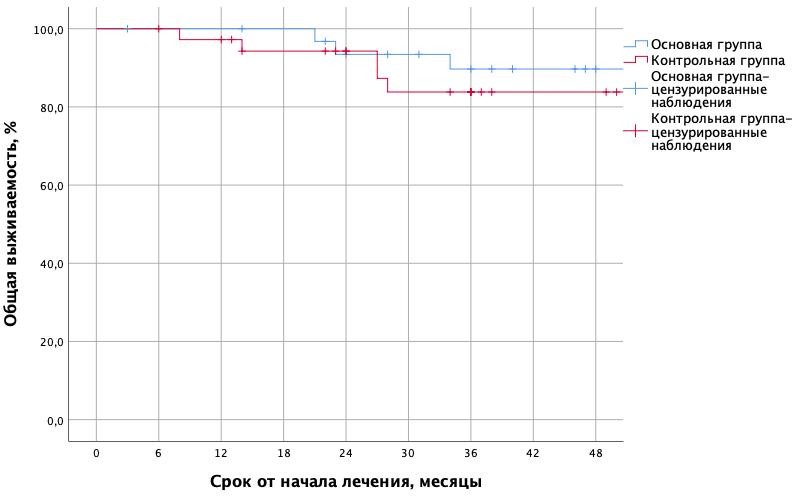
Рисунок 3 - Кривая Каплана-Мейера, характеризующая общую выживаемость пациентов
Медиана срока выживания при N1 cоставила 58,5 месяцев, при N2 – 27,5 месяцев, при N3 – 24 месяца.
При оценке комплексного влияния факторов на риск летального исхода в результате рецидива с помощью метода регрессии Кокса выявлено увеличение риска развития рецидива при увеличении стадии рака желудка на 1 уровень в 15,9 раз, близкое к статистически достоверному (р=0,061). (таблица №3)
Таблица 3 - Зависимость риска летальности от рецидива по сравнению с базовым в зависимости от влияния отдельных факторов
Фактор риска | Изменение риска при уменьшении или увеличении фактора на 1 | р | |
ОР | 95% ДИ | ||
Количество лимфоузлов в препарате | 0,732 | 0,520-1,032 | 0,075 |
Количество лимфоузлов, пораженных метастазами | 1,276 | 0,785-2,074 | 0,326 |
Стадия рака желудка | 15,861 | 0,877-286,696 | 0,061 |
Срок начала АХТ, дни после операции | 0,887 | 0,635-1,240 | 0,483 |
4. Обсуждение
На основании проведенного нами исследования был получен ряд результатов, свидетельствующих о существенных преимуществах применения лапароскопических технологий в хирургическом лечении пациентов с осложненным раком желудка. Несмотря на большую продолжительность лапароскопических операций ввиду более прецизионной техники и лучшей визуализации анатомических структур отмечался меньший объем интраоперационной кровопотери и большее число удаленных лимфатических узлов в препарате. Это, в свою очередь, повышало шансы обнаружения лимфатических узлов, пораженных метастазами. Таким образом, удавалось косвенно снижать риск рецидива.
Было установлено, что в основной группе безрецидивная выживаемость была выше по сравнению с контрольной группой. Данный показатель зависел от количества лимфатических узлов в препарате и патоморфологической стадии заболевания, корректность установки которой зависела от объема лимфодиссекции. Таким образом, объем лимфодиссекции оказался выше при лапароскопическом доступе, что указывает на его преимущество в вопросе увеличения двухлетней безрецидивной выживаемости. Таким образом, было установлено, что при увеличении числа лимфатических узлов, пораженных метастазами, в удаленном препарате, снижалась медиана срока выживания.
Непосредственные послеоперационные результаты демонстрируют преимущество лапароскопического доступа. Медиана длительности госпитализации в контрольной группе оказалось дольше в 1,5 раза по сравнению с данным показателем в основной группе. Шансы развития послеоперационных осложнений увеличивались в 5,92 раза у пациентов, перенесших радикальное оперативное вмешательство из лапаротомного доступа (95% ДИ: 2,53-13,85), а самым частым послеоперационным осложнением являлась раневая инфекция, которая значительно увеличивала сроки госпитализации. Ранняя послеоперационная летальность была почти в 4,5 раза выше в контрольной группе (3,9% и 17,3%), именно за счет большего числа послеоперационных осложнений и их более тяжелому течению.
В зависимости от сроков выписки из стационара определялось и начало адъювантной химиотерапии, что в свою очередь зависело от особенностей течения послеоперационного периода. Таким образом, медиана срока начала адъювантной химиотерапии в основной группе была в 1,2 раза меньше по сравнению с контрольной группой, данная разница была статистически значимой (р=0,003).
Таким образом, нами была получена статистически значимая разница между группами по таким показателям как общая длительность госпитализации, частота развития послеоперационных осложнений, послеоперационная летальность и срок начала адъювантной химиотерапии.
Наиболее значимым отдаленным результатом являлась более низкая частота развития рецидива и более высокая 2-летняя безрецидивная выживаемость.
Отмечалось статистически значимое увеличение риска развития рецидива при уменьшении количества удаленных лимфоузлов в препарате и при увеличении стадии рака желудка на 1 уровень. Это объясняется тем, что при недостаточном объеме лимфодиссекции повышается риск пропущенных лимфоузлов, пораженных метастазами.
Из результатов модели, построенной методом бинарной логистической регрессии, было выявлено, что основным фактором, потенциально увеличивающим риск рецидива являлась первоначальная распространенность онкологического процесса по лимфогенному пути, то есть количество регионарных лимфатических узлов, пораженных метастазами: при увеличении числа лимфатических узлов, пораженных метастазами, в удаленном препарате, снижалась медиана срока выживания, что оказалось статистически значимым параметром.
Общая двухлетняя выживаемость оказалась выше в основной группе. Данный показатель зависел в первую очередь от стадии онкологического процесса, однако статистической значимости по данному фактору не получено.
5. Заключение
Таким образом, мы пришли к статистически обоснованному выводу, что применение лапароскопических технологий у пациентов с осложненными формами рака желудка приводит к значительному снижению частоты послеоперационных осложнений и послеоперационной летальности. Также в ходе лапароскопически-ассистированной радикальной резекции желудка удается выполнить более прецизионную лимфодиссекцию, увеличить количество лимфатических узлов в препарате и, таким образом, повысить вероятность обнаружения лимфатических узлов с метастазами, что, в свою очередь, имеет непосредственное влияние на увеличение 2-летней безрецидивной и 2-летней общей выживаемости пациентов. Применение лапароскопических технологий в нашем исследовании продемонстрировало безопасность и эффективность методики для пациентов с раком желудка, осложненным кровотечением или злокачественными стенозом кардиального и антрального отделов желудка, что требует в дальнейшем проведения более мощного и многоцентрового исследования, для оформления полученных выводов в рекомендации и современный стандартизированный алгоритм.
Выводы:
1. Частота развития послеоперационных осложнений и послеоперационная летальность после лапароскопических операций статистически значимо ниже по сравнению с открытыми вмешательствами.
2. Рецидив рака желудка и летальность в результате рецидива после первично лапароскопических вмешательств ниже по сравнению с открытыми операциями.
3. Двухлетняя безрецидивная выживаемость и двухлетняя общая выживаемость после лапароскопических вмешательств по поводу осложненных форм рака желудка выше по сравнению со стандартными вмешательствами.
4. Общее число лимфатических узлов в препарате, число лимфоузлов, пораженных метастазами, стадия рака желудка оказывают статистически значимое влияние на увеличение риска рецидива.
