Diagnostic search for recurrent bronchopulmonary syndrome in children: a clinical case of pneumofibrosis development in an atopic child
Diagnostic search for recurrent bronchopulmonary syndrome in children: a clinical case of pneumofibrosis development in an atopic child
Abstract
Pneumofibrosis in chronic non-specific lung diseases (COPD) in children develops due to prolonged, persistent inflammation and represents irreversible damage to the lung parenchyma. Recurrent infections combined with allergic inflammation form a "vicious circle" leading to pathological fibrogenesis. Objective. To demonstrate the complexity of the differential diagnosis of recurrent bronchopulmonary syndrome in a child with atopy and the development of pneumofibrosis. Materials and methods. A case of an 8-year-old girl with recurrent bronchopulmonary syndrome is presented. Results. Prominent markers of atopy were identified: IgE 1687 ME/ml, blood eosinophilia 22% (1.87×10⁹/l), nasal secretion 98%, increased FeNO level to 48-64 ppb, sensitisation to household and epidermal allergens. Changes in immune status (increased IgG, spontaneous HST test up to 42%, decreased phagocytosis reserve) reflect chronic immune activation. Multislice computed tomography (MSCT) of the chest organs (CO) showed bilateral pneumofibrosis. Moderate bronchial asthma was diagnosed. Positive dynamics was achieved with basic therapy with combined iGCS. This case demonstrates that the combination of eosinophilic and neutrophilic inflammation creates unfavourable conditions for the development of pneumofibrosis. It highlights the necessity of early diagnosis of bronchial asthma, comprehensive evaluation of immunological status, and timely performance of MSCT of the thoracic region in children with recurrent bronchopulmonary syndrome.
1. Введение
Пневмофиброз при ХНЗЛ у детей развивается на фоне длительного персистирующего воспаления и представляет собой необратимое структурное повреждение легочной паренхимы , . Основным повреждающим фактором, приводящим к необратимым структурным изменениям лёгочной ткани, часто выступают именно рецидивирующие инфекции нижних дыхательных путей. Каждый эпизод инфекции вызывает прямое повреждение эпителия и паренхимы, запуская процессы регенерации альвеолоцитами второго типа . В условиях персистирующего воспаления, особенно при сочетании инфекционного и аллергического компонентов, физиологическая репарация замещается патологическим фиброгенезом с избыточным отложением коллагена и необратимым изменением архитектоники лёгких , , , . Таким образом, формируется порочный патологический круг, в котором инфекция и аллергия взаимно усугубляют друг друга: инфекционный процесс провоцирует обострение и усугубляет течение атопического процесса, а хроническое аллергическое воспаление снижает сопротивляемость инфекциям. Цель. Продемонстрировать сложность дифференциальной диагностики рецидивирующего бронхолёгочного синдрома у ребёнка с атопией с формированием пневмофиброза.
Представлена клиническое наблюдение девочки 8 лет с рецидивирующим бронхолегочным синдромом, находившейся на лечении в клинике Хабаровского Филиала НИИ охраны материнства и детства.
2. Основные результаты
Демонстрация клинического случая. Пациентка Д., 8 лет, поступила в клинику Хабаровского Филиала НИИ охраны материнства и детства в плановом порядке с жалобами на частые респираторные заболевания по типу бронхитов с бронхообструктивным синдромом (БОС), повторные пневмонии. Анамнез заболевания: пульмонологический анамнез отягощен с 1,5 лет, когда впервые перенесла БОС. С этого возраста заболевания стали приобретать затяжной характер — БОС 3–4 раза в год, повторные пневмонии различной локализации (2019г — в S10 справа, S4 слева, 2020г — пневмония слева S10, 2023г — S1-2 справа, 2024 г – S4-5 слева). Антибиотикотерапия 3-4 раза в год. В 2020г при обследовании амбулаторно в частной клинике выявлена сенсибилизация к шерсти и эпителию кошки. За последние 6 месяцев перенесла БОС 3 раза, потребности в АБТ не было. Приступы сняты ингаляционными глюкокортикостероидами (ИГКС) глюкокортикостероидов, бронхолитиками.
Анамнез жизни: Ребёнок от 2-й беременности, протекавшей с анемией и гестационным сахарным диабетом у матери. Роды 2-е, срочные, путём операции кесарева сечения. Масса при рождении 3970 г, рост 56 см, оценка по шкале Апгар 8/9 баллов. Перенесённые заболевания: ветряная оспа, частые ОРЗ, ротавирусная инфекция. Наблюдается у кардиолога (ВПС: открытый артериальный проток, компенсированный, НК0), невролога (астено-вегетативный синдром). Отягощена наследственность по атопии и желчнокаменной болезни. Аллергоанамнез: атопический дерматит в раннем возрасте.
Объективный статус при поступлении: состояние удовлетворительное. Рост 128,5 см, масса 24,4 кг (ИМТ 14,7 кг/м², норма). Кожные покровы чистые. Носовое дыхание компенсировано, голос с гнусавым оттенком. В лёгких дыхание жёсткое, ослаблено в нижних отделах справа, хрипов нет. ЧДД 20 в мин. SpO2 99%. Тоны сердца ясные, ритмичные. ЧСС 80 уд/мин. Живот мягкий, безболезненный.
По результатам обследования: Общий анализ крови: Hb — 124г/л Э — 4,6·1012/л Л — 8,5·109/л п -0% с -27% э -22% б — 1% л — 41% м — 9% СОЭ - 4мм/ч. Эозинофилия относительная и выраженная абсолютная (1,87 × 10⁹/л, при норме до 0,5× 10⁹/л). Острофазовые показатели крови: АСЛО, СРБ, РФ — отрицательно. Биохимия крови: общий белок — 74г/л; глюкоза — 4,6ммоль/л, холестерин — 4,0ммоль/л, билирубин об. 10,1 мкмоль/л, прямой 2,4 мкмоль/л, ЩФ 153ед/л, железо 30,1мкмоль/л, ОЖСС 71,4мкмоль/л (норма 40–70). Признаки латентного дефицита железа. Иммуноглобулин Е общий: 1687 (норма до 90 МЕ/мл). Анализ крови на ИГЕ специфический: выявлена сенсибилизация к клещу домашней пыли, микст (Dermatophagoides Pteronyssinus, Dermatophagoides farinae, Euroglyphus maynei, Dermatophagoidesmicroceras, Acarus siro, Lepidoglyfus destructor, Tyrophagus putreus, Glycophagus domesticus) — 0,59 МЕ/мл, эпителию кошки 0,5 МЕ/мл, эпителию собаки 0,64 МЕ/мл (Норма до 0,5 МЕ/мл). ИФА на гельминты: антитела к а/г токсакар — отриц, а/г аскарид — отрицательно. Анализ крови на гуморальное звено иммунитета: lgA 1,70г/л, lgM 1,81 г/л, lgG 15,48 г/л. ЦИК 40 у.е. Анализ крови на фагоцитарное звено иммунитета: ФАН сп 54%, ст 70%, НСТ сп 42%,ст 60%, ФЧ сп 3,2ед, ст 4,10ед. Общий анализ мочи: цвет — с/ж, прозрачность — полная, плотность — 1015, белок — 0,122г/л (норма до 0,12г/л), лейкоциты — 1–2 в п/з, эпителий плоский ед.в п/зр. В цитологии носового секрета: лейкоциты 100–120 в п/зр (эозинофилы 98%). ПЦР мазка из зева: ЦМВ отрицательно; ВЭБ отрицательно, Герпес 6тип — положительно, Chl. pneumoniae — отрицательно, Мyc. рneumoniae — отрицательно. Бак посев из зева и носа: роста нет. По ЭКГ от 02.06.25: синусовая аритмия с ЧСС 73–107 мин. Нормальное положение ЭОС. Ускоренное АВ-проведение. По результатам оценки функции внешнего дыхания (спирометрия): исходно ЖЕЛ 97%, ФЖЕЛ 75%, ОФВ1 84%, МОС 25 – 90%, МОС 50–80%, МОС 75–80%. Нарушения проходимости трахеобронхиального дерева не выявлено. Результат пробы с бронхолитиком — положительно (прирост ОФВ1 на 16%). Уровень оксида азота в выдыхаемом воздухе — 48–64ppb (норма до 20 ppb). По УЗИ сердца: ВПС: открыты аортальный проток, компенсация. При проведении СКТ ОГК легкие расправлены. Легочный рисунок не усилен. Очагово-инфильтративных изменений не выявлено. Отмечается утолщение междолевой плевры на границе S4 и S6 сегментов правого легкого. Линейные пневмофиброзные изменения S5 левого легкого. Корни легких структурны, не расширены. Средостение не смещено, дополнительных образований не выявлено. Контуры диафрагмы четкие, ровные. Латеральные синусы свободные. Сердце обычных размеров. Костно-травматических и костно-деструктивных изменений на уровне исследования не выявлено. Мягкие ткани на уровне исследования без особенностей.
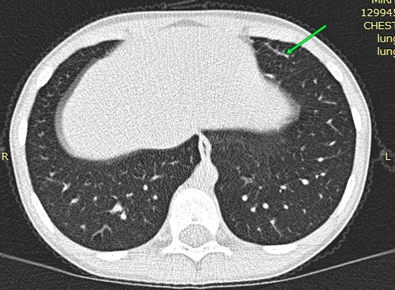
Рисунок 1 - MCКТ органов грудной клетки у ребенка Д
Примечание: стрелкой обозначен участок пневмофиброза в S5 слева (сагиттальный срез)
Ребенок выписан на амбулаторный этап под наблюдение педиатра, аллерголога-иммунолога, пульмонолога. Базисная терапия ИГКС продолжена в прежнем объеме, с учетом нарушения носового дыхания и проявления аллергического ринита монтелукаст 5мг внутрь, Мометазон по 1дозе в оба носовых хода на ночь, терапия персистенциии герпесвирусной инфекции инозин пранобекс 50 мг/кг массы тела/сут 3 курса по 10 дней с перерывом 20 дней, коррекция латентного дефицита железа. Через 6 месяцев проводимого лечения и динамического наблюдения состояние ребенка удовлетворительное, активных жалоб нет, острая респираторная инфекция однократно легкого течения, эпизодов БОС не отмечалось, переносимость физической нагрузки хорошая.
3. Обсуждение
У пациентки выявлены выраженные маркеры атопии: резко повышенный уровень общего IgE (1687 МЕ/мл при норме до 90), выраженная эозинофилия крови (22%, абсолютное количество 1,87×10⁹/л), эозинофилия назального секрета (98%), сенсибилизация к клещам домашней пыли и эпидермальным аллергенам. Высокий уровень оксида азота в выдыхаемом воздухе (FeNO 48-64 ppb при норме до 20 ppb) подтверждает наличие эозинофильного воспаления 2-го типа в дыхательных путях. Атопическое воспаление, опосредованное эозинофилами и Th2-цитокинами (IL-4, IL-5, IL-13), обладает самостоятельным профибротическим потенциалом . Эозинофилы секретируют TGF-β (трансформирующий фактор роста), стимулирующий пролиферацию фибробластов и отложение коллагена, а IL-13 непосредственно индуцирует тканевой фиброз . В свою очередь, хроническое аллергическое воспаление нарушает эпителиальный барьер и мукоцилиарный клиренс, снижая локальную противоинфекционную резистентность и создавая благоприятные условия для персистенции и повторного инфицирования.
Выявленные изменения иммунного статуса отражают состояние хронической иммунной активации на фоне длительного воспалительного процесса. Повышение уровня IgG (15,48 г/л при норме до 15,0 г/л) свидетельствует о хроническом антигенном стимулировании, что характерно для рецидивирующих инфекций и персистирующих вирусов (у пациентки выявлена персистенция вируса герпеса 6 типа). Особого внимания заслуживает значительное повышение спонтанного НСТ-теста нейтрофилов (42% при норме 5–20%), что указывает на предактивацию нейтрофилов и их постоянную готовность к респираторному взрыву. Данный феномен характерен для хронических воспалительных процессов и отражает «истощение» фагоцитарного резерва, что подтверждается сниженным ответом на стимуляцию (ФАН стимулированная 70% — нижняя граница нормы, ФЧ стимулированное 4,1 ед при норме 5–9 ед). Таким образом, сочетание эозинофильного (атопического) и нейтрофильного (инфекционного) типов воспаления создаёт особенно неблагоприятные условия для формирования фиброза — так называемый «смешанный» или «комбинированный» воспалительный фенотип. Важно отметить, что на момент обследования показатели функции внешнего дыхания существенно не нарушены, что свидетельствует о локальном характере фиброзных изменений и сохранности функциональных резервов. Однако положительная проба с бронхолитиком указывает на наличие обратимого компонента бронхиальной обструкции, что характерно для бронхиальной астмы и подтверждает необходимость базисной противовоспалительной терапии ИГКС.
Представленный случай иллюстрирует сложность дифференциальной диагностики при рецидивирующем бронхолёгочном синдроме у детей. Проведённое комплексное обследование позволило исключить первичные иммунодефициты (уровни иммуноглобулинов в пределах нормы/повышены, функциональная активность фагоцитов сохранна), паразитарные инвазии (отрицательные серологические тесты), атипичные инфекции (ПЦР отрицательна на M. pneumoniae, Ch. pneumoniae). Выявленные изменения иммунного статуса носят вторичный характер и являются следствием хронического воспалительного процесса. Установление диагноза бронхиальной астмы базировалось на совокупности критериев: рецидивирующие эпизоды БОС, атопический фенотип (высокий IgE, сенсибилизация, эозинофилия), повышенный FeNO, положительный бронходилатационный тест, эффективность ИГКС. Формирование пневмофиброза в данном случае следует рассматривать как следствие длительного течения бронхолегочного процесса с повторными эпизодами инфекционного воспаления на фоне атопии. Наличие сформировавшегося пневмофиброза у ребёнка 8 лет может определять неблагоприятный долгосрочный прогноз и требует пересмотра терапевтической стратегии противовоспалительной терапии.
Особое внимание следует уделить профилактике прогрессирования фиброзных изменений. Антифибротическая терапия у детей имеет ограниченное применение, поэтому контроль воспалительного процесса является ключевым фактором, препятствующим дальнейшему фиброгенезу. Данный клинический случай подчёркивает необходимость ранней диагностики и адекватного контроля бронхиальной астмы у детей; комплексной оценки иммунологического статуса у пациентов с рецидивирующими инфекциями для выявления вторичной иммунной дисфункции; проведения МСКТ ОГК у детей с рецидивирующим бронхолёгочным синдромом для своевременного выявления структурных изменений лёгких; мультидисциплинарного подхода с участием узких специалистов в ведении пациентов с коморбидной патологией; дальнейшего изучения патогенетических механизмов формирования пневмофиброза у детей с атопией для разработки персонализированных подходов к профилактике и лечению.
4. Заключение
Представленный клинический случай иллюстрирует сложную патогенетическую взаимосвязь между атопическим процессом, рецидивирующими респираторными инфекциями и формированием пневмофиброза у ребёнка. Ключевыми факторами, способствовавшими неблагоприятному исходу, явились: ранний дебют заболевания, выраженный атопический фенотип с высоким уровнем эозинофильного воспаления, высокая частота БОС, повторные пневмонии различной локализации, вторичная иммунная дисфункция. Сочетание эозинофильного (Th2-опосредованного) и нейтрофильного (инфекционного) типов воспаления создало особенно неблагоприятные условия для процессов патологического ремоделирования и фиброгенеза.
Данный случай подчёркивает критическую важность ранней диагностики бронхиальной астмы, достижения и поддержания полного контроля над заболеванием, своевременного назначения адекватной базисной противовоспалительной терапии для предотвращения необратимого ремоделирования дыхательных путей и формирования пневмофиброза. Комплексный подход к обследованию пациентов с рецидивирующим бронхолёгочным синдромом, включающий оценку аллергологического и иммунологического статуса, функции внешнего дыхания и визуализацию структуры лёгких, позволяет своевременно выявлять структурные изменения и корректировать терапевтическую тактику.
