In silico study of the biological activity profile, chemical modification pathways and pharmaceutical effects of iodantipyrine
In silico study of the biological activity profile, chemical modification pathways and pharmaceutical effects of iodantipyrine
Abstract
An effective method for isolating iodantipyrine has been developed. The structure and purity were confirmed by: melting point 161.2–164.6°C, characteristic IR absorption bands (C=O at 1650 cm-1, C-I at 607 cm-1) and a UV spectrum with maxima at 224 nm and 267 nm (ε = 1.83⋅103 l·mol-1·cm-1). In silico analysis identified a high probability of antiviral (Pa = 0.787) and anti-inflammatory (Pa = 0.744) activity of the parent molecule. Among the in silico synthesised analogues, the best results were achieved by derivatives with benzene ring substitution: the pyridine analogue (1e) exhibited antipyretic activity (Pa = 0.860), and the thiophene analogue (1f) showed even higher antipyretic activity (Pa = 0.879) with no predicted serious side effects.
1. Введение
Йодантипирин (4-йод-1,5-диметил-2-фенил-1,2-дигидро-3H-пиразол-3-он) — препарат, широко применяемый в России для профилактики и лечения вирусного клещевого энцефалита (см. рис. 1) .
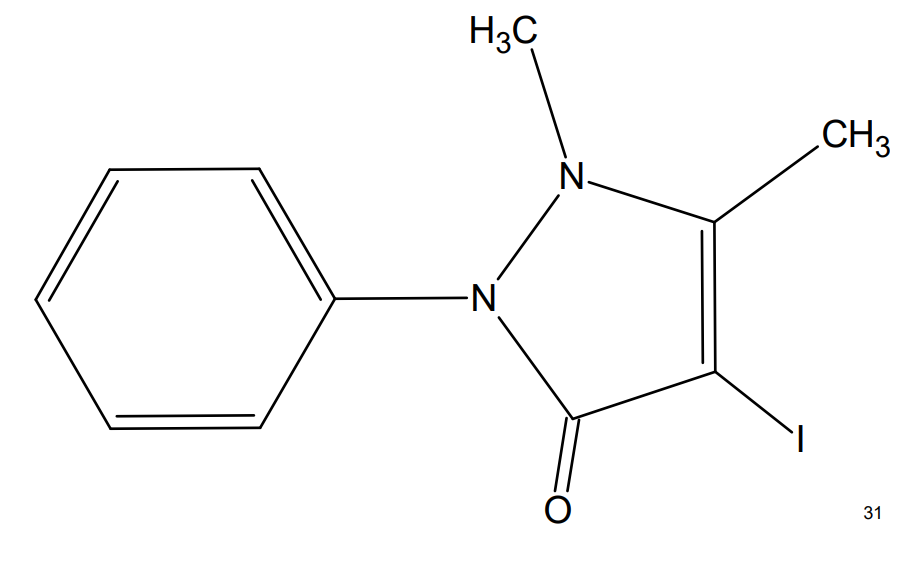
Рисунок 1 - Структура 4-йод-1,5-диметил-2-фенил-1,2-дигидро-3H-пиразол-3-она
Несмотря на высокую безопасность данного лекарственного препарата , отмечаемую многими исследователями, существуют сомнения и пробелы в области селективности действия данного препарата : конкретные молекулярные мишени для данного препарата практически не описаны в современной литературе. Разработка методики выделения действующего вещества йодантипирина из лекарственной матрицы необходима для проведения дальнейших исследований препарата: способов идентификации и распознавания фальсифицированных лекарств , высокие требования к чистоте также важны при проведении in vitro тестов на клеточных культурах и при определении полумаксимальных эффективных концентраций , при применении хроматографических методов анализа (ВЭЖХ) и т.д.
Таким образом, целью данного исследования является разработка методики выделения и идентификации йодантипирина и оценка перспектив дальнейшей модификации действующего вещества, присутствующего в рассматриваемом лекарственном препарате.
2. Методы и принципы исследования
Спектры выделенного действующего вещества записывали на спектрофотометре ПЭ 5400 УФ компании «ЭКРОСХИМ» и на ИК-спектрометре Spectrum 65 (Perkin Elmer) методом нарушенного полного внутреннего отражения, температура плавления измерена с помощью прибора Stuart SMP10. Оценка вероятности биологической активности проводилась с помощью программного комплекса PASS Online .
В работе использован лекарственный препарат Йодантипирин (АО «ТАТХИМФАРМПРЕПАРАТЫ») следующего состава: йодофеназон — 100,0 мг, крахмал картофельный — 26,0 мг, декстрозы моногидрат — 29,0 мг, повидон К17 — 5,0 мг, стеариновая кислота — 1,0 мг.
3. Методика выделения действующего вещества йодантипирина из лекарственной матрицы
3 таблетки йодантипирина по 100 мг растирали в фарфоровой ступке до порошкообразного состояния. Полученный порошок переместили в химический стакан объемом 25 мл и залили 15 мл этилового спирта 96%, затем перемешивали на магнитной мешалке в течение 5 минут до образования гомогенной массы, которую отфильтровывали. Фильтрат медленно упаривали на плитке при температуре 50-60 оС, не допуская перегрева. Сухой остаток промыли этилацетатом от остаточных количеств поливинилпирролидона и стеариновой кислоты, после чего декантировали. Выделенное действующее вещество поставили сушиться в шкаф при температуре 50 оС на 1 час. Выход составил 68% (масса сухого остатка — 204 мг).
4. Основная часть
C целью идентификации и подтверждения выделения 4-йод-1,5-диметил-2-фенил-1,2-дигидро-3H-пиразол-3-она измерен диапазон температур плавления, который составил 161,2-164,6 оС (Т=3,4 оС), что соответствует данным из ГФ РФ .
Измерен электронный спектр (см. рис. 2) выделенного действующего вещества (растворитель – дистиллированная вода): обнаружены 2 типа π→π* переходов бензольного (λmax1=224 нм) и пиразолонового кольца (λmax2=267 нм). Молярный коэффициент экстинкции соединения составил ε = 1,83⋅103 л·моль-1·см-1.
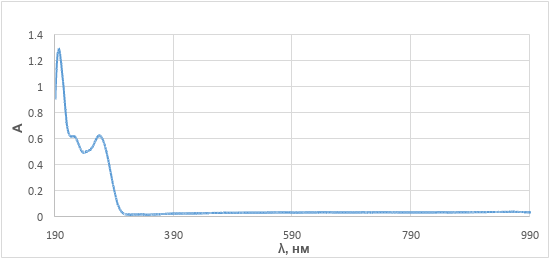
Рисунок 2 - Электронный спектр йодантипирина
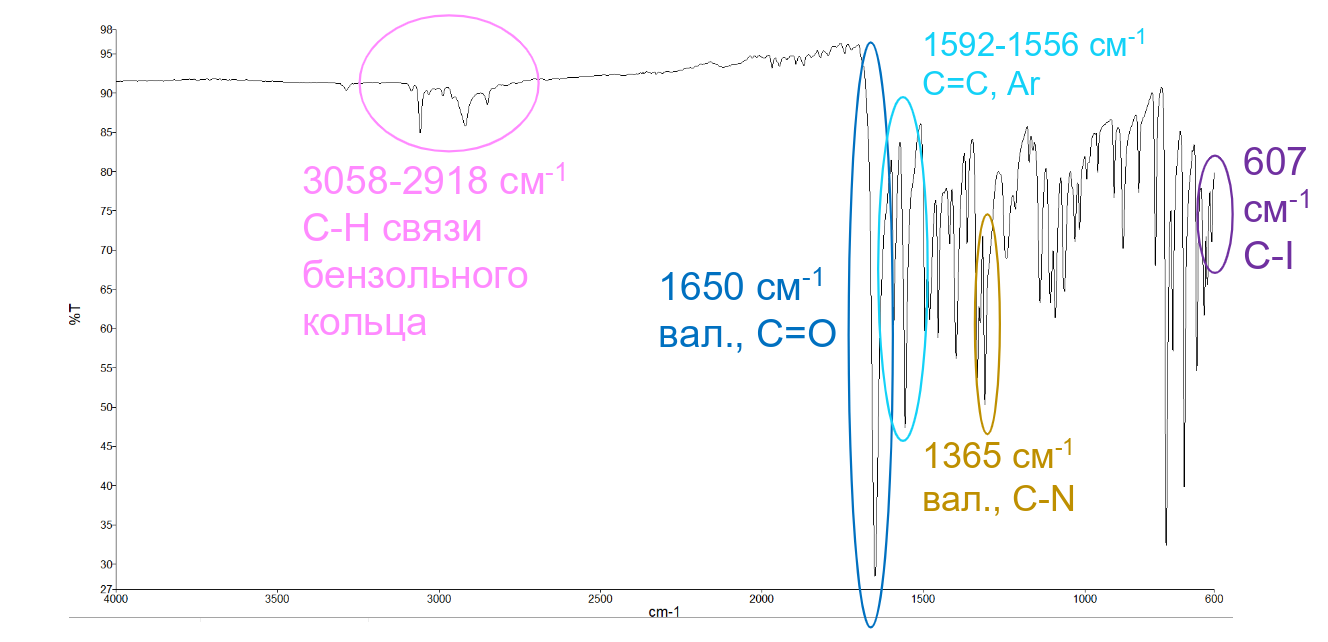
Рисунок 3 - ИК-спектр выделенного действующего вещества йодантипирина
Таблица 1 - Полосы поглощения, присутствующие на ИК-спектре йодантипирина
Волновое число, см-1 | Интенсивность, %T | Группировки атомов |
3058,01 | 84,97 | C-H, валентное |
2918,40 | 85,82 | CH3, симметричное валентное |
1650,12 | 28,50 | C=O валентное |
1592,20 | 60,50 | С=C, C=N; валентное |
1556,94 | 47,38 | C=N, валентное |
1494,66 | 58,37 | C=C, валентное |
1481,36 | 61,17 | C=C, валентное |
1454,89 | 58,82 | -CH3, асимметричное, деформационное |
1419,11 | 70,80 | деформационное, –CH3 |
1365,17 | 70,86 | С-N, валентное |
1242,61 | 68,99 | С-O, валентное |
1215,21 | 75,25 | С-N, валентное |
1106,82 | 63,28 | N-N, валентное |
1063,41 | 64,73 | -CH3, качательное |
1030,88 | 71,09 | -CH3, качательное |
909,85 | 76,68 | Ароматическое C-H, внеплоскостное |
727,61 | 57,14 | Ароматическое C-C-C, внеплоскостное |
607,22 | 71,11 | C-I, валентное |
В программном комплексе PASS Online изучена вероятность биологической активности и нежелательных побочных эффектов для йодантипирина (см. табл. 2). Исходное лекарственное вещество (см. рис. 1) имеет высокую противовирусную (0,787), противовоспалительную (0,744) активность и может применяться в качестве обезболивающего (0,724). С Ра>0,7 присутствует лишь 2 типа побочных эффектов: синдром Свита и подергивание, что подтверждает опытные данные о безопасности данного препарата.
Таблица 2 - Вероятность биологического воздействия йодантипирина
Pa | Pi | Активность |
0,787 | 0,003 | Противовирусный (пикорнавирус) |
0,744 | 0,011 | Противовоспалительное средство |
0,724 | 0,008 | Обезболивающее |
0,863 | 0,009 | Нейтрофильный дерматоз (синдром Свита) |
0,720 | 0,088 | Подергивание |
Был проведен ряд биоизостерических замен для препарата. Последовательная замена функциональных групп в сравнении с исходным препаратом отражена на рис. 4.
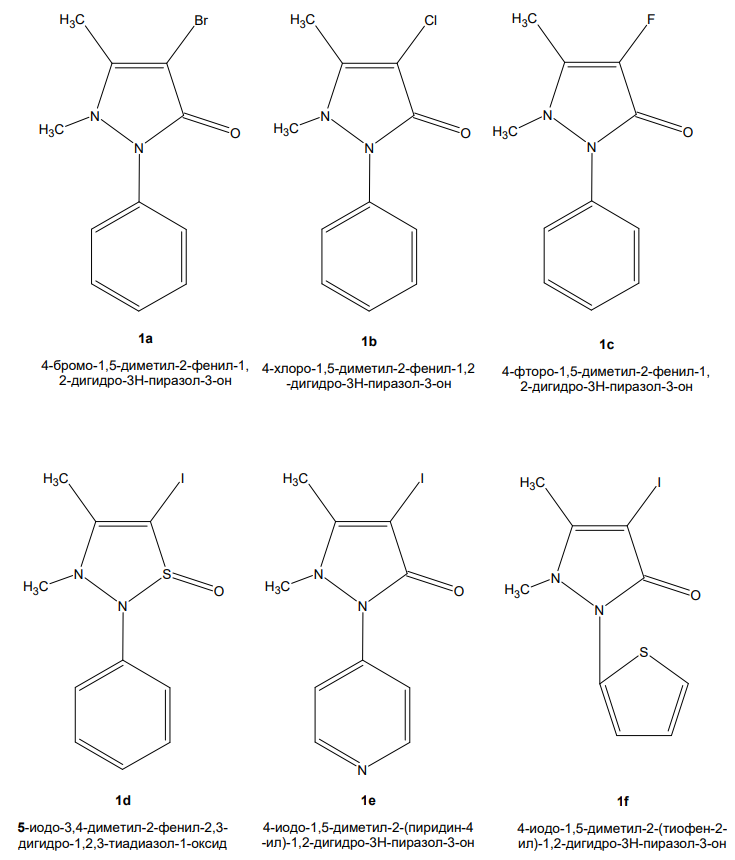
Рисунок 4 - Структуры — производные йодантипирина, полученные путем биоизостерических замен
Таблица 3 - Вероятность биологического воздействия соединения 1а
Pa | Pi | Активность |
0,790 | 0,005 | Обезболивающее |
0,781 | 0,004 | Антигипоксическое |
0,771 | 0,005 | Неопиоидный анальгетик |
0,706 | 0,015 | Противовоспалительное средство |
0,863 | 0,009 | Нейтрофильный дерматоз (синдром Свита) |
Замена галогена на хлор в 4-м положении (структура 1b; см. табл. 4) понизила противовирусное воздействие на 10,54%, увеличила токсичность (4 побочных эффекта вместо 2), в том числе серьезные (полиорганная недостаточность и др.); возросла вероятность возникновения 2-х исходных (синдром Свита и подергивание).
Таблица 4 - Вероятность биологического воздействия соединения 1b
Pa | Pi | Активность |
0,704 | 0,005 | Противовирусный (пикорнавирус) |
0,702 | 0,008 | Антигипоксическое |
0,907 | 0,004 | Нейтрофильный дерматоз (синдром Свита) |
0,790 | 0,047 | Подергивание |
0,742 | 0,021 | Полиорганная недостаточность |
0,733 | 0,017 | Желудочно-кишечное кровотечение |
Замена на фтор (структура 1c; см. табл. 5) сопровождалась ростом на 11,83% противовоспалительного воздействия, на 14,75% — обезболивающего; появились как антигипоксический эффект (0,747), так и возможность лечения ревматоидного артрита (0,721).
Таблица 5 - Вероятность биологического воздействия соединения 1с
Pa | Pi | Активность |
0,832 | 0,005 | Противовоспалительное средство |
0,831 | 0,005 | Обезболивающее |
0,815 | 0,005 | Анальгетик, неопиоидный |
0,747 | 0,005 | Антигипоксическое |
0,721 | 0,004 | Лечение ревматоидного артрита |
0,897 | 0,005 | Нейтрофильный дерматоз (синдром Свита) |
0,803 | 0,006 | Ингибитор тромбоцитопоэза |
0,783 | 0,009 | Желудочно-кишечное кровотечение |
0,743 | 0,028 | Фибрилляция предсердий |
0,756 | 0,067 | Подергивание |
Таким образом, в ряду галогенов токсичность (оцениваемая по вероятности проявления синдрома Свита, что также соотносилось с количеством, ущербом для здоровья и вероятностью проявления остальных побочных эффектов) возрастала в ряду: -I ≈ -Br < -F < -Cl.
Замена карбонильной группы пиразолонового кольца на биоизостерическую сульфоксидную (структура 1d, см. табл. 6) группу привела к исчезновению всех видов фармацевтического воздействия при Ра>0,7, в то время как побочные эффекты оставались (вероятность возникновения существенно не изменилась; см. табл. 5).
Таблица 6 - Вероятность биологического воздействия соединения 1d
Pa | Pi | Активность |
0,859 | 0,010 | Нейтрофильный дерматоз (синдром Свита) |
0,712 | 0,028 | Полиорганная недостаточность |
0,740 | 0,076 | Подергивание |
Наиболее перспективными оказались замены фенильного радикала на пиридиновое кольцо (1е) и тиофен (1f) — см. табл. 7 и 8 соответственно. В первом случае вероятность возникновения синдрома Свита в сравнении с исходной молекулой уменьшилась, но крайне незначительно (на 0,46%). Появилось жаропонижающее действие (0,860), но противовирусное понизилось на 8,25%.
Таблица 7 - Вероятность биологического воздействия соединения 1е
Pa | Pi | Активность |
0,860 | 0,003 | Жаропонижающее |
0,722 | 0,005 | Противовирусный (пикорнавирус) |
0,736 | 0,023 | Изменение цвета ногтей |
0,748 | 0,037 | Нейтрофильный дерматоз (синдром Свита) |
Во втором — побочных эффектов при Ра>0,7 вообще не наблюдается, при этом жаропонижающее действие еще выше, чем у предыдущего соединения (0,879 против 0,860), что делает указанные молекулы перспективными для синтеза в качестве потенциальных препаратов-антипиретиков.
Таблица 8 - Вероятность биологического воздействия соединения 1f
Pa | Pi | Активность |
0,879 | 0,003 | Жаропонижающее |
0,740 | 0,054 | Убихинол-ингибитор цитохром-с-редуктазы |
Более того, полученные в ходе анализа закономерности «структура-свойство» данные можно интерпретировать следующим образом: предполагаемым фармакофором в йодантипирине является пиразолоновое кольцо, которое оказывает противовирусное и противовоспалительное действие. Данный тезис также подтверждает то, что при любой попытке замены карбонильной группы, являющейся неотъемлемой части пиразолонового кольца, терапевтического эффекта при Ра>0,7 не наблюдалось.
5. Заключение
Разработана и апробирована методика выделения йодантипирина из лекарственной формы, подтвержденная данными, полученными с помощью физико-химических методов анализа. Ключевыми доказательствами чистоты и идентичности вещества являются: УФ-спектр с λmax1=224 нм, λmax2=267 нм, а также ИК-спектр, показавший наличие всех характерных группировок, включая карбонильную (1650 см-1) и связь C-I (607 см-1). Производное 1f (замена фенила на тиофен) продемонстрировало наивысшую жаропонижающую активность (Pa = 0,879) и полное отсутствие прогнозируемых побочных эффектов с вероятностью Pa > 0,7, что делает его самым перспективным кандидатом. Производное 1c (замена йода на фтор) показало значительное усиление противовоспалительной (Pa = 0,832, +11,83%) и обезболивающей (Pa = 0,831, +14,75%) активности по сравнению с исходной молекулой. Таким образом, работа предоставляет экспериментальную основу для целенаправленного синтеза новых производных йодантипирина с улучшенными физиологическими свойствами.
