Plasmodium knowlesi – fifth human malaria
Plasmodium knowlesi – fifth human malaria
Abstract
The article presents a literature review of a new species of malarial plasmodium capable of causing natural infection in humans, which has become widespread in Southeast Asia. P. knowlesi is a malaria parasite with long-tailed (M. fascicularis) and pig-tailed macaques (M. nemestrina) as the main natural hosts. The carriers are mosquitoes of the genus Anopheles leucosphyrus. Humans are incidental hosts in the life cycle of this parasite. It became widespread after an outbreak in Kapit district, Sarawak State, Malaysian Borneo in 2004, after which it spread to almost all states in the region. In this review paper, we discuss recent studies on P. knowlesi. The article describes the epidemiology, clinical aspects, diagnosis, therapy and prevention of this infectious disease.
1. Введение
Малярия – одно из старейших инфекционных заболеваний, вызываемых простейшими паразитами, принадлежащих к роду Plasmodium. Передается паразит к человеку через инфицированных комаров. Несмотря на значительное снижение заболеваемости по сравнению с прошлыми столетиями, заболеваемость малярией остается высокой. По оценкам Всемирной организации здравоохранения в 2022 г. в мире было зарегистрировано 249 миллионов случаев заболевания малярией, что на 16 миллионов превышает допандемический уровень, отмеченный в 2019 г. (233 миллиона случаев). В дополнение к сбоям, вызванным COVID-19, глобальные меры по борьбе с малярией сталкиваются с растущим числом угроз, таких как резистентность к лекарствам и инсектицидам, гуманитарные кризисы, нехватка ресурсов, последствия изменения климата и задержки в осуществлении программ, особенно в эпидемических по малярии странах. В докладе ВОЗ за май 2023 г. была рассмотрена взаимосвязь между изменением климата и распространением малярии. В связи с глобальным потеплением происходит изменение влажности и количества осадков на новых территориях, что может влиять на распространение комаров рода Anopheles. Доказательством могут служить события катастрофического наводнения в Пакистане в 2022 г., которое привело к пятикратному увеличению числа случаев заболевания малярией в стране, по сравнению с прошлыми годами . Помимо экологических предпосылок распространения малярии, увеличивается их видовой состав. Так, за последние несколько десятилетий получил распространение новый вид малярийного паразита человека. К известным нам и хорошо изученным P. falciparum, P. vivax, P. malariae и P. ovale присоединяется пятый вид – P. knowlesi , , , .
2. История открытия и ранние исследования
Впервые P. knowlesi была замечена Нейпиром и Кэмбеллом в мазке крови длиннохвостых макаках (M. fascicularis), импортированных из Сингапура, в Калькуттской школе топической медицины (Индия) в 1931 г. . Они ввели заражённую P. knowlesi кровь двум длиннохвостым макакам, и макаке-резус и сообщили, что у макаки-резуса развилась молниеносная инфекция (до 3,25 млн. паразитов на см3), а у длиннохвостых макак — лёгкая форма без заметных симптомов. Свои результаты и зараженных макак ученые передали Роберту Ноулзу и Дас Гупте, зная, что исследование нового вида малярии человека было их главным направлением. В дальнейшем подробное исследование P. knowlesi было описано авторами Робертом Ноулзом и Дас Гуптой. Ноулз и Дас Гупта после серии экспериментов, подтвердили, что передача зараженной крови P. knowlesi естественным хозяевам M. fascicularis приводит к легкому течению заболевания. Напротив, введение зараженной крови макакам-резусам, которые не являются естественными хозяевами P. knowlesi, привело к чрезвычайно высокой паразитемии и тяжелому течению со смертельным исходом. В дальнейшем Ноулз и Дас Гупта провели успешные исследования на трех добровольцах людей. Ученые перелили кровь зараженной макаки двум добровольцам и зараженную кровь человека P. knowlesi третьему добровольцу. Результаты показали, что новой малярией человека заразились все добровольцы. Также в своем наблюдении ученые отметили, что клиническое течение малярии, обусловленной P. knowlesi было легким с ежедневными лихорадочными приступами. В микроскопическом исследовании ученые также отметили морфологическое сходство P. knowlesi с P. malariae , . Синтоном и Маггиланом был изучен лихорадочный процесс малярии, вызванной P. knowlesi. Учеными, в серии экспериментов, был подтвержден 24-часовой эритроцитарный цикл, тогда как у P. falciparum, P. vivax и P. ovale он составляет примерно 48 часов, а у P. malariae — 72 часа . Синтон и Маггилан назвали нового паразита в честь Роберта Ноулза . Данное открытие привело к использованию нового паразита как жаропонижающего средства при лечении третичного сифилиса до открытия антибиотиков вместо P. vivax, у которого эритроцитарный цикл составлял примерно 48 часов. Но в 1950-х от данной терапии отказались, так как возбудитель стал более патогенным после 170 серийных пассажей у пациентов с нейросифилисом , .
Первое естественное заражение человека P. knowlesi произошло в 1965 г. у путешественника из США, находившегося в штате Паханг в Малайзии . Вернувшись в США, лечащий врач пациента заметил в маске паразитов похожих на P. falciparum. Перед лечением у него взяли образец крови и отправили образец в Атланту. Исследование крови показало наличие в мазке плазмодиев похожих на P. malariae, где как раз проводились испытания химиотерапии против P. malariae на добровольцах. При переливании крови пациента первому добровольцу и шести другим добровольцам наблюдалась ежедневная лихорадка, хотя при P. malariae лихорадка в среднем отмечается через 72 часа. Последующее переливание инфицированной человеческой крови трем макакам-резусам привело к смертельным инфекциям, тем самым подтвердив, что исследователь был естественным путем заражен P. knowlesi . Далее случился еще один случай, предположительно P. knowlesi, которым заразился исследователь во время поездки на полуостров Малайзия .
После двух естественных случаев заражения P. knowlesi интерес медицинской общественности к данному паразиту снизился до обнаружения крупного очага малярии у людей, вызванной P. knowlesi в районе Капит (Kapit) Малазийского Борнео (Malaysian Borne) в 2004 г. ПЦР анализы показали, что на долю P. knowlesi приходилось 58% из всех госпитализированных случаев в данном районе. Стоит отметить, что первая ПЦР-диагностика показало наличие плазмодиев в крови больных, но при этом не было идентифицировано ни одного из 4-х известных видов на тот момент. Секверинование 2-х ядерных генов ДНК и рРНК цепи показало, что у 8 пациентов с «P. malariae» были на самом деле инфицированы P. knowlesi . В связи с этим были созданы ПЦР-праймеры, которые являются чувствительными для P. knowlesi, и было организовано ретроспективное исследование, в ходе которого были исследованы 208 образцов крови у пациентов с малярией, обратившихся в больницу Капит. ПЦР-анализы показали, что на долю малярии, вызванной P. knowlesi, приходилось 112 из 208 случаев госпитализации с малярией в больнице Капит .
3. Эпидемиология
Возникшие события в районе Капит Малаийзиского Борнео привели к распространению P. knowlesi почти во все страны Юго-Восточной Азии. Новая малярийная инфекция, помимо Малайзии, регистрируется в Тайланде, на Филиппинах, Мьянме, Сингапуре, Вьетнаме, Индонезии, Брунее и Камбодже (рис. 1) .
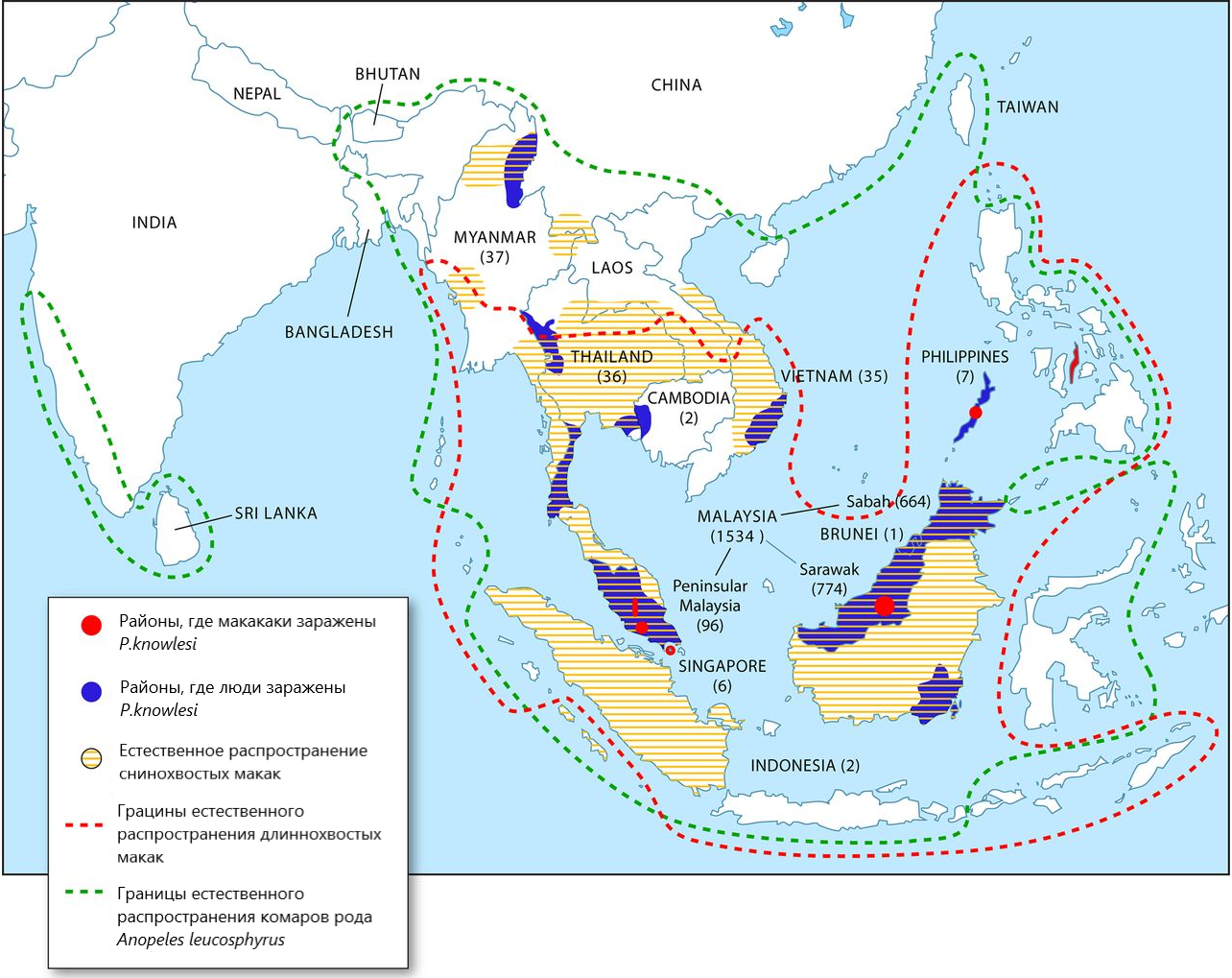
Рисунок 1 - Зарегистрированные случаи малярии P. knowlesi у людей и макак, а также границы естественного распространения комаров-переносчиков и естественных хозяев макак
Примечание: адаптировано из ист. [14]
Распространение P. knowlesi в популяции человека, скорее всего, продолжается длительное время. Основной проблемой диагностики P. knowlesi в прошлом столетии считается ограничение молекулярных методов, специфичных к антигенному составу P. knowlesi. Считается, что за 2000-2011 гг. в Сараваке (Малайзия) с помощью специфических молекулярных методов диагностики, было выявлено 881 случай P. knowlesi и 6 случаев P. malariae среди сельского населения . Проведенное исследование в Сараваке может говорить о длительном распространении P. knowlesi в популяции людей в прошлые столетия, которые были приняты за P. malariae.
Помимо трех установленных хозяев обнаруживаются новые виды макак, у которых методом ПЦР были обнаружены P. knowlesi. В качестве потенциальных хозяев были предложены северная косичкохвостая макака (M. leonina) в штате Шан Мьянмы, короткохвостая макака (M. arctoides) в провинции Прачуап-Кири-Хан (Таиланд), макаки из Себу и острова Палаван (Филиппины) , , . В районе Капит, входившем в состав Борнео, было выявлено, что 87% из 83 M. fascicularis и 50% из 26 M. nemestrina являются носителями P. knowlesi. Такой высокий процент инфицированных макак свидетельствует о значительной интенсивности распространения малярии среди диких популяций этих приматов в данной местности Малазийского Борнео .
Также по миру начали регистрироваться завозные случаи малярии, обусловленный P. knowlesi. Изучив 13 случаев завозной малярии (таб.1) 8 человек прибыли в свои страны из Малаийзии, 2 человека из Таиланда, по 1 случаи из Филиппин и Индонезии и 1 пациент находился во время путешествия в 4 странах: Индонезия, Малайзия, Таиланд, Вьетнам , , , .
Таблица 1 - Завозные случаи малярии, вызванной P. knowlesi
Страна, куда произошел завоз | Страна, откуда происходил завоз | Год, в котором был зарегистрирован случай |
США | Малайзия | 1965 |
Швеция | Борное, Малайзия | 2006 |
Финляндия | Малайзия | 2007 |
Испания | Индонезия, Малайзия, Таиланд, Вьетнам | 2009 |
Франция | Таиланд | 2010 |
Новая Зеландия | Борнео, Малайзия | 2010 |
Япония | Малайзия | 2012 |
Шотландия | Борнео, Малайзия | 2012 |
Китай | Малайзия | 2014 |
Италия | Филиппины | 2016 |
Шри-Ланка | Малайзия | 2016 |
Германия | Таиланд | 2017 |
Польша | Индонезия | 2018 |
4. Молекулярная эпидемиология
Важно подчеркнуть длительность циркуляции P. knowlesi на современном этапе. С развитием чувствительных диагностических методов и исследований в Малайзии удалось установить, что многие изолированные образцы P. knowlesi от диких макак и людей, обладают идентичными последовательностями гена циркумспорозоитного белка (csp) и митохондриальной ДНК (мтДНК) . Это свидетельствует о том, что гаплотипы и линии мтДНК не ограничены каким-либо определённым позвоночным хозяином, что говорит о возможности заражения как макак, так и человека. Совокупные молекулярные данные в сочетании с эпидемиологическими и энтомологическими исследованиями подтверждают точку зрения, согласно которой малярия, вызываемая P. knowlesi, имеет преимущественно зоонозный характер, а дикие макаки играют роль промежуточных хозяев. Анализ последовательностей мтДНК P. knowlesi позволил изучить историческое становление вида. Период существования P. knowlesi по молекулярным оценкам составляет от 98 000 до 478 000 лет назад . Аналогичные исследования мтДНК у M. fascicularis и M. nemestrina пока не проводились, что не позволяет установить, происходило ли расширение ареала P. knowlesi с человеком, макаками или переносчиками-комарами. Молекулярные данные убедительно подтверждают древнее происхождение P. knowlesi и показывают, что его проникновение в человеческие популяции не является недавним. Остаётся неизвестным, когда именно люди впервые подверглись заражению P. knowlesi. Так, в Сараваке Малазийского Борнео первое исследование малярии с использованием микроскопии было проведено в 1952 г. Из 421 случая малярии – 142 (33,7%) по результатам микроскопии были вызваны P. malariae . Однако анализ методом ПЦР ДНК плазмодиев, выделенной из архивных слайдов с диагнозом «P. malariae» в 1996 г. из Саравака, показал, что это была малярия, вызванная P. knowlesi. Недавние исследования в районе также подтверждают, что паразиты, определённые микроскопически как P. malariae, на самом деле представляли собой P. knowlesi. Можно предположить, что архивные слайды 1952 г., которые недоступны для ПЦР-диагностики, на самом деле вызваны P. knowlesi.
5. Клиническая картина
Клиническое течение малярии, вызванная P. knowlesi может варьировать от бессимптомного течения до тяжелых случаев. Инкубационный период в среднем составляет 3-14 дней, некоторые авторы отмечали более длинный инкубационный период . Проспективное исследование 130 и 437 пациентов с подтвержденным диагнозом малярия, вызванный P. knowlesi показал, что в 82,5% встречается легкое и среднетяжелое течение без осложнений и в 17,5% – тяжелое течение. Лихорадка отмечалась в 100% и в среднем длилась ежедневно 4-5 дней, средняя температура на момент обследования – 37,5 °C. Головная боль отмечалась у 90% больных, рвота – 27%, кашель – 41,5%, одышка – 16,5%, боль в животе – 27%, диарея – 13%, миалгии – 54%, артралгии – 62%. На момент осмотра гепатомегалия выявлялась в 32% случаях, а спленомегалия – 20% , . На данный момент не существует специфических признаков или клинических проявлений инфекций P. knowlesi, которые помогли бы отличить их от других видов малярии .
6. Методы диагностики
1. Микроскопия. Микроскопия позволяет выявить малярийных плазмодиев в крови. При диагностике P. knowlesi в мазке периферической крови возникают трудности в его идентификации. Дело в том, что ранние стадии развития (ранние трофозоиты) P. knowlesi демонстрируют аналогичные морфологические особенности с P. falciparum, включая наличие двойных точек хроматина и отсутствие значительного увеличения числа зараженных эритроцитов, что усложняет их микроскопическое отличие. Ленточные трофозоиты и другие стадии развития (шизонты и гаметоциты) P. knowlesi в крови проявляют сходство с аналогичными стадиями у P. malariae (рис. 2) .
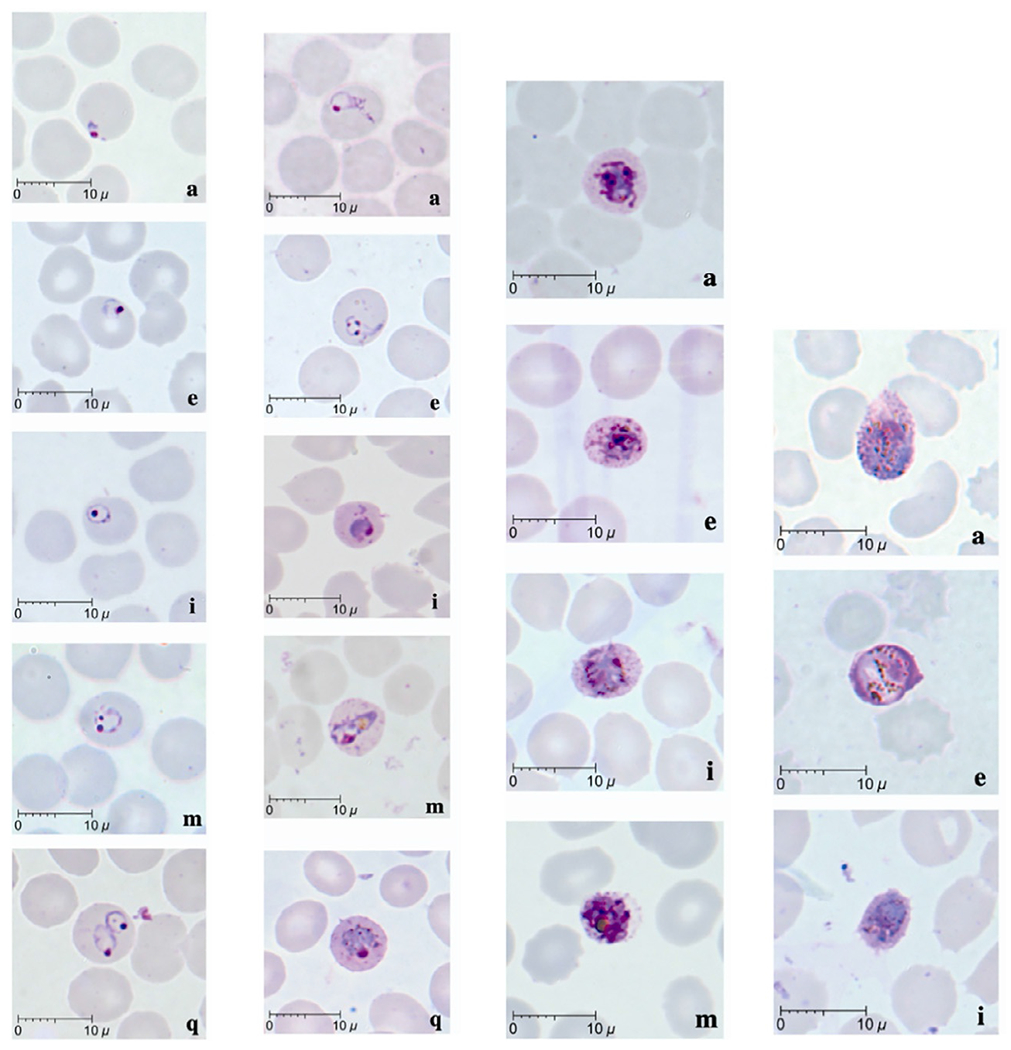
Рисунок 2 - Морфология жизненных стадий P. knowlesi:
1 - ранние трофозоиты; 2 - поздние трофозоиты (в том числе лентовидные формы); 3 - шизонты; 4 - гаметоциты (а) макрогаметоцит, (е) микрогаметоцит, (i) молодой гаметоцит
Примечание: адаптировано из ист. [28]
Данную проблему решили с созданием новых праймеров: PkF1060-PkR1550 и PkF1040-PkR1550. Эти праймеры были чувствительны для фрагмента ssrRNA-A гена рРНК P. knowlesi, экспрессируемого на бесполых стадиях . Это позволило проводить идентификацию P. knowlesi без каких-либо пересечений с другими видами.
Также в диагностике используется ПЦР в реальном времени, которые высокочувствительные и специфичные к генам SSU рРНК P. knowlesi. Данный метод позволяет быстро выявить возбудителя .
Метод петлевой изотермической амплификации (LAMP) обладает высокой чувствительность. Данный метод позволяет эффективно амплифицировать ДНК, поскольку предел обнаружения ДНК в реакционной смеси составляет всего шесть копий в течение часа при температуре 65°C. Подтверждает данный факт исследование Лау и др., где технология LAMP смогла обнаружить паразитов малярии во всех подтвержденных экземплярах инфекции P. knowlesi (всего 13 случаев, что соответствует 100% чувствительности), а также не выявила их в образцах без инфекции (100% специфичности) всего за один час. LAMP показал более высокую способность к обнаружению по сравнению с методом встроенной ПЦР, успешно выявляя даже образцы с крайне низким уровнем паразитемии (0,01%) .
7. Лечение
Согласно клиническим рекомендациям Министерства Здравоохранения Малайзии препаратами выбора являются артеметер-люмефантрин (Coartem) и артесунат-мефлохин для лечения неосложненной малярии, вызванной P. knowlesi. Применение артеметер-люмефантрина на 36 пациентах с подтвержденным диагнозом малярия, вызванная P. knowlesi показало 100% выживаемость и стойкую ремиссию . В исследовании из 8 и 34 пациентов с подтвержденной ПЦР неосложненной инфекцией, вызванной P. knowlesi, лечилась перорально артеметер-лумефантрином. Среднее время снижения паразитемии составило 1 день, что было значительно быстрее, чем у тех, кто получал хлорохин (в среднем 2,5 дня) (p = 0,01). Учитывая 24-часовой цикл репликации P. knowlesi, раннее агрессивное лечение перечисленными препаратами оправдано для пациентов с относительно высокой паразитемией, чтобы предотвратить внезапное усиление паразитемии и развитие осложнений.
При тяжелой малярии, вызванной P. knowlesi, предпочтительным методом лечения является парентеральное введение артесуната, а при переносимости перорального приема рекомендуется 3-дневный курс перорального противомалярийного препарата артеметер-люмефантрин, в соответствии с рекомендациями и доступностью препарата.
8. Профилактика
Одним из методов профилактики против распространения малярии может являться борьба с использованием естественных врагов комаров переносчиков – личинкоядных рыб, нимф, ракообразных, паразитов насекомых , .
Ландшафтное и городское планирование играет ключевую роль в снижении риска распространения малярии. Между жилыми зонами и лесами рекомендуется создавать «буферные зоны», свободные от человеческого присутствия и мест размножения малярийных комаров. При проектировании таких зон необходимо учитывать характеристики переносчиков, включая их дальность полета и скорость перемещения . Кроме того, можно внедрять физические барьеры, отделяющие лесные массивы от населенных пунктов. Одним из примеров такой преграды может служить электрическое ограждение на солнечных батареях, чтобы препятствовать проникновению обезьян в населенные пункты.
Еще одним важным направлением профилактики является создание специальных групп сотрудников и волонтеров, занимающихся информированием населения о рисках заражения малярией и способах защиты от нее. Такое просвещение может мотивировать людей к более строгому соблюдению профилактических мер. Работники лесозаготовок, туристы, фермеры и сборщики лесных ресурсов должны проходить обучение, чтобы их деятельность согласовывалась с программами борьбы с малярией. Кроме того, переселение сельского населения в городские или безлесные районы может снизить уровень заражения.
Ключевое место занимает химиопрофлактика противомалярийными препаратами. Согласно данным «Консультативно-диагностического центра с поликлиникой» при Управлении делами Президента Российской Федерации , основными препаратами противомалярийной терапии являются: «Делагил» («Хлорохин») – при риске заражения трехдневной малярией или «Мефлохин» («Лариам») – при риске заражения тропической малярией. Прием препаратов следует начинать за 1 неделю до выезда в «тропики», продолжать весь период пребывания и в течение 3 недель после возвращения. Детям препарат назначают в соответствии с возрастными дозами после консультации с врачом. В день приема препарата запрещается употреблять алкоголь, водить автомобиль, заниматься работой и силовыми видами спорта, требующими повышенной концентрации внимания. По прибытию в страну назначения целесообразно проконсультироваться с врачом посольства о необходимости химиопрофилактики малярии в конкретном месте пребывания, сроках ее проведения, а также о противомалярийных препаратах, которые можно приобрести в местной аптечной сети, схеме и дозе применения. Согласно данным Управления Роспотребнадзора по Республике Алтай рекомендуемые препараты для туристов, планирующих посетить Индонезию, Малайзию: Хлорохин (Делагил) + Прогуан, Мефлохин (Лариам). Для туристов, посещающих Таиланд, Камбоджу рекомендуемые препараты — Мефлохин (Лариам), Доксициклин (Вибрамицин), при посещении Филиппин и Индии – Хлорохин (Делагил) + Прогуанил, Вьетнама – Мефлохин (Лариам). Детям препарат назначают в соответствии с возрастными дозами после консультации с врачом.
Туристам рекомендуется принимать меры для защиты от укусов комаров. Желательно носить одежду, закрывающую большую часть тела, например, рубашки с длинными рукавами, комбинезоны, длинные брюки и обувь с закрытым верхом. Открытые участки кожи, особенно в сумеречное время на улице, следует обрабатывать репеллентами (кремами, аэрозолями, спиртовыми растворами), которые разрешены к применению. При необходимости можно обработать ими одежду. Чтобы предотвратить проникновение комаров в помещение, на окна и двери рекомендуется устанавливать защитные сетки.
Важно помнить, что в течение трех лет после возвращения из страны с неблагоприятной ситуацией по малярии, при повышении температуры тела необходимо обратиться к врачу и сообщить о том, что вы посещали регион с тропическим климатом.
9. Заключение
Малярия, вызванная P. knowlesi, является в первую очередь зоонозным паразитом, естественными хозяевами которых являются Macaca fascicularis и Macaca nemestrina. Человек является случайным хозяином в жизненном цикле P. knowlesi, но при развитии заболевания, инфекционный процесс поддается лечению противомалярийными препаратами. Основными методами, позволяющим точно определить наличие P. knowlesi в мазках крови, являются вложенная ПЦР, ПЦР в реальном времени, изотермическая амплификация (LAMP). Борьба с переносчиками должна включать методы биологической борьбы, ландшафтное и городское планирование, просвещение населения и туристов.
