MORPHOLOGY OF MYCELIAL GLOBULES OF THE BASIDIOMYCETE NEONOTHOPANUS NAMBI AND THE LEVEL OF EXTRACELLULAR OXIDASE PRODUCTION DURING DEEP CULTIVATION IN DIFFERENT NUTRIENT ENVIRONMENTS
MORPHOLOGY OF MYCELIAL GLOBULES OF THE BASIDIOMYCETE NEONOTHOPANUS NAMBI AND THE LEVEL OF EXTRACELLULAR OXIDASE PRODUCTION DURING DEEP CULTIVATION IN DIFFERENT NUTRIENT ENVIRONMENTS
Abstract
The morphology of mycelial globules of the basidiomycete Neonothopanus nambi, as well as the extracellular peroxidase and alcohol oxidase activities of the fungus during its submerged cultivation in different nutrient environments, were examined. The biomass cultivation was carried out at 27°C for 7-8 days with constant orbital agitation of the nutrient medium. Growth of fungal mycelium in the form of spherical globules with a diameter of 2-7 mm was observed under this cultivation regime. When growing in nutrient media containing malt extract or starch, the growth of large mycelial globules with numerous surface bundles of hyphae is observed. Cultivation of the fungus in medium containing mycological peptone is accompanied by the growth of numerous mycelial globules of small size with an almost smooth surface. It was found that cultivation in nutrient medium based on malt extract increases the secretion of extracellular oxidases of the fungus into the environment (from 30% to several times, compared to other studied nutrient media). Treatment of mycelium with β-glucosidase was used to extract fungal extracellular enzymes (including oxidases). The highest activity of extracellular oxidases was found in extracts from mycelium grown in nutrient medium based on malt extract: the level of peroxidase activity was higher from 30% to an order of magnitude or more, and alcohol oxidase activity was 2-5 times higher compared to extracts from mycelium grown in other nutrient media. The results of the study indicate the promising application of basidiomycete N. nambi in the biotechnology of extracellular fungal enzymes for analytical applications and creation of prerequisites for increasing their production in the biomass of the fungus at the stage of cultivation.
1. Введение
Базидиальные грибы обладают огромным биотехнологическим потенциалом для получения широчайшего спектра ценных целевых продуктов, востребованных в медицине, биологии, фармакологии, пищевой и химической промышленности, экологии и т.д. Биомассу базидиомицетов (мицелий и плодовые тела) используют для выделения волокнистых полимерных материалов (полисахариды, хитин)
, ; соединений с фармакологической активностью , , ; ферментов и ферментных систем, катализирующих разложение лигнина и целлюлозы , .Большой интерес для ученых представляют внеклеточные оксидазы базидиомицетов (в частности, гем- и ФАД-содержащие), благодаря возможностям их использования в биотехнологических и биоаналитических приложениях. В частности, эти ферменты являются перспективными биокатализаторами для конструирования эффективных средств индикации и диагностики, в том числе, создания мультиферментных индикаторных и диагностических биосенсоров. Например, глюкозооксидазу, пиранозооксидазу и пероксидазы из базидиальных грибов успешно применяют в создании различных аналитических систем
, , , , . Внеклеточная ФАД-содержащая арилалкогольоксидаза базидиомицетов перспективна в биотехнологических приложениях, благодаря широкой субстратной специфичности фермента и простоте катализируемой им реакции , .Следует заметить, что исследователи продолжают поиск для выявления среди базидиомицетов новых перспективных продуцентов известных оксидаз и обнаружения ферментов с новыми свойствами, разрабатывают подходы к созданию рекомбинантных штаммов-продуцентов внеклеточных оксидаз базидиальных грибов. В свою очередь, биотехнологическое использование базидиомицетов для производства ферментов (в том числе, оксидаз) связано с необходимостью изучения возможностей увеличения их продукции в грибной биомассе на стадии культивирования. Так, в работах ряда авторов показано, что соотношение углерода и азота в питательной среде при культивировании базидиомицетов влияет на уровень продукции грибами экзополисахаридного матрикса и внеклеточных ферментов
, . Это свидетельствует, что состав питательной среды является одним из ключевых факторов, оказывающих влияние на уровень биосинтеза внеклеточных ферментов базидиальными грибами на стадии их выращивания.Светоизлучающий базидиомицет Neonothopanus nambi является хорошо известным объектом в исследованиях не только механизмов биолюминесценции высших грибов, но и применимости в биотехнологическом производстве ценных целевых продуктов, в том числе для аналитических приложений. Например, для применения в биоаналитике интерес могут представлять внеклеточные оксидазы N. nambi
, . При этом надо сказать, что интенсивность световой эмиссии данного гриба коррелирует с активностью его оксидазных ферментов, участвующих в разрушении лигнина . Исходя из изложенного, представляет научный интерес и имеет практическое значение изучение возможностей и подходов для увеличения биосинтеза оксидазных ферментов в биомассе гриба N. nambi.
В представленной работе мы исследовали морфологию формирующихся глобул мицелия и уровень содержания внеклеточных оксидаз базидиомицета Neonothopanus nambi при глубинном культивировании гриба в питательных средах разного состава.
2. Материалы и методы исследования
В экспериментах использовали мицелий светящегося высшего гриба N. nambi IBSO 2391 из Коллекции микроорганизмов (CCIBSO 836) Института биофизики ФИЦ КНЦ СО РАН (Красноярск). При глубинном культивировании гриба были использованы жидкие питательные среды, в которых по нашим предварительным данным наблюдался достаточно быстрый (не более 7-8 суток) рост биомассы мицелия. Выращивание мицелия проводили в следующих питательных средах:
- (ME) – Питательная среда на основе солодового экстракта (декстроза – 2 г/л, солодовый экстракт – 20 г/л, микологический пептон – 1 г/л);
- (YM) – Питательная среда на основе дрожжевого и солодового экстрактов (дрожжевой экстракт – 3 г/л, солодовый экстракт – 3 г/л, декстроза – 10 г/л, микологический пептон – 5 г/л);
- (PD) – Картофельно-декстрозная питательная среда (картофельный экстракт – 4 г/л, глюкоза – 20 г/л);
- (PS) – Картофельно-сахарозная среда (бульон из свежесваренного картофеля – 200 г/л, сахароза – 20 г/л);
- (S) – Питательная среда Сабуро (декстроза – 40 г/л, микологический пептон – 10 г/л).
Готовые к использованию питательные среды и их ингредиенты были приобретены у HiMedia Laboratory (Индия). Перед использованием приготовленные жидкие среды автоклавировали при 120°С в течение 15 мин.
Мицелий N. nambi, выращенный в чашках Петри на картофельно-сахарозном бульоне в течение 8 – 10 суток, измельчали и использовали в качестве инокулята для глубинного культивирования гриба. Объем инокулята составлял 2 – 5% от объема питательной среды. Культивирование осуществляли в конических колбах объемом 300 мл, содержащих 100 мл питательной среды, при температуре 27°С и постоянном перемешивании со скоростью 160 – 180 об/мин на шейкере-инкубаторе ES-20 (BIOSAN, Латвия). Процесс выращивания останавливали на 7 – 8 сутки, поскольку ранее мы показали, что в это время гриб переходит в стационарную стадию роста
.Для выделения внеклеточных ферментов (в том числе оксидаз) базидиомицета N. nambi использовали обработку мицелия β-глюкозидазой. Такой способ позволяет без разрушения биомассы экстрагировать из мицелия внеклеточные белки в относительно мягких условиях и получать экстракты внеклеточных грибных ферментов с малым содержанием балластных примесей. Обработку мицелия проводили с использованием β-глюкозидазы из сладкого миндаля (Serva, Германия), исходный раствор фермента готовили в 10 мМ фосфатном буфере (рН 6,0). Экстракцию проводили следующим образом. Выращенные глобулы мицелия N. nambi извлекали из питательной среды и промывали деионизированной (ДИ) водой (Milli-Q system, Millipore, США) для удаления остатков питательной среды и метаболитов. Отмытые глобулы помещали в ДИ воду, содержащую β-глюкозидазу в концентрации 1 МЕ/мл, и инкубировали при 25°С в течение 24 ч при постоянном перемешивании со скоростью 80 об/мин на шейкере OS-10 (BIOSAN, Латвия). После инкубации жидкую часть (водный экстракт, содержащий выделенные из мицелия внеклеточные ферменты) отделяли от биомассы фильтрацией через бумажный фильтр. Для концентрирования выделенных ферментов и удаления низкомолекулярных соединений проводили ультрафильтрацию экстракта через мембрану Amicon с пределом исключения 30 кДа (Merk Millipore, Германия). В ходе ультрафильтрации в образце трижды заменяли ДИ воду для более полного удаления низкомолекулярных примесей. Полученную надмембранную фракцию (концентрат ферментов) использовали для исследований.
Уровень внеклеточной оксидазной активности базидиомицета N. nambi оценивали:
(1) – в нативных глобулах мицелия, полученных при культивировании гриба в разных питательных средах;
(2) – в питательных средах после удаления выращенных глобул;
(3) – в ферментных концентратах, полученных после обработки глобул β-глюкозидазой и последующей ультрафильтрации экстрактов.
Внеклеточную оксидазную активность в нативных глобулах мицелия оценивали следующим образом. Выращенные глобулы извлекали из питательной среды, промывали ДИ водой для удаления остатков питательной среды и метаболитов и использовали в исследованиях. При определении пероксидазной активности глобулы помещали в 1 мл ДИ воды, содержащей 6 мM фенола (Fluka, Германия), 0,5 мM 4-аминоантипирина (4-ААП) (Реахим, Россия) и 0,8 мM Н2О2 (ОАО «Фармацевтическая фабрика Санкт-Петербурга», Россия). Пробы инкубировали в течение 1 ч при 25°C, после чего отбирали окрашенные растворы и оценивали количество образовавшегося хромогена (хинонимин) на спектрофотометре UV-1800 (Shimadzu, Япония) при длине волны 506 нм. Для определения алкогольоксидазной активности глобулы помещали в 1 мл ДИ воды, содержащей 10 мM вератрилового спирта (Sigma, США), и инкубировали пробы при указанных выше условиях. Количество образовавшегося продукта (вератриловый альдегид) оценивали спектрофотометрически при длине волны 310 нм. При тестировании пероксидазной активности в питательных средах и ферментных концентратах реакционная смесь объемом 600 мкл содержала: 6 мМ фенола, 0,5 мМ 4-ААП, 8 мM Н2О2 и 100 мкл питательной среды или концентрата ферментов. При тестировании алкогольоксидазной активности реакционная смесь объемом 600 мкл содержала: 10 мМ вератрилового спирта и 50 мкл питательной среды или концентрата ферментов. В обоих случаях после добавления всех ингредиентов реакции пробы перемешивали в течение 3 сек на Vortex-Genie 2 g-560E (Scientific Industries, Inc., США) и инкубировали в течение 30 мин при 25°C. Выход продуктов реакций оценивали спектральным методом, как изложено выше. Активность ферментов выражали в единицах оптической плотности на 1 мл реакционной смеси при измерениях с нативными глобулами и питательными средами, или на 1 мг белка при тестировании ферментных концентратов. Концентрацию белка в концентратах ферментов определяли биуретовым методом с использованием реактива Бенедикта и БСА в качестве стандарта. Измерение оксидазных активностей проводили в пяти повторностях.
3. Результаты и их обсуждение
Применение базидиальных грибов для производства ферментов требует изучения уровня их продукции в грибной биомассе и возможностей ее увеличения на стадии культивирования. Известно, что на эффективность биосинтеза внеклеточных ферментов в мицелии базидиомицетов могут оказывать влияние состав питательной среды и условия выращивания биомассы. Ранее было показано, что состав питательной среды и условия погруженного культивирования базидиомицетов (скорость перемешивания, температура, аэрация кислородом и др.) влияют на выход биомассы мицелия, уровень продукции и состав экзополисахаридного матрикса в мицелии
, . Экзополисахаридный матрикс играет важную роль в жизнедеятельности базидиомицетов. Хорошо известно, что полисахаридная капсула покрывает наружную поверхность клеточной стенки гиф мицелия, имеет поры и состоит из разветвленных β-D-глюканов, образующих гелеобразную сеть во внешней оболочке гиф и межклеточном пространстве. В гелеобразной сети находятся внеклеточные ферменты и удерживается вода, необходимая для их функционирования , .Ранее нами было показано, что культивирование гриба N. nambi в погруженных условиях при постоянном орбитальном перемешивании питательной среды приводит к формированию шарообразных глобул мицелия диаметром от 2 до 7 мм, имеющих шероховатую поверхность за счет большого количества поверхностных выростов – пучков гиф
. При этом было показано, что длина отдельных гиф и пучков гиф, вырастающих на поверхности глобул мицелия данного гриба, может достигать нескольких миллиметров.Как показали исследования, проведенные нами в данной работе, морфологические характеристики глобул мицелия N. nambi (размер глобул, обилие и длина отдельных гиф и пучков гиф на поверхности глобул) могут значительно варьировать, в зависимости от состава питательной среды, используемой для выращивания (рис. 1). Из представленных данных видно, что образование крупных глобул с большим количеством поверхностных пучков гиф наблюдается при росте мицелия в средах, содержащих солодовый экстракт (МЕ среда) или крахмал (PS и PD среды) (рис. 1а–в). При этом при культивировании гриба в питательной среде S, содержащей микологический пептон, наблюдалось образование большого количества глобул малых размеров с практически гладкой поверхностью, среди которых встречались экземпляры не шарообразной формы (рис. 1г). Видно, что в данной биомассе встречалось и некоторое количество крупных глобул, имеющих крайне редкие и короткие пучки гиф на поверхности. И, наконец, в биомассе, выращенной в среде YM, содержащей дрожжевой экстракт, встречались как глобулы небольшого и среднего размера с гладкой поверхностью, практически не содержащей выростов, так и более крупные экземпляры с короткими толстыми пучками гиф (рис 1д). Следует сказать, что на поверхности гладких глобул, образование которых наблюдалось при культивировании базидиомицета N. nambi в средах S и YM, длина поверхностных гиф (или пучков гиф) была крайне мала и составляла менее 200 мкм.
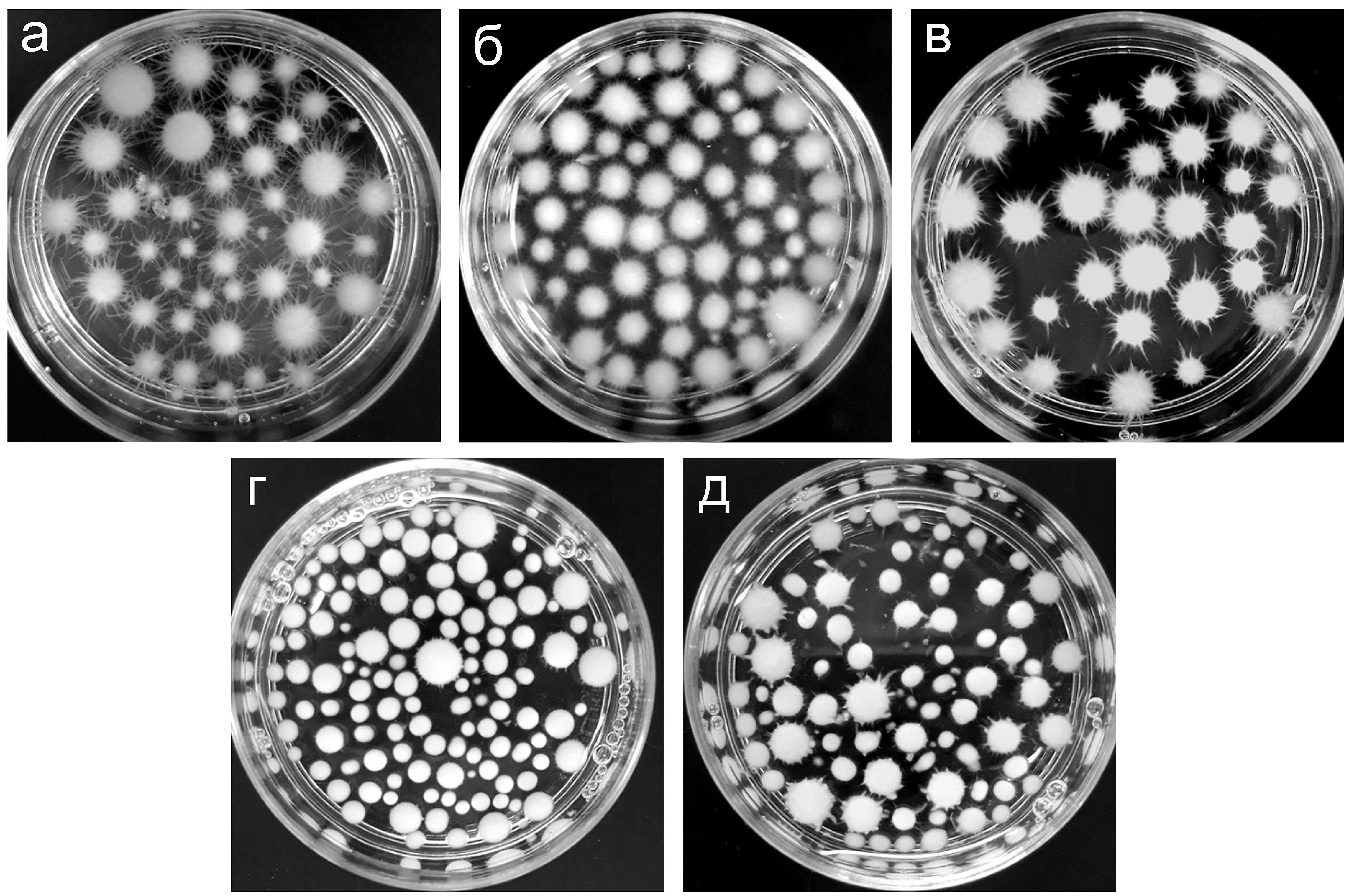
Рисунок 1 - Морфология глобул мицелия базидиомицета N. nambi при погруженном культивировании в разных питательных средах:
а – PD; б – PS; в – ME; г – S; д – YM
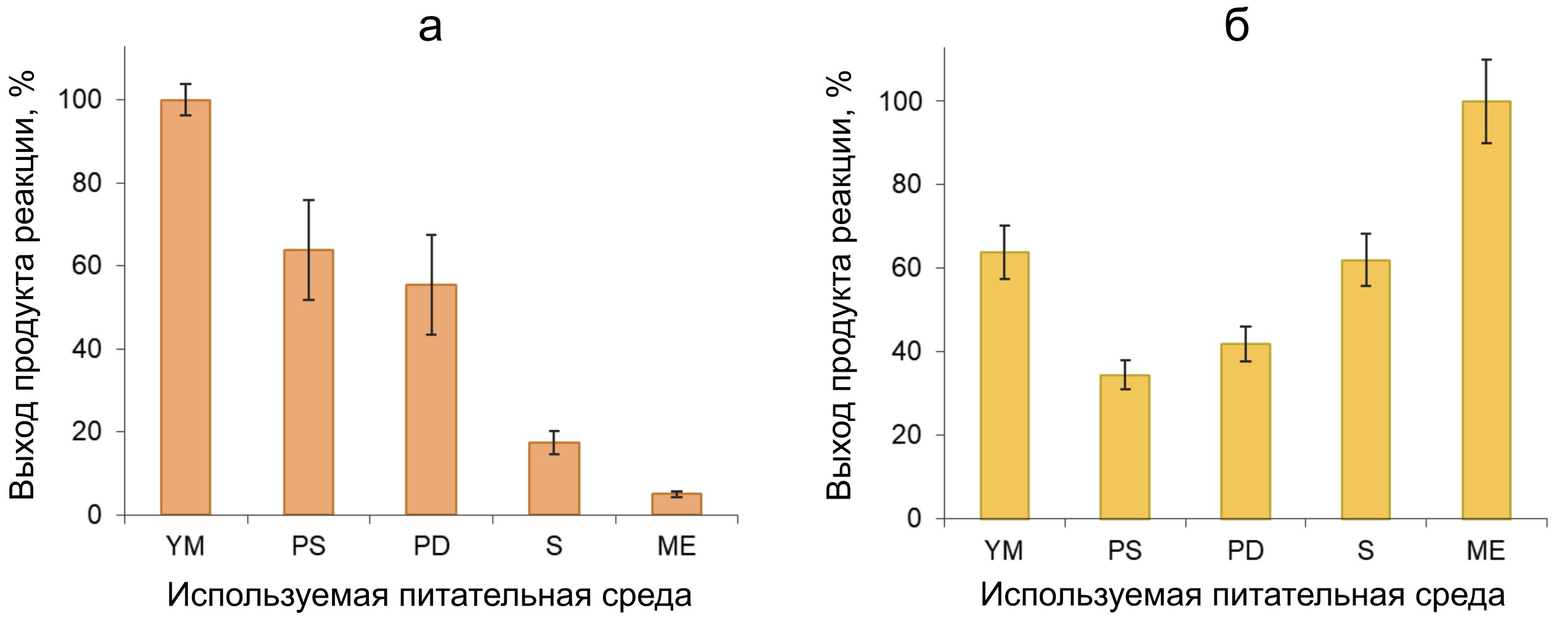
Рисунок 2 - Выход продукта реакции окислительного азосочетания, отражающий уровень пероксидазной активности в нативных глобулах мицелия N. nambi (а) и в питательных средах после культивирования гриба (б)
Примечание: данные нормированы на максимальные уровни выхода продукта в рядах измерений: 0.218 ± 0.04 отн.ед./мл и 0.046 ± 0.005 отн.ед./мл, соответственно
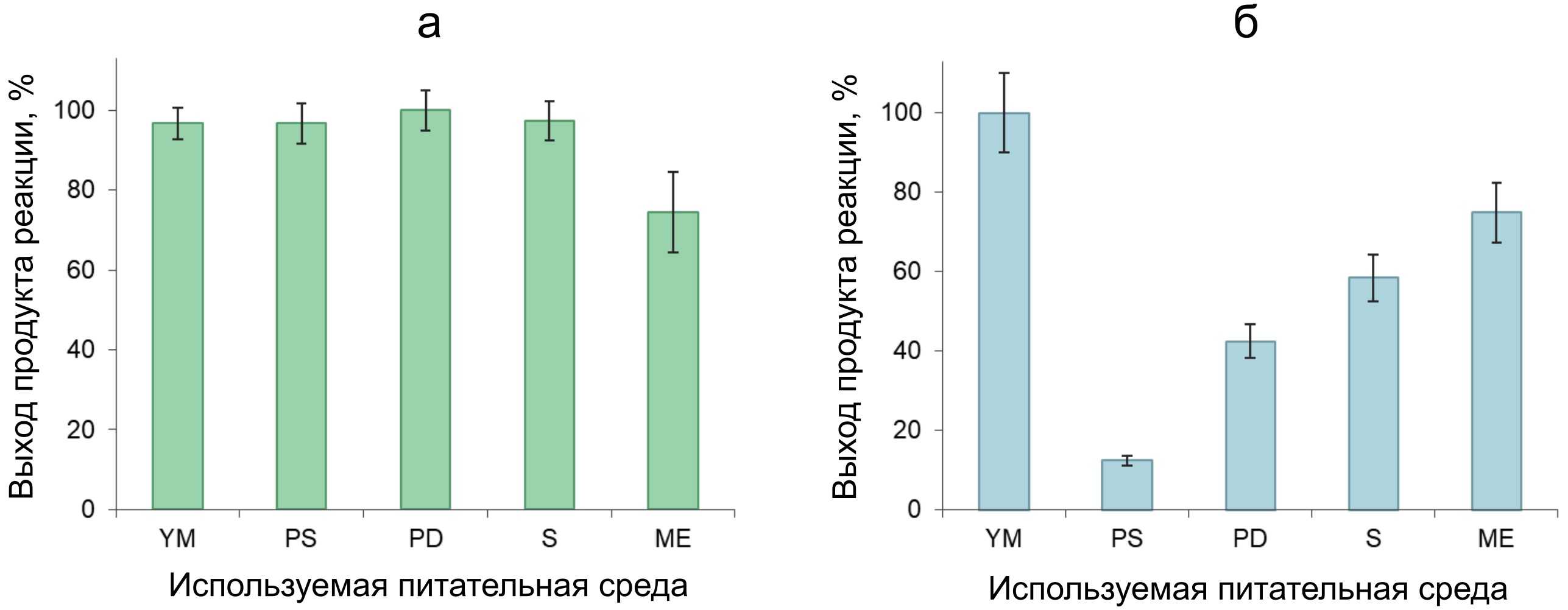
Рисунок 3 - Выход продукта реакции окисления вератрилового спирта, отражающий уровень алкогольоксидазной активности в нативных глобулах мицелия N. nambi (а) и в питательных средах после культивирования гриба (б)
Примечание: данные нормированы на максимальные уровни выхода продукта в рядах измерений: 0.3 ± 0.05 отн.ед./мл и 1.39 ± 0.13 отн.ед./мл, соответственно
Как показали эксперименты с концентратами внеклеточных ферментов, полученных после обработки мицелия N. nambi β-глюкозидазой, во всех образцах регистрируется пероксидазная и алкогольоксидазная активности (рис. 4). Видно, что уровень активности изучаемых оксидаз, извлекаемых из биомассы мицелия данным способом, существенно различается, в зависимости от состава питательной среды, которая была использована для выращивания гриба. Так, высокий уровень пероксидазной активности регистрируется в ферментных концентратах, полученных из глобул, выращенных в средах PD, S и МЕ (рис. 4а). В концентратах из глобул, выращенных в средах YM и PS, уровень пероксидазной активности был значительно ниже. При тестировании алкогольоксидазной активности самый высокий ее уровень был зарегистрирован в ферментном концентрате, полученном из глобул, выращенных на среде ME. В ферментных концентратах, полученных из глобул, выращенных в средах PS, PD и S, регистрировался практически в 2 раза меньший уровень этой активности (рис. 4б). Как и при тестировании пероксидазной активности, наиболее низкий уровень алкогольоксидазной активности был зарегистрирован в концентрате из глобул, выращенных в среде YM (рис. 4б).
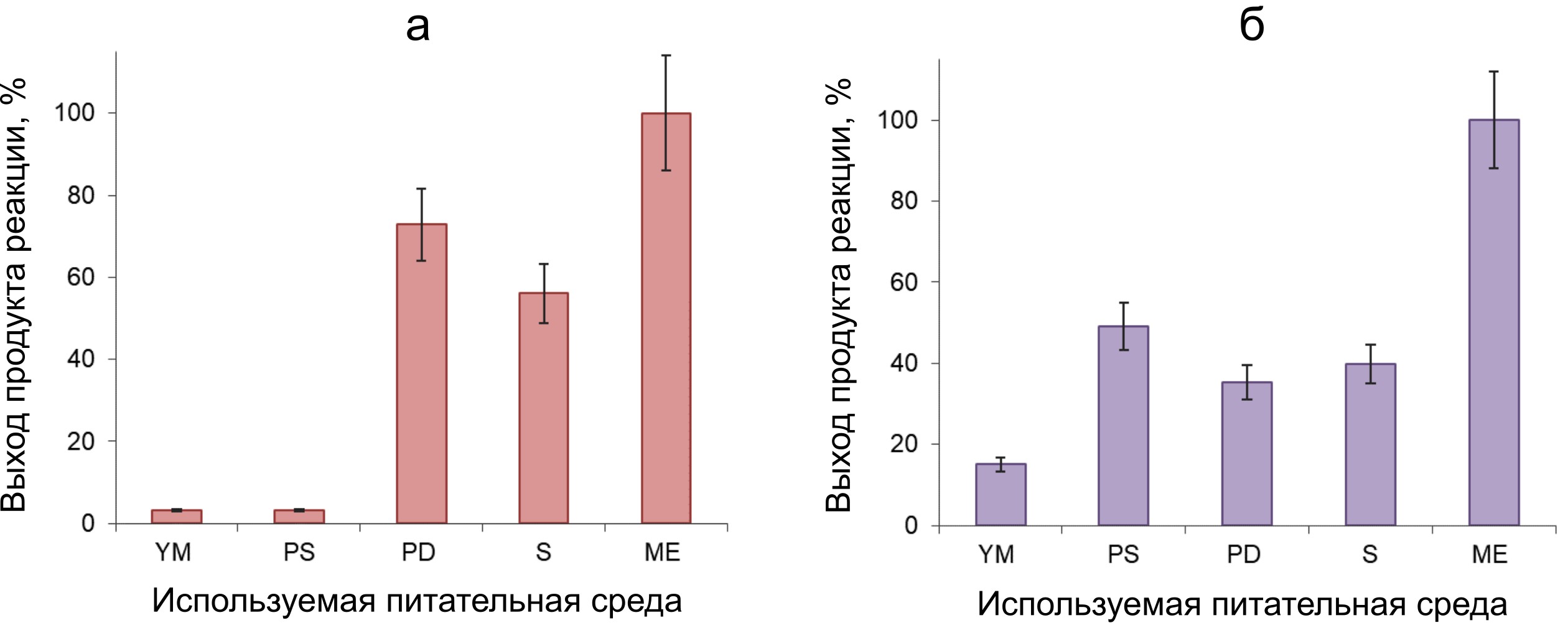
Рисунок 4 - Выход продуктов реакции окислительного азосочетания (а) и реакции окисления вератрилового спирта (б), отражающих уровни активности экстраклеточных оксидаз в водных концентратах из мицелия N. nambi
Примечание: данные нормированы на максимальные уровни выхода продуктов реакций в рядах измерений: 0.418 ± 0.06 отн.ед./мг и 1.51 ± 0.18 отн.ед./мг, соответственно
4. Заключение
Обнаружение пероксидазной и алкогольоксидазной активностей в питательных средах после выращивания мицелия N. nambi открывает перспективы создания биореакторов на основе базидиомицетов для производства внеклеточных грибных ферментов, обладающих оксидазной функцией. Для выделения пула внеклеточных ферментов из базидиомицета N. nambi может быть рекомендована обработка биомассы мицелия β-глюкозидазой. Этот прием позволяет в относительно мягких условиях (без разрушения биомассы) получать из мицелия экстракты, обогащенные внеклеточными грибными ферментами и содержащие малое количество балластных примесей. В работе было выявлено, что наибольшая секреция внеклеточных оксидаз в окружающую среду и их наибольшая активность в экстрактах после обработки биомассы мицелия β-глюкозидазой наблюдаются при выращивании гриба N. nambi в питательной среде на основе солодового экстракта. В свою очередь, наличие таких питательных сред, содержащих внеклеточные ферменты базидиальных грибов, и экстрактов, полученных после обработки биомассы β-глюкозидазой и обогащенных данными ферментами, будет способствовать повышению эффективности технологий дальнейшей очистки этих ценных целевых продуктов, востребованных в аналитике.
