Genotyping of E.coli Isolates with Identification of Virulence Genes
Genotyping of E.coli Isolates with Identification of Virulence Genes
Abstract
Escherichiosis is a widespread disease of poultry, including turkeys. The disease is caused by the gram-negative opportunistic bacterium E.coli. The pathogenicity of the microorganism is determined by the presence of a set of virulence genes. The severity of the clinical picture of the disease is also determined by the state of the host's immune system. Quarantine measures are often used as preventive measures for infectious diseases of poultry, allowing to isolate sick individuals. Scientifically justified preventive measures include genotyping of the pathogen, which makes it possible to evaluate the epizootic potential of the pathogen, identify pathways of transmission of the bacterium and find the source of infection. In the course of this work, a greater genetic diversity of E.coli isolates extracted from the maternal line of turkeys was revealed. The avian haemolysin gene (HlyF) was present in the genome of all isolates of this bacterium, while the avian fimbrial adhesin gene was absent.
1. Введение
К числу условно-патогенной микрофлоры птиц относится широко распространенная в природе бактерия E.coli . Обычно эта бактерия является частью микробиоты кишечника и не вызывает развития заболевания у птиц и млекопитающих. Однако, в определенных условиях, когда бактерия приобретает путем горизонтального переноса генетической информации участки ДНК с генами вирулентности, она становится патогенной для хозяина. Ситуацию отягощает скученное содержание птицы, неполноценное кормление, приводящие к снижению иммунитета , . При контактах птицы в условиях индустриального выращивания создаются условия для распространения инфекции. Отследить этот процесс можно с использованием методов генотипирования бактерий , . Широкому распространению генов резистентности к антибиотикам способствует использование последних в кормах . Существует большое число методов генотипирования бактерий , среди которых выделяются методы, основанные на полимеразной цепной реакции, в частности, с использованием праймеров к повторяющемуся генетическому элементу в геноме энтеробактерий ERIC и коротких праймеров к анонимным последовательностям в геноме RAPD . По данным генотипирования E.coli, выделенных из различных источников, бактерии разделяют на несколько кластеров, в зависимости от хозяина, например, птичьи патогены именуются группой APEC , . Цель работы заключалась в определении генетического разнообразия изолятов E.coli, выделенных из разных групп индеек и выявлении носительства генов вирулентности у бактерий. Эти вопросы на примере патогенов индеек, разводимых в условиях промышленных птицефабрик, раскрыты недостаточно, что и предопределило тему работы. Полученные данные могут быть использованы специалистами при планировании ветеринарно-санитарных профилактических мероприятий.
2. Методы и принципы исследования
Объектом исследования служили образцы геномной ДНК, выделенные из чистой культуры E.coli. Бактерии выращивались на бульоне в соответствии с общепринятыми в микробиологии правилами. В анализ были взяты 30 бактериальных изолятов, полученных из смывов клоаки индеек создаваемого среднего кросса (отцовская линия – образцы 1-10, материнская линия – образцы 11-20), а также 10 изолятов из разных органов (почки, легкие, сердце, печень и красный костный мозг) трех заболевших (павших) индеек. В момент взятия биоматериала не было найдено других индеек с клиническими признаками эшерихиоза. У павших особей диагноз «эшерихиоз» был установлен патологоанатомическим исследованием (характерная картина серозно-фибринозного перикардита, дуоденита, воспалительный процесс в тонком кишечнике, и затем подтвержден микробиологическим методом выращивания бактерии на дифференциально-диагностических средах (среда Эндо и XLD-агар).
Для выделения геномной ДНК клетки бульонной культуры E.coli осаждали центрифугированием при 3000g в микроцентрифуге, осадок суспендировали в буфере TES (50 мМ Трис-HCL, 20 мМ ЭДТА, 10 мМ NaCL, pH 8.0). Суспензия инкубировалась в течение 30 минут после внесения лизоцима (конечная концентрация 2 мг/мл) при 37°С. Затем клетки лизировали путем добавления в смесь додецилсульфата натрия до конечной концентрации 1%. Геномную ДНК E.coli выделяли с использованием фенольно-хлороформенного метода. Количество и качество выделяемой ДНК оценивали в спектрофотометре NanoDrop 2000™.
Генотипирование проводили с помощью метода RAPD-PCR с использованием HotStart ДНК полимеразы и двух праймеров – 1254 и OPL-12. Выявление генов резистентности HlyF (птичий гемолизин) и Yqi (птичий фимбриальный адгезин) осуществляли с помощью специфических праймеров, окружающих участок соответствующего гена. Последовательности праймеров и условия амплификации изложены в таблице 1. Устанавливали количество циклов – 42, начальная денатурация ДНК и активация полимеразы 95°С в течение 5 минут, затем на каждом цикле продолжительность денатурации была 15 секунд при этой же температуре. По завершении всех циклов амплификации, проводили инкубацию при температуре 72°С в течение трех минут.
Таблица 1 - Последовательность нуклеотидов и условия проведения ПЦР с RAPD-праймерами 1254, OPL-12 и праймерами для детекции генов вирулентности HlyF и Yqi
Праймеры | Последовательность нуклеотидов | Температура отжига, °С | Температура элонгации, °С |
1254 | CCG CAG CCA A | 37 | 72 |
OPL-12 | GGGCGGTACT | 37 | 72 |
HlyF | GGCCACAGTCGTTTAGGGTGCTTACC GGCGGTTTAGGCATTCCGATACTCAG | 62 | 72 |
Yqi | CTGGTGGCAACATCAAATTG ATGCAATGGCAGTACCCTTC | 62 | 72 |
После проведения амплификации продукты реакции анализировали с помощью электрофореза в 1.5% агарозном геле с бромидом этидия в буфере 1хTAE. Устанавливали напряжение в 120 В, разделение фрагментов ДНК проводили в течение двух часов. По окончании электрофореза гель помещали в систему гель-документации и производили фиксацию результатов. Для оценки длины амплификатов использовали либо рестрикты фага лямбда либо лесенку GeneRuler (Thermo Fisher Sci™).
3. Основные результаты
В процессе проведенной научно-исследовательской работы были выявлены генетические профили изолятов E.coli (Рис.1).
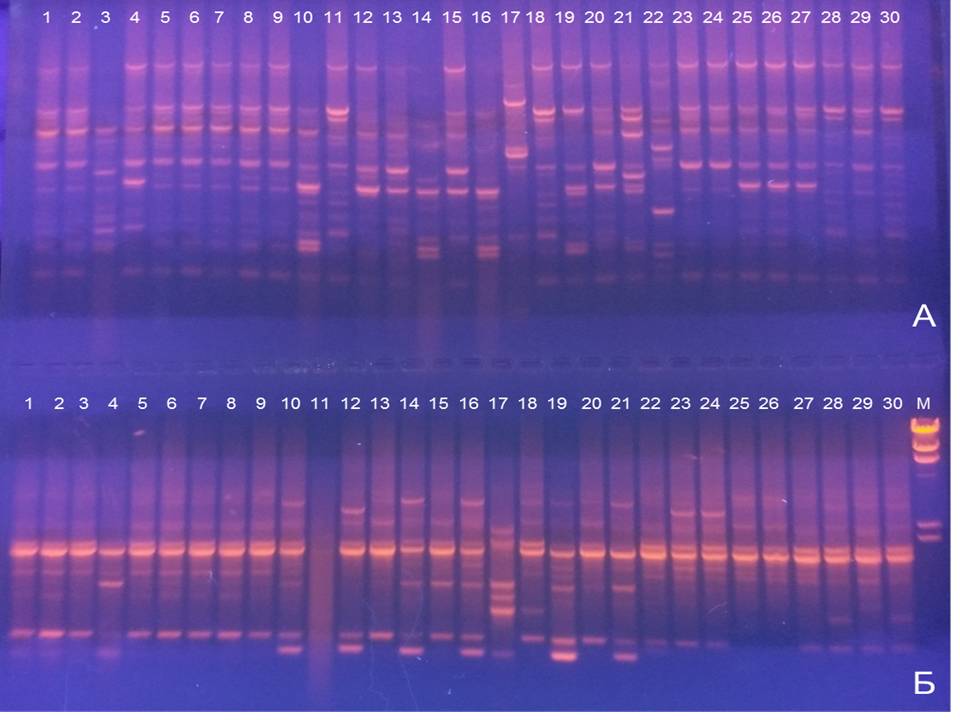
Рисунок 1 - Генетические профили 30 изолятов E.coli:
сверху (а) - праймер 1254; снизу (б) - праймер OPL-12; дорожки 1-10 отцовская линия; дорожки 11-20 материнская линия; дорожки 21-30 патологический материал из индеек
Что касается данных генотипирования изолятов, выделенных от материнской линии, то здесь просматривается большее генетическое разнообразие. Праймер 1254 был более информативным в сравнении с праймером OPL-12 в плане идентификации генетических профилей. Было выявлено восемь различающихся генотипов, что превышает количество выявленных вариантов в отцовской линии (три генотипа).
В группе изолятов, выделенных из биоматериала павших индеек обращает на себя внимание выраженная дифференциация изолятов на отдельные кластеры. Например, один кластер включал изоляты в дорожках №23 и №24, другой – №25, №26 и №27, третий – №28 и №30, выявились также и уникальные штаммы – №21, №22 и №29.
Проведение эксперимента по выявлению двух генов вирулентности HlyF (птичий гемолизин) и Yqi (птичий фимбриальный адгезин) в бактериальных изолятах, выделенных от отцовской и материнской линий, показало, что во всех образцах присутствовал ген птичьего гемолизина, а ген фимбриального адгезина отсутствовал (Рис.2.). Размер амплифицируемого фрагмента ДНК соответствовал ожиданиям (450 пар оснований) и был немного меньше, чем ярко светящийся в электрофоретической дорожке маркерный фрагмент GeneRuler в 500 пар оснований. В дальнейшем планируется проведение аналогичной работы с двумя другими генами вирулентности – Iss (фактор, повышающий выживаемость клетки в сыворотке крови), и OmpT (поверхностный белок с протеазной активностью).
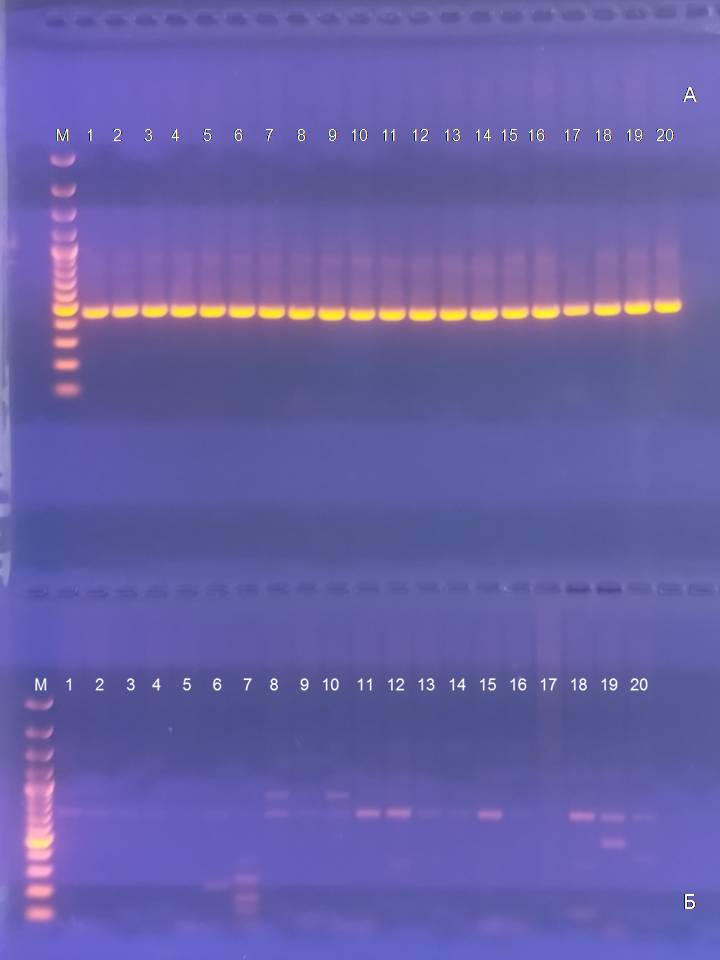
Рисунок 2 - Наличие генов вирулентности у изолятов E.coli:
дорожки 1-10 - смыв из клоаки индеек создаваемого среднего кросса, отцовская линия; дорожки 11-20 - смыв из клоаки индеек создаваемого среднего кросса, материнская линия; а – праймер для выявления гена вирулентности HlyF (птичий гемолизин); б - праймер для выявления гена вирулентности Yqi (птичий фимбриальный адгезин)
4. Заключение
Таким образом, доказано большее генетическое разнообразие изолятов в материнской группе изолятов с формированием восьми различающихся генотипов, в группе изолятов E.coli от клинически больных индеек методом RAPD-PCR удалось идентифицировать 4 генотипа. В группе изолятов от отцовской и материнской линий здоровых индеек выявлено присутствие гена вирулентности птичьего гемолизина (HlyF), в то же время четкой амплификации гена птичьего фимбриального адгезина (Yqi) не наблюдалось.
