Solid electrolytes of sodium and potassium hydroxides in porous layers grafted onto microparticles of amorphous silicon dioxide and sewn onto cellulose fabric fibers
Solid electrolytes of sodium and potassium hydroxides in porous layers grafted onto microparticles of amorphous silicon dioxide and sewn onto cellulose fabric fibers
Abstract
Solid donor electrolytes consisting of a porous layer of glycinate PVC derivatives grafted onto aerosil microparticles and cellulose fabric fibers and dissolved sodium or potassium hydroxide aqua-complexes were synthesized. The sorption characteristics of the solvents were studied in terms of water and alkali content in them was determined by the titration method. Infrared spectroscopy was used to study the effect of sorbed hydroxides on the solid electrolyte composition, the current-voltage dependence in the Pt (+) - MON solution (anolyte) - solid electrolyte bridge - MON solution (catholyte) - Pt (-) and the internal resistance of the solutions in question (where M is Na or K). The limiting stage of charge movement in the circuit is their transfer through the solid electrolyte. It was shown that the solid electrolytes obtained behave as OH-conducting membranes.
1. Введение
Пористые слои циклических ацетат-N-замещенных аминов, привитые к поверхности гидрофильного пирогенного диоксида кремния (далее аэросил) и химически пришитые к волокнам целлюлозной ткани, перспективны как двухфазные матричные растворители [1]. Примерами являются ионопроводящие твердые электролиты сульфатов натрия и калия [1], [2], [3]. Донорные атомы из ->N и -СОО-*M+ групп полимера, ->Si-O-Si<- и ->Si-OH групп аэросила и ->Si-О-С< групп на границе фаз координируются ионами Na+ и К+. Из катионов, анионов и молекул воды образуются многоядерные комплексы с координационными фрагментами [М2SO4(H2O)j]n, в которых j+2 меньше координационного числа М+. Согласно [4], при сорбции в аэросил растворов МОН группы ->Si-OH превращаются в ->Si-O-* М+. В нашем случае, наиболее вероятно, что продуктами сорбции будут электролиты МОН в твердом растворителе, в фазе аэросила которого будут ->Si-O-Si<- и ->Si-O-* М+ группы, а в порах будут многоядерные комплексы с координационными фрагментами [МОН(H2O)j]n. В настоящее время такие электролиты в литературе не описаны.
Цель исследования: Синтезировать электролиты МОН в твердом матричном растворителе с ->Si-O- группами, измерить их ионную проводимость и зависимость тока от напряжения в цепи: катод - анолит - электролит (мостик) - катлит - анод, в которой мостик находится на воздухе.
2. Экспериментальная часть и результаты
Матричные растворители были синтезированы по методике [1]. Использовались 3М водные растворы гидроокиси натрия и калия (х.ч.).
Методы исследования:
- препаративный, химический анализ;
- ИК-Фурье спектроскопия (ИК -Фурье спектрометр Perkin-Elmer 2000), отнесение полос проводили согласно [4], [5], [7], [8];
- измерение электропроводности твердых электролитов проводили по методике [1], [2], используя прямоугольные отрезки твердых электролитов: длина 10 см, ширина 10 см. Погрешность измерения не более 100 Ом;
- измерения напряжение величины Е0, при которой начинается перенос зарядов в цепи катод - раствор МОН - электролит (мостик) - раствор МОН – анод, и константы скорости переноса проводили методом вольтамперометрии согласно [1], [3], используя 3 моль/л растворы МОН и отрезки твердого электролита длиной 20 см и шириной 10 см, концы которого опущены в растворы на 4 см каждый.
Погрешность измерения тока J в цепи при заданном напряжении составила 0.05 мА.
Для синтеза твердых электрлитов образцы матричных растворителей известной массы (mo) выдерживали в растворах NaOH или КОН, удаляли окклюдированную жидкость с помощью фильтровальной бумаги и сушили при 110-115оС до постоянной массы (m1), по ходу синтеза периодически записывая их ИК-спектры. Процесс считали законченным, когда в ИК- спектрах исчезали полосы 1004 и 690 см-1 колебаний (-О)3Si -OH групп и появлялись полосы 1100, 1040-1050, 770 см-1, в которых находятся полосы колебаний (-О)3Si -O- групп. Электролиты, содержащие гидроокись натрия обозначены как I(NaOH), II(NaOH), III(NaOH), с гидроокисью калия - I(КOH), II(КOH) и III(КOH), где I, II и III - твердые электролиты с содержанием аэросила 24,3%, 45,9%, и 76,1% соответственно.
Для определения содержания МОН и j (среднего числа молекул воды, приходящихся на один катион), образец электролита массы m помещали в воду, добавляли раствор фенолфталеина, тировали 0.01 н раствором соляной кислоты, кипятили в воде и сушили при 110о до постоянной массы m1. Содержание гидроокиси (ммоль/г) рассчитывали по формуле СМОН = 0.01V/m1, где V – число мл раствора соляной кислоты, пошедшей на титрование. Содержание воды рассчитывали по формуле Сaq = (m- m1 - СМОН Mr), где Mr – молекулярная масса гидроокисей, после чего рассчитывали значения j = Сaq/ СМОН (табл. 1).
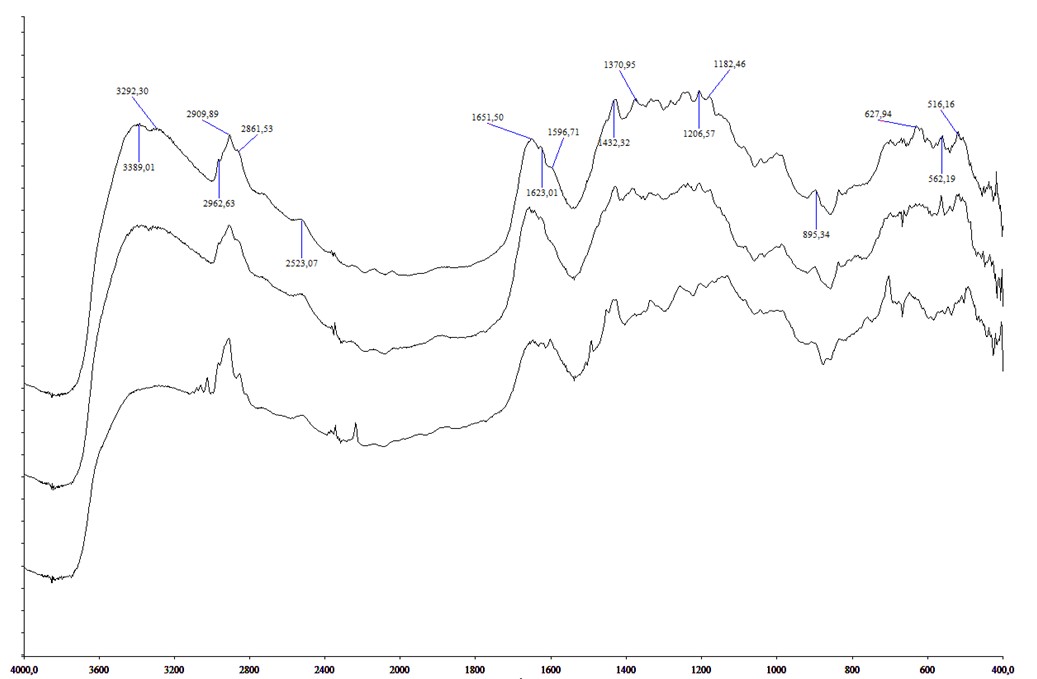
Рисунок 1 - ИК-спектры, сверху вниз III(КОН), II(КОН), I(КОН)
Таблица 1 - Содержание МОН и среднее число молекул воды, приходящихся на один катион в электролитах
Электролит | СNaOH, ммоль/г | j, ммоль/г | Электролит | СKOH, ммоль/г | j, ммоль/г |
I(NaOH) | 1,03 | 3,63 | I(КOH) | 0,98 | 2,61 |
II(NaOH) | 3,79 | 2,99 | II(КOH) | 2,94 | 2,86 |
III(NaOH) | 6,95 | 2,38 | III(КOH) | 3,76 | 2,79 |
Из таблицы видно, что значения j+2 меньше координационного числа катиона в акваионах, равного 6 для Na+ и 6-8 для К+ [9], [10], [11], [12]. В таких условиях ОН- и Н2О выступают как мостиковые лиганды, объединяя центральные атомы через донорные атомы кислорода. В электролитах остальные места в координационных сферах занимают донорные атомы из групп растворителя. Следовательно, в порах находятся многоядерные комплексы с координационными фрагментами [MOH(H2O)j]n. Значения СМОН возрастает с увеличением массовой доли аэросила. Для каждого растворителя СNaOH>СKOH. В случае NaOH значения j падает с увеличением массовой доли аэросила, а КОН – мало зависит от этих величин.
Таблица 2 - Электропроводность электролитов
Электролит | σ, 10- 5, См | Электролит | σ, 10-5 , См |
I(NaOH) | 2,22 | I(КOH) | 3,57 |
II(NaOH) | 2,54 | II(КOH) | 3,84 |
III(NaOH) | 3,33 | III(КOH) | 4,00 |
Судя по значениям σ (табл. 2) полученные твердые электролиты являются диэлектриками. Значениям σ электролитов уменьшается с увеличением доли аэросила, то есть подвижность ионов в комплексах в фазе аэросила меньше, чем в фазе полимера. Это связано с тем, что структура пор полимера не жесткая со множеством конформаций, тогда как пор аэросила – жесткая. В каждом случае подвижность ионов в электролитах КОН больше, чем в электролитах NaOH, а электропроводность возрастает при увеличении доли аэросила.
При пропускании тока через цепи: катод- анолит – мостик - католит - анод, на катоде выделяется водород, а на аноде – кислород. Это означает, что твердые электролиты с МОН ионопроводящие. Зависимости J от Е приведены на рис. 2.
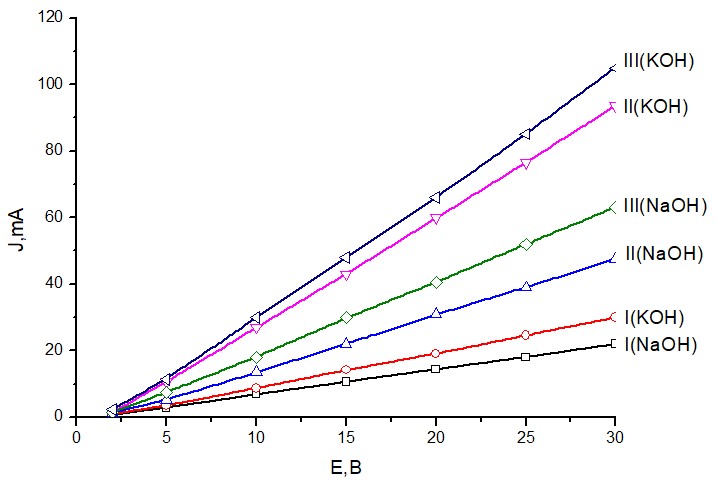
Рисунок 2 - Зависимости тока от напряжения в цепи
Таблица 3 - Напряжение начала движения ОН- и константа скорости переноса в электролитах
Электролит | Е0, В | kск 105, мг-экв/секВ | Электролит | Е0, В | kск*105, мг-экв/секВ |
I(NaOH) | 1,05 | 0,76 | I(КOH) | 1,05 | 1,57 |
II(NaOH) | 1,69 | 1,97 | II(КOH) | 1,79 | 3,29 |
III(NaOH) | 2,23 | 2,28 | III(КOH) | 1,96 | 3,66 |
Из таблицы видно, что с увеличением доли аэросила возрастают как Енач, так и kск. При этом для одного и то же растворителя kск в электролитах NaOH меньше, чем КОН.
3. Заключение
Выделение водорода на катоде и кислорода на аноде в цепи: катод- раствор МОН – электролит (мостик) - раствор МОН - анод, происходят по реакциям 2Н2О + 2е- = 2ОН- + Н2 и 4ОН- - 4е = О2 + 2Н2О. В растворе с катодом возникает избыток, в растворе с анодом – недостаток ОН-. Избыточные ОН- из раствора с катодом сорбируются в участок твердого электролита, контактирующего с раствором, а из твердого электролита в раствор с анодом происходит десорбция ОН-. На концах твердого электролита возникают отрицательный и положительный заряды, а в электролите – электрическое поле. Как было показано выше в многоядерных комплексах координированные ОН- и молекул воды образуют агрегаты с группами из фрагментов типа Н2О-М-ОН*ОН2*ОН-М. При напряжении Е0 напряженность поля достигает такой величины, при которой начинается эстафетный перенос гидроксид-ионов между ОН- и Н2О через поры. Подобные процессы характерны для ОН- проводящих мембран.
