SALICYLIC ACID INCREASES THE RESISTANCE OF LUPIN SEEDLINGS TO HYPERTHERMIA
САЛИЦИЛОВАЯ КИСЛОТА ПОВЫШАЕТ УСТОЙЧИВОСТЬ ПРОРОСТКОВ ЛЮПИНА К ГИПЕРТЕРМИИ
Научная статья
Буцанец П.А.1, *, Шугаев А.Г.2
1, 2 Институт физиологии растений им. К.А.Тимирязева РАН, Москва, Россия
* Корреспондирующий автор (p.corbeau[at]list.ru)
АннотацияВ работе изучено влияние стрессового фитогормона – салициловой кислоты (СК) на устойчивость проростков люпина узколистного (Lupinus angustifolius L.) к действию повышенной температуры. Представлены результаты опытов, которые свидетельствуют, что предобработка СК проростков люпина, которая не оказывала неблагоприятного действия на рост и развитие проростков, но активировала в их тканях и органах цианид-резистентный путь дыхания, катализируемый альтернативной оксидазой митохондрий, способствовала в дальнейшем формированию у растений устойчивости к действию повышенной температуры (42оС). Эта базовая устойчивость была выше приобретенной устойчивости, которая возникала после закаливания проростков при 35оС. Полученные результаты согласуются с литературными данными о том, что митохондрии могут быть одной из мишеней СК и других стрессовых фитогормонов при адаптации растений к действию неблагоприятных факторов внешней среды.
Ключевые слова: Lupinus angustifolius, проростки люпина, салициловая кислота, митохондрии, альтернативный путь дыхания, повышенная температура.
SALICYLIC ACID INCREASES THE RESISTANCE OF LUPIN SEEDLINGS TO HYPERTHERMIA
Research article
Butsanets P.A.1, *, Shugaev A.G.2
1, 2 K.A.Timiryazev Institute of Plant Physiology of the Russian Academy of Sciences, Moscow, Russia
* Corresponding author (p.corbeau[at]list.ru)
AbstractThe current study examines the effect of salicylic acid, a stress phytohormone on the resistance of seedlings of Lupinus angustifolius L. to high temperature. The article presents the results of experiments that indicate that the pretreatment of lupin seedlings with salicylic acid, which did not have an adverse effect on the growth and development of seedlings but activated the cyanide-resistant respiratory pathway in their tissues and organs, catalyzed by alternative mitochondrial oxidase, further contributed to the formation of resistance in plants to high temperature (42 ° C). This basic stability was higher than the acquired stability that occurred after the hardening of seedlings at 35 ° C. The results obtained are consistent with the literature data that mitochondria can be one of the targets of salicylic acid and other stress phytohormones when plants adapt to the effects of adverse environmental factors.
Keywords: Lupinus angustifolius, lupin seedlings, salicylic acid, mitochondria, alternative respiratory pathway, elevated temperature.
Введение
В многочисленных исследованиях было продемонстрировано, что обработка салициловой кислотой (СК) способствовала формированию устойчивости растений к действию различных биотических и абиотических стресс-факторов [1], [2], [3] в том числе к неблагоприятным температурам [4], [5]. Однако, несмотря на успехи, достигнутые в последнее время в изучении передачи регуляторного сигнала этого фитогормона [6], некоторые стороны механизма ее защитного действия остаются малоизученными. Это относится в первую очередь к выяснению возможного участия митохондрий в передаче регуляторного сигнала СК. Тем не менее, в литературе имеются данные о том, что индуцированная СК устойчивость табака к вирусу табачной мозаики оказалась чувствительной к салицилгидроксамовой кислоте (СГК) – известному ингибитору альтернативной CN-резистентной оксидазы митохондрий растений (АО) [7]. В последнее время, с использованием трансгенных растений арабидопсиса, было обнаружено, что митохондрии, будучи одной из мишеней регуляторного действия СК, играют важную роль в процессе формирования устойчивости растений к различным патогенам. В этом процессе могут быть задействованы генерирующие активные формы кислорода (АФК) переносчики электронов ЭТЦ (комплексы II, III), на активность которых СК оказывает, по-видимому, прямое регуляторное действие [8], [9]. Эти данные являются доказательством того, что митохондрии и образуемые в них АФК могут служить важными посредниками в передаче сигнала СК не только при индукции термогенеза у ароидных, но также при формировании защитных реакций растений на действие неблагоприятных факторов (НФ) окружающей среды. Однако количество работ, посвященных выяснения взаимосвязи между гормональной регуляцией функционирования митохондрий и формированием устойчивости растений к неблагоприятным условиям среды, включая повышенную температуру, остается кране ограниченным, а представленные в них результаты подчас достаточно противоречивы. Цель исследования заключалась в изучении влияния обработки проростков люпина СК на их устойчивость к действию повышенной температуры и активность альтернативного пути дыхания, катализируемого АО.
Методы исследованияОбъектами исследования в работе являлись проростки и семядоли люпина (Lupinus angustifolius L., сорт Дикаф-14). Семена были получены из ФГБУН Московского НИИСХ «Немчиновка». Проращивание семян и экспонирование интактных семядолей на растворах СК проводили в термостате при 25оС, без света. Для изучения влияния экзогенной СК на дыхание ткани, активность различных путей митохондриального окисления семядоли 2-дневных этиолированных проростков, выдерживали в течение 12 ч. на фильтровальной бумаге или на воде при рН 7.0 (контроль) или на растворах СК различной концентрации при рН 7.0. Проростки люпина выращивали в почве смешанной с перлитом в камерах фитотрона при температуре 25оС, при 16 часовом фотопериоде (250 мкмоль квантов м-2 с-1). Возраст растений определяли с момента прорастания семян. Схема проведения опытов по изучению влияния обработки проростков люпина 0.5 мМ СК на формирование устойчивости к действию повышенной температуры (42оС) приведена в разделе Результаты и обсуждение.
Определение активности различных путей митохондриального окисления в ткани семядолей люпина проводили с помощью ингибиторного анализа. Для определения активности цитохромного (ЦП) и альтернативного (АП) пути окисления в ткани семядолей использовались специфические ингибиторы терминальных оксидаз ЭТЦ митохондрий: 0.5 мМ цианид калия для цитохромоксидазы и 3 мМ салицилгидроксамовая кислота (СГК) для АО. Оптимальные концентрации ингибиторов были подобраны в предварительных опытах. Максимальную активность АП оценивали как часть дыхания ткани, которая подавлялась СГК в присутствии цианида [10].
Результаты и обсуждение
На рисунке 1 приведена схема проведения опытов по изучению влияния обработки проростков люпина 0.5 мМ СК на формирование устойчивости к действию повышенной температура (42оС). В предварительных опытах нами было показано, что выдерживание растений при этой температуре в течение 2 ч оказывало шоковое термическое воздействие на проростки, большая часть которых погибала в течение нескольких дней. Для сравнения, с эффектом СК, мы изучали также влияние на проростки люпина более низкой температуры (35о), которая могла обладать закаливающим эффектом.
Всего было проведено 3 опыта, на рисунках 2-4 показаны результаты одного из них. На рис. 2 видно, что шоковая температура сразу оказывала серьезное негативное действие на проростки люпина, которое морфологически проявлялось, в снижении тургора листьев у растений, обработанных СК (вариант 3) и у проростков, подвергнутых закаливающему действию температуры 35оС (вариант 2). Хуже всего себя чувствовали контрольные необработанные гормоном или умеренной температурой проростки (вариант 1), у которых наблюдалось отсутствие тургора у стеблей, что приводило к пониканию и падению большей части из них.
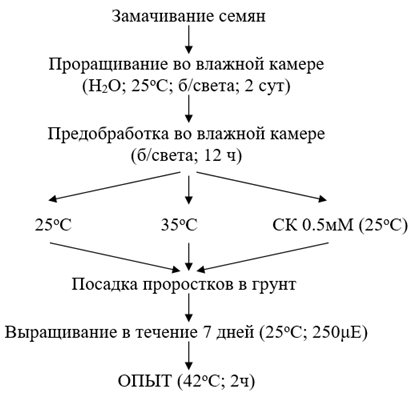
Рис. 1 – Схема проведения опытов по изучению влияния обработки СК проростков L. angustifolius на устойчивость к повышенной температуре

Рис. 2 – Внешний вид растений L.angustifolius сразу после действия температуры 42oC:
1 – Контрольные проростки без всякой предобработки; 2 – проростки предварительно выдерживали при 35оС; 3 – проростки, после обработки СК
На рис. 3 показано, что восстановление в течение 3 суток растений в нормальных условиях после действия стрессовой температуры также проходило по-разному. Наиболее полным было восстановление проростков, обработанных СК (3). У части «закаленных» проростков, хотя не у всех, также наблюдалось восстановление тургора листьев (2), и дальнейшего роста растений. Признаков восстановления не обнаруживалось у большинства контрольных растений, которые погибали в течение нескольких дней (1).

Рис. 3 – Растения L. angustifolius тех же вариантов, что на рисунке 2 после 3 суток восстановления в нормальных условиях
Наконец, на рис. 4 показано, что растения люпина, обработанные СК, после действия гипертермии, полностью восстанавливали свой внешний уже на 4 сутки, т.е. морфологически не отличались от таковых, не подвергнутых действию повышенной температуры (К).

Рис. 4 – Внешний вид растений L.angustifolius, обработанных СК после 4 суток восстановления:
1 – 25oC (К); 2 – 35oC; 3 – 42oC
При подборе действующей концентрации СК в предыдущих опытах нами было изучено также влияние ее различных концентраций (0.1; 0.5; 1.0; 5.0 мМ) на уровень альтернативного пути дыхания (АП) этиолированных семядолей L. angustifolius, который определяли по его устойчивости к цианиду (ингибитору цитохромоксидазы) и чувствительности к СГК (ингибитору АО) (рис. 5).
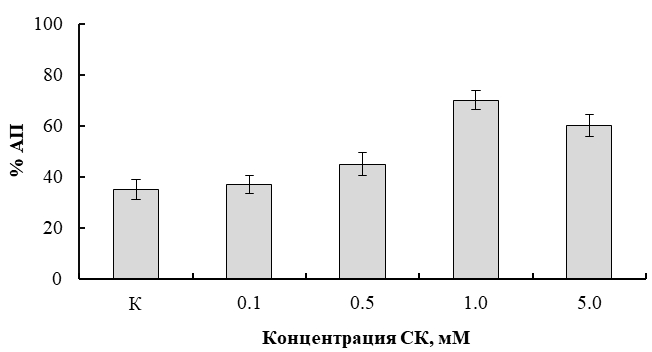
Рис. 5 – Влияние СК на уровень альтернативного пути дыхания семядолей проростков люпина
Примечание: в % от общей скорости дыхания
Полученные результаты показали, что выбранная нами в качестве действующей 0.5 мМ концентрация СК, наиболее сильно активировала общее дыхание ткани (на 40%). Это происходило преимущественно за счет увеличения максимальной скорости АП дыхания по сравнению с контролем (рис. 5). Следует также отметить, что используемые условия обработки растений СК не оказывали заметного влияния на дальнейший рост и развитие проростков люпина. Подтверждением правильности выбора концентрации фитогормона служило также то, что аналогичные данные с использованием 0.5-1.0 мМ СК получены на гипокотиле G. max. [11]. Кроме того, активация АО при действии СК показана на различных видах растений [12], [13]. Выбор достаточно высокой концентрации СК обусловлен также тем, что неоднократно было показано быстрое поглощение и интенсивная метаболизация этого фитогормона в клетках растений. В частности, в работе Chen et al. [14] было показано, что более 85% поглощенной клетками табака СК метаболизируется в течение 5 часов. Учитывая это, использование в качестве действующей 0.5 мМ концентрации СК, оказалось вполне оправданным и такая концентрация фитогормона позволила получить отчетливый эффект при действии на растения повышенной температуры.
ЗаключениеТаким образом, полученные результаты показали, что те используемые нами условия обработки проростков люпина СК, которые не оказывали неблагоприятного действия на их рост и развитие, но активировали в тканях и органах альтернативный путь дыхания, способствовали в дальнейшем формированию у растений базовой устойчивости к действию повышенной температуры. Она была выше приобретенной устойчивости, возникающей после закаливания проростков при 35оС. Вместе с тем, несомненно, что многие вопросы, касающиеся формирования устойчивости растений к экстремальным температурам под влиянием СК и других стрессовых фитогормонов, а также касающиеся возможного участия в этом процессе АО и других альтернативных путей митохондриального окисления требуют дополнительных исследований.
| Финансирование Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 121040800153-1). | Funding The work was carried out within the framework of the state assignment of the Ministry of Science and Higher Education of the Russian Federation (topic No. 121040800153-1). |
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Vlot A.C. Salicylic acid, a multifaceted hormone to combat disease / A.C. Vlot, D.A. Dempsey, D. Klessig // Annu. Rev. Phytopatol. – 2009. V. 47. P. 177 – 206. DOI: 10.1146/annurev.phyto.050908.135202
- Khan M.I.R. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants / M.I.R. Khan, M. Fatma, T.S. Per et al. // Front. Plant. Sci. – 2015. V. 6. Article 462. DOI: 10.3389/fps.2015.00462
- Prakash V. Nitric oxid and salicylic acid: a framework for their relationship in plant development under abiotic stress / V. Prakash, V.P. Singh, D.K. Tripathi et al. // Plant. Biol. – 2021. V. 23. P. 39 – 49. DOI: 10.1111/plb.13246
- Khanna P. Salicylic acid induces differential antioxidant response in spring maize under high temperature stress / P. Khanna, K. Kaur, A.K. Gupta // Ind. J. Exp. Biol. – 2016. V. 54. P. 386–393.
- Rai K.K. Salicylic acid and nitric oxid signaling in plant heat stress / K.K. Rai, N. Pandey, M. Aamir et al. // Physiol. Plantarum. – 2020. V. 168. – P. 241 – 255. DOI: 10.1111/ppl.12958
- Li N. Signaling crosstalk between salicylic acid and ethylene/jasmonate in plant defense / N. Li., X. Han, D. Feng et al. // Int. J. Mol/ Sci. – 2019. V. 20. – Article 671. DOI: 10.3390/ijms.200306671
- Chivasa S. Salicylic acid interferes with Tobacco Mosaic Virus replication via a novel salicylhydroxamic acid-sensitive mechanism / S. Chivasa, A.M. Murphy, M. Naylor et al. // Plant Cell. – 1997. V. 9. P. 547–557 DOI: 10.1105/tpc.9.4.547
- Nie S. Mitochondria-derived reactive oxygen species play a vital role in the salicylic acid signaling pathway in Arabidopsis thaliana / S. Nie, H. Yue, J. Zhou et al. // PLos One. – 2015. DOI: 10.1371/journal.pone.0119853
- Belt K. Salicylic acid-dependent plant stress signaling via mitochondrial succinate dehydrogenase / K. Belt, S. Huang, L.F. Thatcher et al. // Plant Physiol. – 2017. V. 173. P. 2029 – 2040. DOI: 10.1104/pp.16.00060
- Moller I.M. Measurement of the activity and capacity of the alternative pathway in intact plant tissues. Identification of problems and possible solutions / I.M. Moller, A. Berzi, L.H.W. van der Plas et al. // Physiol. Plant. – 1988. V. 72. 642-649 DOI: 10.1111/j.1399-3054.1988.tb09176.x
- Matos A.R. Study of the effects of salicylic acid on soybean mitochondrial lipids and respiratory properties using the alternative oxidase as a stress-reporter protein / A.R. Matos, A.T. Mendes, P. Scotti-Campos et al. // Physiol. Plantarum. – 2009. V. 137. P. 485 – 497 DOI: 10.1111/j.1399-3054.2009.01250.x
- Clifton R. Alternative oxidases in Arabidopsis: a comparative analysis of differential expression in the gene family provides new insights into function of non-phosphorylating bypasses / R. Clifton, A.H. Millar, J. Whelan // Biochim. Biophys. Acta. – 2006. V. 1757. P. 730 –741. DOI: 10.1016/j.bbabio.2006.03.009
- Poor P. Effects of salicylic acid on the metabolism of mitochondrial reactive oxygen species in plants / P. Poor // Biomolecules. – 2020. V. 10. P. 341 – 361. DOI: 10.3390/biom10020341
- Chen L. ANT1, aromatic and neutral amino acid transporter in Arabidopsis / L. Chen, A. Ortiz-Lopez, A. Jung et al. // Plant Physiol. – 2001. V. 125. P. 1813 – 1820. DOI: 10.1104/pp.125.4.1813
