SYNTHESIS OF NEW SCHIFF BASIS AND BISAMINOPHENOL FROM LEVOPYMARIC ACID
В.Н. Конев1, Т.Б. Хлебникова2, З.П. Пай3
1ORCID: 0000-0002-5962-9538, 2ORCID: 0000-0002-3366-9128, кандидат химических наук, 3ORCID: 0000-0002-4622-5323, доктор технических наук, Институт катализа им. Г.К. Борескова СО РАН
Работа выполнена при поддержке Российской Академии наук и Федерального Агентства Научных организаций (проект V.44.5.8 № 0303-2016-0008)
СИНТЕЗ НОВЫХ ОСНОВАНИЯ ШИФФА И БИСАМИНОФЕНОЛА ИЗ ЛЕВОПИМАРОВОЙ КИСЛОТЫ
Аннотация
Доступный оптически чистый дитерпен – левопимаровая кислота - был использован в качестве хирального природного сырья для получения энантиомерно чистых диамина и основания Шиффа. Синтез основан на превращении монометилового эфира фумаропимаровой кислоты в оптически чистый транс-1,2-диамин через перегруппировку Курциуса c сохранением конфигурации хиральных центров. Взаимодействием хирального диамина с салициловым альдегидом был получен бисальдимин, восстановление которого привело к получению транс-1,2-бисаминофенола.
Ключевые слова: живица, дитерпены, хиральные соединения, Pinus silvestris.
V.N. Konev1, T.B. Khlebnikova2, Z.P. Pai3
1ORCID: 0000-0002-5962-9538, 2ORCID: 0000-0002-3366-9128, PhD in Chemistry, 3ORCID: 0000-0002-4622-5323, PhD in Engineering, Boreskov Institute of Catalysis SB RAS
The work was supported by the Russian Academy of Sciences and the Federal Agency of Scientific Organizations (project V.44.5.8 No. 0303-2016-0008)
SYNTHESIS OF NEW SCHIFF BASIS AND BISAMINOPHENOL FROM LEVOPYMARIC ACID
Abstract
The available optically pure diterpenes, levopimaric acid, is used as a chiral natural raw material for the preparation of enantiomerically pure diamine and Schiff basis. The synthesis is based on the conversion of the fumaropimaric acid monomethyl ester to optically pure trans-1,2-diamine through the Curtius rearrangement, while maintaining the configuration of the chiral centers. By the interaction of chiral diamine with salicylic aldehyde, bisaldimine is obtained, the reduction of which led to the production of trans-1,2-bisaminophenol.
Keywords: oleoresin, diterpenes, chiral compounds, Pinus silvestris.
Природные оптически чистые соединения являются удобным возобновляемым сырьем для синтеза сложных соединений с потенциалом использования в фармацевтической промышленности в качестве полупродуктов или реагентов для разделения или анализа энантиомеров. Многие природные соединения, содержащие в молекулах асимметрические центры, являются доступными и обладают разнообразным набором легко трансформируемых функциональных групп. Природные аминокислоты, углеводы, терпены, алкалоиды и др. широко используются в синтезе медицинских препараторов, пищевых добавок, катализаторов асимметрических реакций [1, С. 935], [2, С. 1], [3, С. 2007]. Применение дитерпенов в качестве строительных блоков для синтеза хиральных веществ и материалов исследовано в гораздо меньшей степени, что можно объяснить недостаточным разнообразием легковоспроизводимых методов стереоселективной гетерофункционализации этого класса природных соединений. В литературе встречаются немногочисленные примеры использования дитерпенов в качестве медицинских препаратов или бифункциональных органических катализаторов [4, С. 2114], [5, С. 2406].
В то же время, дитерпеновые смоляные кислоты представляют собой оптически чистые реакционноспособные соединения, которые могут служить удобным и доступным хиральным материалом для синтеза широкого спектра оптически активных веществ, поскольку являются основными компонентами живиц и канифолей – крупнотоннажных продуктов переработки деревьев хвойных пород. Ранее нами были разработаны методы получения оптически чистых азот- и фосфорсодержащих производных дитерпеновых смоляных кислот, а также была показана возможность синтеза металлокомплексов с полученными моно- и бидентатными N-, P-лигандами и их использования в каталитических асимметрических превращениях [6, С. 40].
В данной статье представлены результаты дальнейших исследований в разработке методологии функционализации природных дитерпеновых смоляных кислот. Целью нашей работы была разработка синтеза хиральных оптически чистых 1,2-бисаминофенола и основания Шиффа из левопимаровой кислоты.
Экспериментальная часть
1H NMR и 13C NMR спектры были записаны на Bruker AV-300 и АМ-400 спектрометрах. Химические сдвиги для 1H NMR были записаны в м.д. (δ) относительно тетраметилсилана (0 м.д.), сигналы растворителей использовались в качестве внутреннего стандарта (CDCl3, d 7.25 м.д.). Химические сдвиги для ЯМР 13C были записаны в м.д., с использованием сигнала дейтерохлороформа (76.90 м.д.) в качестве внутреннего стандарта. Углы оптического вращения записаны на поляриметре polAAr 3005 с использованием 100 мм кюветы (концентрация приведена в г/100 мл). Масс-спектры высокого разрешения записаны на DFS-спектрометре. Для записи ИК-спектров использовался прибор Инфралюм FT-801 или Shimadzu IRAffinity-1 FT-IR спектрометр. Тонкослойная хроматография проводилась с использованием пластин Сорбфил ПТСХ-АФ-А (силикагель на алюминиевых пластинах). Для проявления пятен пластины обрабатывали 10% раствором фосфорномолибденовой кислоты в этаноле с последующим нагреванием. Для колоночной хроматографии использовали силикагель (Panreac 60-230 мкм). Все коммерчески доступные соединения использовали без дополнительной очистки. Растворители сушили стандартными лабораторными способами.
13-Isopropyl-17,18-dinor-atis-13-ene-15β,16α-di(2-hydroxybenzylideneamino)-4-carboxylic acid methyl ester (3): К раствору 1 г диамина (2,7 ммоль) в 20 мл хлороформа добавили 0,65 г (5,3 ммоль) салицилового альдегида. Реакционную смесь перемешивали 8 ч, затем растворитель удалили в вакууме, остаток кристаллизовали из этанола. Получили 1,38 г (89%) желтых кристаллов. Тпл. = 129-131 °C, : +330.0 (c 0.4, CHCl3). 1H NMR (300 MHz, CDCl3): δ = 0.72 (s, 3H), 1.05 (m, 2H), 1.12 (m, 7H), 1.17 (m, 4H), 1.55 (m, 6H), 1.75 (m, 3H), 2.18 (m, 1H), 2.46 (m, 1H), 2.56 (m, 1H), 2.92 (d, J = 2.2 Hz, 1H), 3.06 (m, 1H), 3.66 (s, 3H), 5.59 (s, 1H), 6.83-7.01 (m, 4H), 7.19-7.37 (m, 4H), 8.15 (s, 1H), 8.27 (s, 1H), 13.43 (br s, 1H), 13.53 (br s, 1H) ppm. 13C NMR (75 MHz, CDCl3): δ = 179.5, 164.6, 163.6, 161.3, 161.2, 147.9, 132.6, 132.4, 131.6, 131.5, 125.4, 118.9, 118.8, 118.6, 118.6, 117.1, 117.09, 85.5, 76.7, 53.3, 52.0, 49.9, 47.4, 42.3, 40.8, 38.3, 37.7, 37.0, 34.9, 32.9, 22.2, 21.9, 20.87, 20.85, 17.3, 16.9, 16.3. IR (KBr): 2929, 2868, 1723, 1626, 1579, 1494, 1460, 1386, 1280, 1244, 1194, 1150, 1071, 1049, 846, 757 cm-1. HRMS ESI [M]+ calcd. for C37H46N2O4 582.3457, found 582.3456.
13-isopropyl-17,18-dinor-atis-13-ene-15β,16α-di[(2-hydroxybenzyl)amino]-4-carboxylic acid methyl ester (4): К раствору основания Шиффа 3 (1 ммоль) в этаноле (10 мл) при комнатной температуре порциями добавили боргидрид натрия (150 мг, 4 ммоль). Контроль протекания реакции осуществляли по ТСХ. Реакционную смесь упарили, добавили 10 мл воды, экстрагировали этилацетатом (2x20 мл). Органическую фазу отделили, сушили над Na2SO4, упарили. Продукт очищали колоночной хроматографией на силикагеле (гексан-этилацетат 7:3). Получили диамин в виде бесцветных кристаллов массой 0,56 г (96%). Тпл. 173-175 °C, : +16.4 (c 0.5, CHCl3). 1H NMR (400 MHz, CDCl3): δ = 0.65 (s, 3H), 0.96 (m, 1H), 1.02 (m, 6H), 1.06 (m, 1H), 1.16 (s, 3H), 1.20 (m, 1H), 1.30 (m, 1H), 1.42 (m, 4H), 1.53 (m, 2H), 1.71 (m, 2H), 1.82 (m, 1H), 2.02 (m, 1H), 2.15 (m, 1H), 2.30 (m, 1H), 2.41 (m, 1H), 2.75 (m, 1H), 3.66 (s, 3H), 3.83 (d, J = 13.6 Hz, 1H), 3.89 (d, J = 13.6 Hz, 1H), 3.95 (d, J = 13.6 Hz, 1H), 4.06 (d, J = 13.6 Hz, 1H), 5.40 (s, 1H), 6.74 (m, 1H), 6.81 (m, 2H), 6.88 (m, 1H), 6.97 (m, 1H), 7.03 (m, 1H), 7.14 (m, 1H), 7.20 (m, 1H) ppm. 13C NMR (100 MHz, CDCl3): δ = 179.4, 158.7, 158.3, 149.5, 129.5, 129.3, 128.8, 128.7, 124.8, 123.1, 123.07, 119.8, 119.5, 116.9, 116.8, 73.7, 63.6, 53.8, 52.3, 50.8, 50.3, 49.8, 47.6, 43.0, 38.8, 37.9, 37.2, 35.9, 34.9, 33.1, 22.2, 21.6, 21.0, 20.8, 17.5, 17.2, 16.2. IR (KBr): 3282, 2926, 2865, 1708, 1612, 1590, 1476, 1446, 1387, 1248, 1193, 1139, 1104, 845, 797, 752 cm-1. HRMS ESI [M]+ calcd. for C37H50N2O4 586.3765, found 586.3768.
Учитывая химические свойства левопимаровой кислоты (1) и других компонентов, входящих наряду с ней в состав природного сырья, мы определили оптимальную последовательность стадий синтеза 1,2-диамина (см. рис. 1). Сосновая живица Pinus silvestris на 75-95% состоит из смеси смоляных кислот абиетинового типа – трициклических диеновых дитерпенов, содержащих одну карбоксигруппу и претерпевающих взаимопревращения при нагревании или в присутствии кислотных катализаторов [7, P. 342]. Левопимаровая кислота (1) - одна из кислот абиетинового типа, составляющая 30-50 % от сосновой живицы - является цис-диеном и легко вступает в реакцию Дильса-Альдера с активированными диенофилами уже при 20-30 °C [8, С. 39-54, 150-163], [9, С. 368]. Другие кислоты абиетинового ряда образуют те же аддукты Дильса-Альдера при температурах 150 °C, после in situ изомеризации в левопимаровую кислоту [9, P. 368]. Диеновый синтез протекает с высокой стереоселективностью и, вследствие значительной разницы в растворимости образующихся диастереомеров, основной продукт легко отделяется при кристаллизации как от минорных изомеров, так и от непрореагировавших компонентов исходного сырья [9, С. 368]. Полученный таким образом оптически чистый аддукт циклоприсоединения (2) содержит транс-1,2-карбоксигруппы, которые легко превращаются в транс-1,2-аминогруппы через перегруппировку Курциуса. Аналогичное превращение мы использовали ранее при стереоспецифичном синтезе моноамина из дегидроабиетиновой кислоты [6, С. 40].
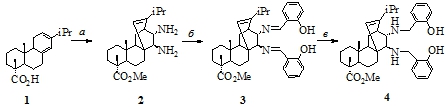
Рис. 1 - Синтез диамина (4) из левопимаровой кислоты (1). Реагенты и условия: (а) CH3I, K2CO3, ацетон, кипячение, 6 ч; фумаровая кислота, 180 ○C, Ar, 6 ч; SOCl2, ДМФА, 110 ○C, 3 ч; NaN3, толуол, +5 ○C, 2 ч; толуол, 110 ○C, 2 ч; HCl (35%), 110 ○C, 2 ч; H2O, K2CO3; (б) 2-(OH)-PhCHO, CHCl3; (в) NaBH4, C2H5OH
Для того чтобы избежать получения нежелательного триамина, при реализации разработанной схемы синтеза 1,2-диамина (2) использовали предварительно этерифицированную сосновую живицу. Метилирование смеси смоляных кислот происходит в результате их взаимодействия с йодистым метилом при кипячении в ацетоне в присутствии карбоната калия. Диеновый синтез осуществляли в атмосфере аргона при 180 ○C без органических растворителей, используя метиловые эфиры смоляных кислот и фумаровую кислоту. Последовательная обработка реакционной смеси диэтиловым эфиром и перекристаллизация выпавшего осадка из метанола приводит к выделению метилового эфира фумаропимаровой кислоты. Полученный таким образом монометиловый эфир фумаропимаровой кислоты является оптически чистым соединением, что подтверждается наличием в спектрах ЯМР 1Н и 13С только одного набора сигналов.
Превращение монометилового эфира фумаропимаровой кислоты в транс-1,2-диамин 2 через перегруппировку Курциуса было осуществлено one pot без выделения промежуточных продуктов (дихлорангидрид, диазид и диизоцианат) с общим выходом 78% [10, С. 159]. Дихлорангидирид метилового эфира фумаропимаровой кислоты получали обработкой аддукта Дильса-Альдера хлористым тионилом с 0.1 мл диметилформамида при кипении в толуоле за 3 ч. Дихлорангидрид метилового эфира фумаропимаровой кислоты не выделяли в чистом виде и использовали для получения диазида без дополнительной очистки. Синтез диазида проводили в двухфазной системе толуол-вода при температуре 5 °C взаимодействием дихлорангидрида метилового эфира фумаропимаровой кислоты с азидом натрия. Диазид ввиду термической нестабильности не выделяли в чистом виде, а использовали в дальнейшем синтезе без дополнительной очистки. Диизоцианат получали с использованием термической перегруппировки Курциуса. Для этого раствор диазида в толуоле осторожно нагревали, а затем кипятили. Полученный диизоцианат разлагали соляной кислотой при нагревании в толуоле. После обработки выпавшего дигидрохлорида диамина водным раствором карбоната калия выделяли свободный амин.
Синтез ключевого диамина 2 протекает стереоспецифично с образованием оптически чистого продукта, на основе которого были получены хиральные основание Шиффа 3 и вторичный амин 4 (см. рис. 1).
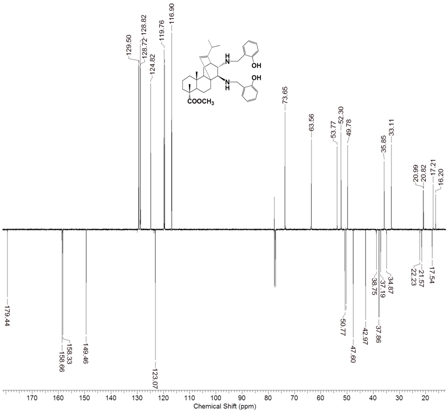
Рис. 2 – ЯМР 13С спектр аминофенола 4
Новое основание Шиффа 3 было синтезировано с выходом 89% в результате конденсации транс-1,2-амина 2 с салициловым альдегидом в хлороформе. Очистку полученного продукта проводили перекристаллизацией из этанола. Строение нового оптически чистого основания Шиффа было установлено по данным ЯМР-спектроскопии. Так в 1Н ЯМР-спектре имина 3 присутствуют характерные синглеты двух иминовых атомов водорода в области 8.16-8.26 м.д., сигналы фенольных атомов водорода наблюдаются при 13.4-13.5 м.д. Сигналы протонов двух ароматических колец наблюдаются в области 6.8- 7.4 м.д. Оптическая чистота полученного имина 3 подтверждается наличием в спектрах ЯМР только одного набора сигналов.
Новый аминофенол 4 был синтезирован восстановлением основания Шиффа 3 боргидридом натрия в этаноле при комнатной температуре. Очистка продукта осуществлялась колоночной хроматографией, в результате были получены бесцветные кристаллы аминофенола с выходом 96%. В 1Н ЯМР-спектре аминофенола 4 отсутствуют сигналы двух иминовых атомов водорода и появляются сигналы дублетов 4 протонов метиленовых групп в области 3.8-4.1 м.д. Оптическая чистота полученного диамина 4 подтверждается наличием в спектрах ЯМР только одного набора сигналов (см. рис. 2).
Таким образом, был разработан способ аминофункционализации природного хирального соединения – левопимаровой кислоты. На основе 1,2-диаминопроизводного фумаропимаровой кислоты синтезированы с высокими выходами новые хиральные диазометин и диаминофенол в оптически чистом виде.
Список литературы / References
- Blaser U. The Chiral Pool as a Source of Enantioselective Catalysts and Auxiliaries / Blaser // Chemical Reviews. – 1992. – Vol. 92. – P. 935-952. doi:10.1021/cr00013a009
- Blaser H. U. Progress in enantioselective catalysis assessed from an industrial point of view / B. Pugin, F. Spindler // Journal of Molecular Catalysis A: Chemical. – 2005. – Vol. 231. – P. 1-20. doi:1016/j.molcata.2004.11.025
- Woodward S. Use of sugar-based ligands in selective catalysis: Recent developments / S. Woodward, M. Diéguez, O. Pàmies // Coordination Chemistry Reviews. – 2010. – Vol. 254. – P. 2007-2030. doi:1016/j.ccr.2010.03.005
- González M. A. Semisynthesis of the Antiviral Abietane Diterpenoid Jiadifenoic Acid C from Callitrisic Acid (4-Epidehydroabietic Acid) Isolated from Sandarac Resin / M. A. González, R. J. Zaragozá // Journal of Natural Products. – 2014. – Vol. 77. – P. 2114–2117. doi:10.1021/np500569y
- Liu Z.-M. Asymmetric organocatalytic conjugate addition of dialkyl phosphites to N-unprotected isatylidene malononitriles: access to 3-phospho-2-oxindoles with chiral quaternary stereocenters / Z.-M. Liu, N.-K. Li, X.-F. Huang, B. Wu, N. Li, C.-Y. Kwok, Y. Wang, X.-W. Wang // Tetrahedron. – 2014. – Vol. 70. – P. 2406-2415. doi:1016/j.tet.2014.02.023
- Khlebnikova T. B. Synthesis of New Chiral Phosphorous- and Nitrogen-Containing Ligands From Resin Acids / T. B. Khlebnikova, N. N. Karpyshev, O. V. Tolstikova, A. G. Tolstikov // Chirality. – 2004. – Vol. 16. – P. 40-50. doi:1002/chir.20045
- Baldwin D. Acidic Composition of Oleoresins and Rosins / D. Baldwin, V. Loeblich, R. Lawrence // Journal of Chemical & Engineering Data. – 1958. – Vol. 3. – P. 342-346. doi:10.1021/i460004a036
- Sandermann W. Naturharze, Terpentinöl, Tallöl. Chemie und Technologie / W. Sandermann reprint of the original 1st ed. 1960 Edition, Verlag: WILEY-VCH, 1961. – 483 p.
- Halbrook N.J. Preparation and Some of the Properties of trans-6,14-Dihydrolevopimaric Acid-6,14-endo-α,β-succinic Acid / N.J. Halbrook, R.V. Lawrence. // Journal of the American Chemical Society. – 1958. – Vol. 80. – P. 368-370. doi:1021/ja01535a030.
- Konev V. N. Synthesis of Novel Optically Pure Chiral Diamine from Levopimaric Acid / N. Konev, T. B. Khlebnikova, Z. P. Pai // Chemistry for Sustainable Development. – 2011. – Vol. 19. – P. 159-162.
