ХАРАКТЕР ИЗМЕНЕНИЙ НЕСПЕЦИФИЧЕСКИХ ПРОТЕИНАЗ И ИХ ИНГИБИТОРОВ ПРИ РАЗВИТИИ КРИТИЧЕСКИХ СОСТОЯНИЙ В ЭКСПЕРИМЕНТЕ И КЛИНИКЕ
Фомочкина И. И.
Кандидат медицинских наук, Крымский государственный медицинский университет им. С.И. Георгиевского
ХАРАКТЕР ИЗМЕНЕНИЙ НЕСПЕЦИФИЧЕСКИХ ПРОТЕИНАЗ И ИХ ИНГИБИТОРОВ ПРИ РАЗВИТИИ КРИТИЧЕСКИХ СОСТОЯНИЙ В ЭКСПЕРИМЕНТЕ И КЛИНИКЕ
Аннотация
В статье представлены результаты экспериментально-клинического исследования, проведенного на 65 белых крысах-самцах линии Wistar, с моделью реперфузионного синдрома, и у 78 пациентов с острой воспалительной патологией органов брюшной полости и шоками различной этиологии. Анализ результатов исследования позволил выделить два варианта реагирования неспецифических протеиназ при системных патологических процессах. Первый вариант наблюдался при острой абдоминальной патологии и сопровождался активацией как протеиназ, так и ингибиторов, с установлением их баланса на более высоком уровне. Второй вариант, с истощением системы ингибиторов, наблюдался при тяжелых и критических ситуациях – тяжелом перитоните, реперфузионном синдроме, шоках. В данном случае системная активация протеиназ выходила из-под контроля ингибиторов, возможно, в результате усиленного потребления ингибиторов в результате массивной активации протеолитических ферментов.
Ключевые слова: неспецифические протеиназы, ингибиторы протеолиза, воспаление, шок.
Fomochkina I. I.
PhD in Medicine, Crimea State Medical University named after S. I. Georgievsky
CHARACTER OF CHANGES OF NON-SPECIFIC PROTEINASES AND THEIR INHIBITORS IN DEVELOPMENT OF CRITICAL CONDITION IN EXPERIMENTS AND CLINIC
Abstract
Experimental and clinical investigation was performed in 65 white Wistar male, with the model of systemic reperfusion syndrome and in 78 patients with acute inflammatory abdominal pathology and shocks of different etiology. Important pathogenetic role of nonspecific proteases and their inhibitors system was determined. Analysis of the results of research demonstrated two main options of response of nonspecific proteases and inhibitors in systemic pathological processes. First variant was observed in acute abdominal pathology and was accompanied with activation of both proteases and inhibitors with the restoration of their balance at a higher level. The second variant, with the depletion of inhibitors, was observed in severe critical situations - severe peritonitis, reperfusion injury syndromes, shocks. In this case, the systemic activation of proteases went out under the control of inhibitors. Such changes in proteases and their inhibitors can trigger impairment of the main course of the disease and required the specific correction.
Keywords: nonspecific proteases, inhibitors of proteolysis, inflammation, shock.
Ограниченный протеолиз является одним из наиболее универсальных механизмов, принимающих участие в регуляции многих биологических процессов [1, 2]. Исследование протеолитических систем претерпело значительные изменения в последние десятилетия: произошло смещение внимания от протеиназ-ферментов, которые принимают участие в деградации белковых молекул, к рассмотрению их в качестве ключевых сигнальных молекул [3]. Однако мы все еще в начале полного понимания значения протеолиза в регуляции физиологических функций и патогенетических механизмов развития локальных и системных патологических процессов. В большинстве случаев в научных исследованиях изучалась роль протеиназ на уровне крови, а данные о значении протеиназ-ингибиторного дисбаланса на органном и тканевом уровне носят противоречивый характер. Поэтому важным представляется проведение комплексной оценки состояния системы протеолиза на разных уровнях структурной организации. В связи с этим, цель исследования - установить патогенетические механизмы участия неспецифических протеиназ и их ингибиторов в развитии системных патологических процессов (шок, перитонит) и обосновать подходы к их патогенетической коррекции.
Материалы и методы
Экспериментальная часть исследования проведена на 65 белых крысах-самцах линии Wistar, массой тела 180–200 грамм. Животные содержались в стандартных идентичных условиях, что необходимо для создания структурной группы. Исследования проводились в соответствии с требованиями «Европейской конвенции о защите позвоночных животных, которые используются в исследовательских и других научных целях» (Strasburg, 18.03.1986) и постановления I национального конгресса по биоэтике (Киев, 2001) [4]. В качестве модели критического состояния использовали модель системного реперфузионного синдрома (РС), который моделировали путем наложения резиновых жгутов на обе задние конечности животных на уровне паховой складки [5]. Ширина пережатия тканей составляла 2-3 мм, реваскуляризация конечностей проводилась через 6 часов [5]. Развитие реперфузионного синдрома контролировали с помощью морфологических исследований. Взятие биологического материала - сыворотка крови и бронхоальвеолярный секрет (БАС) - осуществляли через 6, 12 и 24 часа после реваскуляризации конечностей. После эвтаназии животных, которую осуществляли под тиопенталовим наркозом (10 % раствором тиопентала натрия в дозе 0,5 мг/кг) путем артериального кровопускания из сонной артерии (взятие крови), выделяли легочно-сердечный комплекс. Из легких получали бронхоальвеолярный секрет путем 6-8 кратного промывания легких через трахею 10 мл изотонического раствора NaСl, получали 7-8 мл БАС. В последующем секрет центрифугировали в течение 15 минут при 1500g и отбирали супернатант, который использовали для проведения биохимических исследований.
Клинические исследования включали изучение острой абдоминальной воспалительной патологии и шоковых состояний. Исследовали сыворотку крови и БАС 40 больных с экстренной воспалительной абдоминальной патологией (22 пациента с перитонитом и 18 – без перитонита), которые находились на лечении в отделении хирургии городской клинической больницы № 6 г. Симферополя. Все больные нуждались в экстренном хирургическом лечении в связи с: острым холециститом – 12 пациентов, язвенной болезнью желудка/12перстной кишки – 16 пациентов, острым аппендицитом – 12 пациентов. БАС у пациентов получали путем введения в бронхи 7-10 мл изотонического раствора NaСl с последующей его аспирацией при проведении интубации. Возраст пациентов варьировал от 24 до 78 лет, мужчины составляли 65 %, женщины – 35%. Диагноз перитонит определялся интраоперационно. Отдельную группу наблюдения (n=8) составляли пациенты, у которых послеоперационный период протекал с развитием патологии легких по типу респираторного дистресс-синдрома (РДС): для оценки степени тяжести острого повреждения легких использовали шкалу Lung Injure Score.
Также было обследовано 38 больных отделения интенсивной терапии в возрасте от 48 до 72 лет (61 % – мужчины, 39 % – женщины). Больные находились в стационаре с диагнозом шок: кардиогенный (n=8), травматический (n=8), ожоговый (n=7) и инфекционно-токсический (n=15). Диагноз устанавливался на основании клинических проявлений болезни, а также данных лабораторных и инструментальных методов исследований: ЭКГ (некоторым больным − эхокардиография), ОАК, ОАМ, биохимические исследования: коагулограмма, АЛТ, АСТ, сахар крови). В соответствии с задачами исследования, впоследствие больные были разделены на группы с летальными (n=23) и нелетальными исходами (n=15). Все этапы клинических исследований проводили в соответствии с требованиями I национального конгресса по биоэтике (Киев, 2001).
В сыворотке крови и БАС с использованием энзиматических методов изучали активность неспецифических протеиназ и их ингибиторов на спектрофотометре «BioMate 5» (Великобритания). В частности, определяли трипсиноподобную активность (ТПА), эластазоподобную активность (ЭПА), активность α-1-ингибитора протеиназ сыворотки крови (α-1-ИП), антитриптическую активность (АТА) в секретах и кислотостабильные ингибиторы (КСИ) [21]. Белок определяли методом Лоури. Статистическая обработка полученных данных проведена с использованием методов вариационной статистики с вычислением средних величин (M) и оценкой вероятности расхождений (m), достоверными считали показатели при Р<0,05.
Результаты и обсуждение
В результате экспериментальных исследований, было установлено, что при экспериментальном РС в течение 6-ти часов наблюдалось увеличение уровня ТПА в сыворотке крови на 41,0 % (Р<0,01) по сравнению с показателями контрольной группы. Увеличение длительности постишемического периода сопровождалось более выраженным повышением ТПА: при длительности РС 12 часов наблюдалось увеличение ТПА на 107,7 % (Р<0,01). Максимальный подъем ТПА наблюдался через 24 часа после реваскуляризации, а ЭПА − через 12 часов. РС сопровождался снижением активности α-1-ИП в сыворотке крови на 31,0 % (Р<0,01) через 6 часов, на 44,7 % (Р<0,01) − через 12 и на 48,4 % (Р<0,01) через 24 часа после реваскуляризации конечностей в сравнении с контрольными значениями. РС характеризовался ростом активности КСИ через 6 часов после реваскуляризации: на 61,5 % (Р<0,01) в сравнении с показателями интактных крыс, однако через 12 и 24 часа реваскуляризации имело место выраженное снижение КСИ. Таким образом, системный РС сопровождается функциональным перенапряжением и последующим истощением ингибиторного потенциала сыворотки крови. Значительное повышение активности трипсиноподобных протеиназ может быть одной из основных причин нарушения функций гуморальных систем плазмы крови с образованием значительного количества БАВ, и, как следствие, декомпенсации системной гемодинамики и микроциркуляции, с развитием тяжелой органопатологии.
При РС в БАС увеличивалась концентрация белка, что, скорее всего, связано с увеличением проницаемости сосудистого русла. Наблюдалось приблизительно равное увеличение активности ЭПА через 6 и 12 часов после реваскуляризации конечностей. Значение АТА и уровень КСИ бронхоальвеолярного секрета уменьшались, что также может свидетельствовать о формировании дисбаланса в протеиназ-ингибиторний системе при моделировании реперфузионного синдрома в эксперименте. По-видимому, механизмы антипротеазной защиты сыворотки крови оказываются несостоятельными, что предопределяет максимальную реализацию деструктивного действия трипсиноподобных и эластазоподобных протеиназ на системном уровне.
При исследовании протеолитической активности и α-1-ИП сыворотки крови больных с острой воспалительной абдоминальной патологией были обнаружены повышение активности трипсиноподобных протеиназ. Причем у больных с перитонитом имели место более выраженные изменения ТПА. Уровень активности α-1-ИП был достаточно высок: на 37,9 % (Р<0,001) выше у больных с острой абдоминальной патологией в сравнении с контролем. На фоне увеличения ингибиторного потенциала сыворотки крови наблюдалась закономерная тенденция к снижению показателей ЭПА: ниже на 25,0 % (>0,5) в сравнении с контролем. Это указывает на то, что в сыворотке крови при воспалении сохраняется контроль над уровнем активности эластазы, который осуществляется основным сывороточным ингибитором эластазы − α-1-ИП.
При острой воспалительной абдоминальной патологии белок в БАС был выше показателей контрольной группы в 1,8 раза (Р<0,001). Увеличение уровня белка сопровождалось тенденцией к параллельному увеличению показателей антипротеолитической активности. На фоне увеличения ингибиторного потенциала БАС наблюдалось закономерное снижение показателей протеолитической активности. Так, уровень ЭПА у больных с острой воспалительной абдоминальной патологией был ниже в 1,9 раза (Р<0,01) в сравнении с контролем. ТПА в группе больных с острой абдоминальной патологией также снижалась на 23,1 % (Р<0,05) в сравнении с показателями у пациентов группы контроля.
Анализируя изменения в бронхоальвеолярном секрете можно предположить, что в БАС наблюдаются реактивные изменения в ответ на развитие патологии в брюшной полости, которые проявляются увеличением концентрации белка, увеличением ингибиторного потенциала и снижением активности протеиназ в зависимости от характера воспалительных изменений в брюшной полости.
Дополнительно были выделенные группы больных, у которых острая абдоминальная патология сопровождалась развитием перитонита или поражением легких по типа РДС. Проведенный анализ показал, что нормальной реакцией легких на развитие воспалительного процесса в брюшной полости является превентивное повышение в БАС активности ингибиторов протеиназ. Низкие исходные значения местного ингибиторного потенциала легких являются фактором риска развития бронхолегочных осложнений при экстремальных состояниях и фактором, содействующим хронизации локального воспаления бронхолегочной системы. Исходя из этого, подходы к повышению эффективности лечения, по нашему мнению, необходимо искать на пути своевременной коррекции основных сдвигов в протеиназ-ингибиторной системе.
Клинические исследования у больных с шоком доказали, что в сыворотке крови при экстремальных состояниях наблюдалось резкое повышение протеолитической активности. Так, имело место увеличение уровня ТПА при кардиогенном, травматическом, ожоговом и инфекционно-токсическом шоках на 7,1 % (Р>0,5), 14,3 % (Р>0,5), 57,1 % (Р<0,05) і 71,4 % (Р<0,05) соответственно, по сравнению с показателями контрольной группы. Также исследованиями было установлено, что развитие шока сопровождается более значительными нарушениями со стороны эластазной активности. Существенное увеличение ЭПА сыворотки крови имело место при исследовании травматического и инфекционно-токсического шока: в 4,7 (Р<0,01) и 5,7 раза (Р<0,001) в сравнении с показателями контрольной группы соответственно. Наиболее активной оказалась эластаза в сыворотке крови больных ожоговым шоком − превосходила показатели контрольной группы более, чем в 7,7 раза (Р<0,001). Таким образом, максимальный подъем ТПА наблюдался на фоне инфекционно-токсического, а ЭПА − на фоне ожогового шока. Проведенные исследования показали, что активация протеиназ сыворотки крови при экстремальных состояниях сопровождается истощением ингибиторного потенциала. При этом степень снижения активности ингибиторов зависит от этиологического фактора.
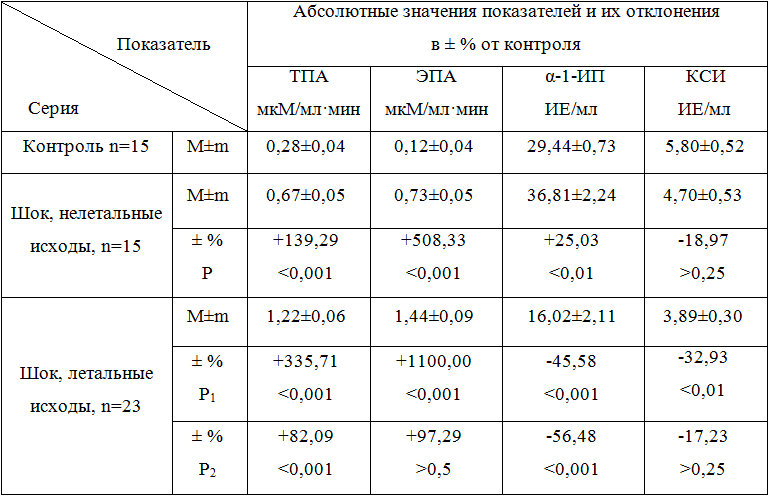
Изучение особенностей протеиназ и их ингибиторов сыворотки крови у больных с экстремальными состояниями в зависимости от исхода заболевания продемонстрировало, что уровень показателей активности протеолитических ферментов и их ингибиторов имеет свои особенности (табл. 1). Так, ТПА превышала контрольные показатели в 2,4 раза (Р<0,001), ЭПА − в 6,1 раза (Р<0,001) в группе больных, которые выжили, в то же время у пациентов с летальными исходами эти показатели превышали контрольные значения в 4,4 и 12 раз (Р<0,001) соответственно. На фоне резкого повышения протеолитической активности у пациентов с летальными исходами происходило достоверное угнетение ингибиторного потенциала сыворотки крови.
Таблица 1 - Состояние неспецифических протеиназ и их ингибиторов сыворотки крови у больных с летальными и нелетальными исходамии шока
Примечание. Р1 – показатель достоверности различий, рассчитанный по отношению к контролю, Р2 – по отношению к показателям выживщих больных.
Полученные нами клинические данные согласовываются с аналогичными экспериментальными результатами и подтверждают идею, что шок тесно связан с дезорганизацией системы ограниченного протеолиза, которая может служить одним из основных факторов, которые приводят к формированию синдрома полиорганной недостаточности, и, соответственно, ухудшают последующий прогноз, как это по-видимому, было у пациентов с летальными исходами при шоках.
Выводы
- Полученные результаты свидетельствуют о важном значении протеиназ-ингибиторной системы в формировании разнообразных вариантов шока и синдрома полиорганной недостаточности. Этот аспект является очень актуальным в клинической практике, потому что использование изменений показателей протеиназ-ингибиторной системы приведет к улучшению диагностики и прогноза развития экстремальной патологии, которое позволит повысить качество диагностики больных.
- Анализ результатов исследования продемонстрировал два основных варианта реагирования неспецифической протеиназ-ингибиторной системы при системных патологических процессах. Первый вариант наблюдался при острой абдоминальной патологии и сопровождался активацией как протеиназ, так и ингибиторов, с установлением их баланса на более высоком уровне.
- Второй вариант, с истощением системы ингибиторов наблюдался при тяжелых и критических ситуациях – тяжелом перитоните, реперфузионном синдроме, шоках. В данном случае системная активация протеиназ выходила из-под контроля ингибиторов, возможно, в результате усиленного потребления ингибиторов в результате массивной активации протеиназ. Системное истощение приводило к снижению активности ингибиторов и на локальном уровне. Результатом такой ситуации может быть риск развитие повреждения внутренних органов. Такие изменения в протеиназ-ингибиторний системе можно расценивать как состояние, которое ухудшает ход основного заболевания и требует специфической коррекции.
Литература
- Turk B. Protease signalling: the cutting edge / Turk, S. A. du Turk, V. Turk // EMBO J. - 2012. - Vol. 31, № 7. - Р. 1630-1643.
- Vargova Matrix metalloproteinases / V. Vargova, M. Pytliak, V. Mechirova // EXS. - 2012. - Vol. 103. - P. 1-33.
- Lal M. Regulated intramembrane proteolysis: signaling pathways and biological functions / M. Lal, M. Caplan // Physiology (Bethesda). - - Vol. 26, № 1. - Р. 34-44.
- Європейська конвенція про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей. Страсбург, 18 березня 1986 року: збірка договорів Ради Європи: Українська версія / Є. М. Вишневський (пер. та ред.). К.: Парламентське видавництво, 2000. 654 с.
- Горохова Н. Ю. Ингибиторы протеиназ, антиоксиданты и сурфактант в коррекции повреждений легких при турникетном шоке : автореф. дис. на здобуття наук. ступеня канд. мед. наук : спец. 03.04 «Патологическая физиология» / Н. Ю. Горохова. – Тернополь, 2003. – 20 с.
- Методи визначення активності неспецифічних протеїназ і їх інгібіторів у сироватці крові і біологічних рідинах / [А. В. Кубишкін, В. З. Харченко, П. Ф. Семенець та ін.] ; за ред. А. В. Кубишкіна. - Київ, 2010. – 28 с.
References
- Turk B. Protease signalling: the cutting edge / Turk, S. A. du Turk, V. Turk // EMBO J. - 2012. - Vol. 31, № 7. - Р. 1630-1643.
- Vargova Matrix metalloproteinases / V. Vargova, M. Pytliak, V. Mechirova // EXS. - 2012. - Vol. 103. - P. 1-33.
- Lal M. Regulated intramembrane proteolysis: signaling pathways and biological functions / M. Lal, M. Caplan // Physiology (Bethesda). - - Vol. 26, № 1. - Р. 34-44.
- Єvropejs'ka konvencіja pro zahist hrebetnih tvarin, shho vikoristovujut'sja dlja doslіdnih ta іnshih naukovih cіlej. Strasburg, 18 bereznja 1986 roku: zbіrka dogovorіv Radi Єvropi: Ukraїns'ka versіja / Є. M. Vishnevs'kij (per. ta red.). K.: Parlaments'ke vidavnictvo, 2000. 654 s.
- Gorohova N. Ju. Ingibitory proteinaz, antioksidanty i surfaktant v korrekcii povrezhdenij legkih pri turniketnom shoke : avtoref. dis. na zdobuttja nauk. stupenja kand. med. nauk : spec. 14.03.04 «Patologicheskaja fiziologija» / N. Ju. Gorohova. – Ternopol', 2003. – 20 s.
- Metodi viznachennja aktivnostі nespecifіchnih proteїnaz і їh іngіbіtorіv u sirovatcі krovі і bіologіchnih rіdinah / [A. V. Kubishkіn, V. Z. Harchenko, P. F. Semenec' ta іn.] ; za red. A. V. Kubishkіna. Kiїv, 2010. – 28 s.