Study of the effect of methyluracil on the growth and reproduction of Saccharomyces cerevisiae yeast cells
Study of the effect of methyluracil on the growth and reproduction of Saccharomyces cerevisiae yeast cells
Abstract
The aim of this study was to evaluate the ability of methyluracil to stimulate the growth and budding of Saccharomyces cerevisiae yeast cells, as well as to examine its potential to reduce the cytotoxic effect of nystatin as a stress factor. Methyluracil is one of the pyrimidine derivatives for which various biological activities have been attested. The objectives included studying the effect of various concentrations of methyluracil (50, 100 and 200 μg/ml) on the growth, viability and budding of yeast, analysis of the action of the antimycotic nystatin and its combination with methyluracil, as well as assessment of the gas-forming ability of yeast in modelling the enzymatic process. Bakery yeast incubated in a liquid medium with the addition of the studied concentrations of the substance was used in the experiment. The number of live, dead and budding cells was counted in a Gorjaev's chamber, and fermentation was assessed by the volume of carbon dioxide formed in syringes with leavened dough. It was found that methyluracil stimulates the growth and reproduction of yeast cells at all concentrations studied, most pronounced at 100 μg/ml. Growth stimulation was 28.5%. In this variant of the experiment, the maximum number of live and actively budding cells was observed. Under the effect of nystatin, methyluracil weakened its toxicity, increasing cell viability and restoring budding. In addition, at a concentration of 100 μg/ml, methyluracil provided the most intense gas formation during fermentation. The obtained data indicate the promise of using methyluracil as a growth-stimulating and protective agent in biotechnological processes related to yeast cultivation.
1. Введение
Процесс брожения, осуществляемый дрожжами Saccharomyces cerevisiae, является одним из ключевых этапов различных бродильных производств. Активность дрожжей напрямую влияет на качество, структуру и вкусовые характеристики конечного продукта, а также на продолжительность технологического цикла. В условиях промышленного производства особую значимость приобретает задача ускорения процессов активации дрожжевых клеток, в том числе их выхода из состояния анабиоза, а также усиления темпов размножения на начальных стадиях ферментации.
Стимуляция физиологической активности дрожжей остаётся актуальным вопросом на сегодняшний день. По данным ряда авторов, для активации роста клеток Saccharomyces cerevisiae применяются различные группы веществ: соли аммония, калия, магния, цинка, органические кислоты, витамины группы B, автолизаты микробной биомассы, экстракты плесневых грибов, растительное сырьё, продукты переработки молока и даже нетрадиционные источники, такие как чечевичная мука и порошок солодовой шелухи , . В частности, установлено, что предварительная дезинтегрированная биомасса Chlorella sorokiniana повышает спиртообразующую способность дрожжей и усиливает их размножение . В ряде работ также рассматривается положительное влияние кремния, дикарбоновых кислот и антиоксидантов на углеводный и азотный обмен дрожжей , . Показано, что применение автолизатов и плазмолизатов способствует ускоренному накоплению биомассы и увеличивает активность дрожжевых ферментов .
Кроме того, активно развиваются физические методы активации, включая ультразвук, электромагнитное и оптическое излучение, обработку постоянным током и ионизацию .
Большинство известных подходов к активации дрожжевых клеток ориентированы на стандартные условия культивирования, тогда как влияние стимуляторов в стрессовых средах изучено ограниченно. Это обуславливает необходимость поиска веществ, способных не только усиливать рост и размножение дрожжей, но и повышать их устойчивость к неблагоприятным факторам среды.
Среди зарегистрированных эффектов пиримидиновых производных на первое место ставят их фармакологическое действие. Введение различных типов биологически активных гетероциклических фрагментов в пиримидиновые матрицы является одним из эффективных способов открытия новых структур с широким спектром биологической активности . Было установлено, что молекулы, содержащие пиримидиновые кольца, включая моноциклические и конденсированные системы, обладают широким спектром фармакологических эффектов, в том числе противоопухолевым, противогрибковым, антибактериальным, противовирусным и противовоспалительным действиями , .
Метилурацил (диоксометилтетрагидропиримидин) — синтетическое производное пиримидина с выраженными репаративными и иммуномодулирующими свойствами. Он участвует в синтезе нуклеиновых кислот, активизирует метаболизм и способствует делению клеток, что делает его потенциальным кандидатом для использования в различных направлениях биотехнологии.
Несмотря на широкое применение метилурацила в медицине, его влияние на рост дрожжевых клеток, особенно в условиях стрессовой нагрузки, остаётся недостаточно изученным.
Цель исследования — оценить способность метилурацила стимулировать рост и почкование дрожжевых клеток, а также его возможный защитный эффект при стрессовом воздействии на клетки Saccharomyces cerevisiae.
Задачи исследования:
1. Изучить влияние различных концентраций метилурацила (50, 100 и 200 мкг/мл) на жизнеспособность и почкование клеток Saccharomyces cerevisiae в стандартных условиях культивирования.
2. Оценить влияние метилурацила на газообразующую способность дрожжей в условиях модельной ферментации.
3. Оценить динамику изменений клеточной популяции дрожжей под действием нистатина.
4. Проанализировать защитный потенциал метилурацила при его совместном применении с нистатином.
2. Методы и принципы исследования
В качестве объекта исследования использовались сухие хлебопекарные дрожжи Saccharomyces cerevisiae, метилурацил (АО ПФК «Обновление», Новосибирск), нистатин (ОАО «Борисовский завод медицинских препаратов», Беларусь).
2.1. Влияние метилурацила на рост и жизнеспособность дрожжевых клеток
Перед началом эксперимента дрожжи вносили в водопроводную воду температурой 30÷2 °C и выдерживали 15 минут, после чего аликвоты дрожжевой суспензии переносили в колбы со стерильным 5Б ячменным суслом.
Экспериментальные колбы были распределены на группы. Первая группа служила негативным контролем (только клетки дрожжей). Во вторую, третью и четвёртую группы вносили водный раствор метилурацила в концентрациях 50, 100 и 200 мкг/мл, соответственно. Инкубацию проводили 5ч при 30÷2 °C при периодическом встряхивании.
Анализ роста и состояния дрожжевых клеток проводился через 3 и 5 часов после начала инкубации. Подсчет клеток осуществляли в камере Горяева при помощи светового микроскопа с увеличением ×400. Живые и мёртвые клетки различались по окраске после окрашивания красителем метиленовым синим. Также отдельно учитывались почкующиеся клетки, как показатель пролиферативной активности.
Процент почкующихся клеток рассчитывали по формуле:
где N почкующихся — число клеток, находящихся в стадии почкования,
N общих — общее количество подсчитанных клеток.
2.2. Оценка протекторного действия метилурацила
Для изучения протекторного эффекта метилурацила проводили инкубирование при совместном внесении в среду суспензии дрожжей, нистатина и метилурацила. Нистатин применяли как модельный цитотоксический агент роста дрожжей, действующий за счёт нарушения целостности клеточной мембраны. Нистатин вносили в концентрации 10 мкг/мл, метилурацил в дозах 50, 100 и 200 мкг/мл. Инкубацию проводили в течение 5ч при температуре 30÷2°C. В начале опыта и по окончании срока инкубации подсчитывали количество живых и мертвых клеток и определяли интенсивность роста культуры в каждом варианте опыта.
2.3. Оценка газообразующей способности дрожжей под действием метилурацила
Для оценки влияния метилурацила на газообразующую активность дрожжей была приготовлена опара (мука пшеничная — 40 г, суспензия дрожжей — 1г, вода — 54 мл, сахар — 0,5 г) и внесен раствор метилурацила в исследуемых концентрациях (50, 100 и 200 мкг/мл). В качестве контроля использовали ту же опару без добавления метилурацила.
Каждую пробу в количестве 2 мл помещали в стерильные шприцы объёмом 10 мл. После внесения суспензии носики шприцев герметично запаивали. Объём выделяемого газа регистрировали по смещению поршня, визуально фиксируя его положение каждые 10 минут в течение 1 часа инкубации при температуре 32÷2 °C. Показатель смещения поршня служил косвенным критерием интенсивности брожения и метаболической активности дрожжевых клеток под действием различных концентраций метилурацила.
3. Результаты и их обсуждение
В рамках первого эксперимента была изучена динамика роста и жизнедеятельности клеток дрожжей при воздействии метилурацила в различных концентрациях. В качестве негативного контроля выступал вариант без внесения исследуемого соединения. Результаты опыта представлены в таблице 1.
В контрольной группе наблюдался стабильный рост дрожжевых клеток на протяжении всего времени инкубации, с постепенным увеличением количества живых и почкующихся клеток к пятому часу. Метилурацил проявил выраженное стимулирующее действие на рост и размножение дрожжей во всех исследованных концентрациях (50, 100 и 200 мкг/мл). При этом наибольший эффект был зафиксирован при концентрации 100 мкг/мл и к пятому часу количество живых и почкующихся клеток достигло максимума. Стимуляция роста составила 28,5%.
Таблица 1 - Выживаемость и почкование клеток дрожжей
Вариант опыта | Время культивирования | |||
3 часа | 5 часов | |||
Выживаемость, % | Почкование, % | Выживаемость, % | Почкование, % | |
Контроль | 93 | 43 | 98 | 78 |
Метилурацил, 50 мкг/мл | 95 | 65 | 100 | 82 |
Метилурацил, 100 мкг/мл | 100 | 75 | 100 | 87 |
Метилурацил, 200 мкг/мл | 98 | 54 | 95 | 83 |
Кроме этого, отмечалось явление ускоренного почкования — когда клетки начинали повторное почкование до отделения дочерних клеток, что может свидетельствовать о повышении метаболической активности и переходе к режиму «цепного» размножения, указывающему на стимулирующее влияние метилурацила на клеточный цикл (рис.1).
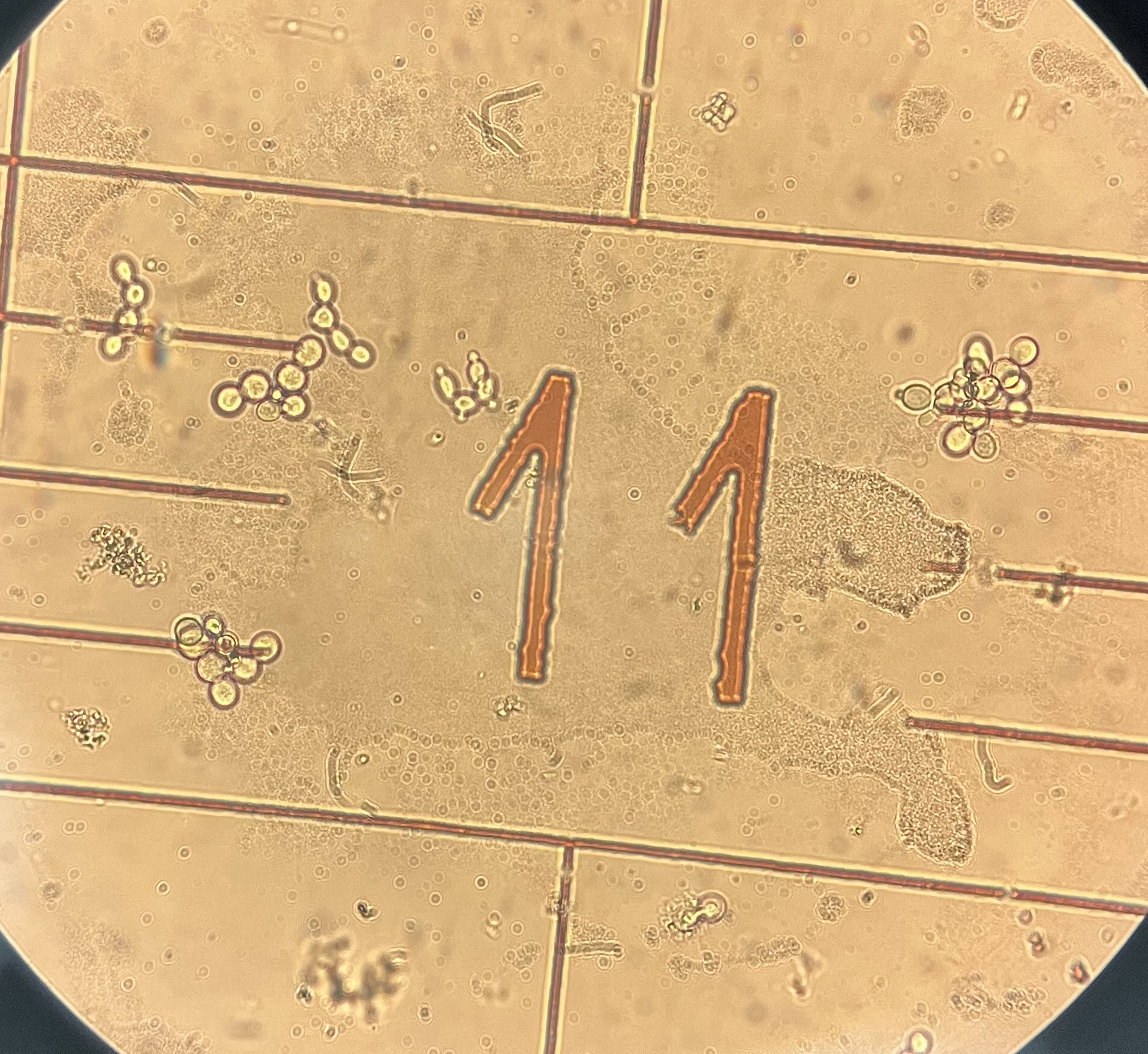
Рисунок 1 - «Цепное» почкование дрожжевых клеток под действием метилурацила
Примечание: микроскопическое изображение, ×400
Совместное применение метилурацила и нистатина значительно «смягчало» ингибирующее действие нистатина. Во всех группах с добавлением метилурацила количество живых и почкующихся клеток было выше по сравнению с группой, где был только нистатин. Особенно выраженный защитный эффект наблюдался при концентрациях 100 и 200 мкг/мл: к пятому часу численность живых клеток практически восстановилась до уровня контроля, а активность почкования достигла максимума.
Таким образом, доля почкующихся клеток, выступающая маркером метаболической активности, заметно увеличивалась под воздействием метилурацила как при его отдельном применении, так и в сочетании с нистатином, что подтверждает стимулирующее влияние метилурацила и его защитное действие на жизнедеятельность дрожжевых клеток (табл.2, 3).
Таблица 2 - Протекторные свойства метилурацила
Вариант опыта | Выживаемость клеток, % через | |
3 часа | 5 часов | |
Контроль | 100 | 98 |
Нистатин, 10мг | 44 | 70 |
Метилурацил | ||
50 мкг/мл | 95 | 100 |
100 мкг/мл | 100 | 100 |
200 мкг/мл | 98 | 95 |
Метилурацил + Нистатин | ||
50 мкг/мл | 75 | 89 |
100 мкг/мл | 80 | 95 |
200 мкг/мл | 79 | 94 |
Таблица 3 - Эффект метилурацила на почкование дрожжей при цитотоксическом стрессе
Вариант опыта | Почкование клеток дрожжей, % через | |
3 часа | 5 часов | |
Контроль | 43 | 78 |
Нистатин, 10мг | 5 | 12 |
Метилурацил | ||
50 мкг/мл | 65 | 82 |
100 мкг/мл | 75 | 87 |
200 мкг/мл | 54 | 83 |
Метилурацил + Нистатин | ||
50 мкг/мл | 18 | 35 |
100 мкг/мл | 28 | 72 |
200 мкг/мл | 27 | 70 |
Нистатин относится к числу полиеновых антибиотиков избирательно действующих на эргостерин и холестерин клеточных мембран грибов. В литературе имеются сведения о нескольких возможных механизмах полиенрезистентности у дрожжевых клеток. Один из них предполагает экскрецию части, содержащихся в клетке стеаринов, в окружающую среду. Вероятно, они связывают полиены при воздействии ими на клетки. Другой свидетельствует на замену эргостерина на другие стериновые компоненты .
В следующей серии экспериментов оценивалась газообразующая способность дрожжей при добавлении различных концентраций метилурацила (табл.4). Через 10 минут наблюдалось увеличение объема образования углекислого газа в опытах с добавлением метилурацила по сравнению с контролем. Ярко выраженный эффект был отмечен в варианте опыта с метилурацилом в концентрации 100 мкг/мл — к 10-й мин объём увеличился до 6 мл и через 60 мин составил 7,5мл. В контроле объём достигал лишь 5,8 мл, что указывает на более позднее начало брожения и медленное.
Таблица 4 - Газообразующая активность дрожжей при действии метилурацила
Время, мин | Контроль | Метилурацил | |||
50 мкг/мл | 100 мкг/мл | 200 мкг/мл | |||
Газообразующая активность, мл | 10 | 4,2 | 5,0 | 6,0 | 4,5 |
20 | 4,8 | 5,5 | 6,5 | 5,0 | |
30 | 5,5 | 6,0 | 7,0 | 5,5 | |
60 | 5,8 | 6,2 | 7,5 | 5,7 | |
Добавление 50 мкг/мл метилурацила также способствовало более быстрому подъему поршня по сравнению с контролем, но выраженность эффекта была ниже, чем при 100 мкг/мл.
Вариант с 200 мкг/мл показал менее выраженное увеличение объема (до 5,7мл) по сравнению с другими вариантами опыта (рисунок 2).

Рисунок 2 - Влияние метилурацила на газообразующую активность дрожжей:
А – контроль; Б – метилурацил 50 мкг/мл; В – метилурацил 100 мкг/мл; Г – метилурацил 200 мкг/мл
4. Заключение
Полученные результаты свидетельствуют, о стимулирующем влиянии метилурацила на дрожжевые клетки Saccharomyces cerevisiae, способствуя увеличению их численности и интенсификации процессов почкования. Наиболее выраженный эффект отмечался при концентрации 100 мкг/мл, при которой наблюдалось максимальное количество живых и активно делящихся клеток. Визуально фиксируемое явление ускоренного почкования с формированием «цепочек» дочерних клеток может свидетельствовать об ускорении клеточного цикла и активации метаболических процессов под действием метилурацила.
Кроме того, метилурацил проявил защитное действие в условиях стрессового воздействия нистатина. Его добавление в среды с нистатином способствовало снижению доли погибших клеток и восстановлению активности почкования, особенно в концентрациях 100 и 200 мкг/мл. Эти данные указывают на перспективность использования метилурацила в качестве потенциального активатора роста и протекторного агента для дрожжевых клеток.
