Sorptive Interaction of Potassium Polititanate with Cobalt (II) Ions
Sorptive Interaction of Potassium Polititanate with Cobalt (II) Ions
Abstract
The mechanism of interaction of potassium polititanate characterized by the general chemical formula K2O-nTiO2 with Co(II) ions in aqueous solution in the concentration range 7.5-30 mmol/l was studied using equilibrium adsorption models (Langmuir, Freundlich, Temkin, BET, Dubinin-Radushkevich). The complex nature of the sorptive interaction of potassium polititanate with Co(II) ions was revealed, and the experimental data corresponded to several adsorption isotherms depending on the concentration range. Equilibrium sorption parameters were calculated. The maximum sorption capacity of potassium polititanate in relation to Co(II) ions under the studied conditions reaches 1 mmol/g after 24 hours of contact. The modified potassium polytitanates obtained as a result of Co(II) ion sorption are promising photocatalysts for the oxidation of organic substances.
1. Введение
На протяжении последних лет сложные оксиды, в частности титанаты щелочных и щелочноземельных металлов, привлекают большое внимание благодаря их уникальным структурным особенностям и свойственным для них процессам адсорбции, интеркаляции и ионного обмена [1]. Слоистые титанаты состоят из октаэдрических элементарных звеньев TiO6, которые объединяются с аналогичными единицами с образованием зигзагообразных слоев. В этом случае баланс заряда поддерживается за счет заполнения межслойного пространства ионами щелочных металлов [2].
Слоистые оксиды, содержащие четырехвалентные металлы, часто используются для удаления / разделения нескольких радио / биотоксичных ионов металлов из водных растворов. Кроме того, они ведут себя как катиониты в щелочных растворах, в зависимости от основности центрального атома и прочности связи М-О по сравнению с O-H в гидроксильной группе. Устойчивость этого полианиона в кислых растворах ограничена сродством к протонам, взаимодействие с которыми может приводить к превращению в протонированные оксиды [3]. Полученные в результате указанных процессов соединения сохраняют исходную слоистую структуру, которая аналогична структуре щелочных ионообменников.
Высокий уровень загрязнения водной среды различными токсичными ионами тяжелых металлов хорошо известен в связи с высокой степенью индустриализации / урбанизации, и является серьезной экологической проблемой. Как и все тяжелые металлы, кобальт может быть токсичным при больших концентрациях. ПДК кобальта для водной среды составляет 0,1 мг/л [4].
Относительно новым и эффективным сорбентом и ионообменником по отношению к ионам тяжелых металлов выступает рентгеноаморный полититанат калия (ПТК). Полититанат калия относится к группе соединений с общей химической формулой K2O·nTiO2 (n = 2-8 в зависимости от условий синтеза), в данной работе стехиометрически близок к тетратитанату калия.
Известно, что тетратитанаты калия K2Ti4O9 различной морфологии обладают хорошими сорбционными свойствами. Так, максимальная сорбционная емкость нитей тетратитаната калия для ионов Cu(II), Pb(II) и Cr(III) составляет 142; 395,7 и 97 мг/г, соответственно [5]. Тетратитанат калия с морфологией вискерсов адсорбирует до 10 мг/г ионов Pb(II) и до 9 мг/г ионов Cd(II) [6]. Согласно работе [7] максимальное насыщение тетратитаната калия соответствует адсорбированному количеству катионов Pb(II), Cd(II) и Cu(II) около 319; 247 и 185 мг/г. Во всех исследованиях адсорбционный процесс преимущественно описывается изотермой Фрейндлиха.
Однако в отличие от кристаллических аналогов структурные единицы ПТК соединены под разными углами, образуя полукристаллическую слоистую структуру. Октаэдрический каркас ПТК включает в себя непрерывные ряды междоузлий, где К+ и Н+ находятся совместно с некоторыми молекулами Н2О, что способствует различным локальным расстояниям между листами и позволяет предположить об их улучшенных ионообменных и сорбционных характеристиках.
В связи с этим целью работы является исследование процесса сорбционного взаимодействия полититаната калия с ионами Со(II) в водном растворе с использованием равновесных моделей.
2. Методы и принципы исследования
Полититанат калия синтезирован по методике [8].
Для исследования сорбционного процесса суспензию полититаната калия (10 г/л) смешивали с водным раствором сульфата кобальта (II) (х.ч., ГОСТ 4462-78) с получением концентраций ионов металла 7,5; 10; 12,5; 15; 20; 25 и 30 ммоль/л при нейтральном рН. Полученные системы выдерживали в течение 24 часов при постоянном перемешивании на магнитной мешалке. Затем центрифугировали при скорости 4000 об./мин. в течение 15 минут для отделения взвешенных частиц сорбента.
Концентрацию ионов Со(II) в растворе определяли методом потенциометрического титрования с использованием иономера лабораторного И-160МП (Гомельский завод измерительных приборов, Республика Беларусь).
Оксидиметрическое определение Со(II) основано на реакции окисления ионов Со(II) феррицианидом калия в аммиачной среде:
[Co(NH3)6]2+ + [Fe(CN)6]3+ = [Co(NH3)6]3+ + [Fe(CN)6]2+
В стакан для титрования помещали аликвоту кобальтсодержащего раствора, добавляли 10 мл раствора NH4Cl (х.ч., ГОСТ 2210-72), 10 мл NH3 (ГОСТ 27067-86) и доводили до 50 мл дистиллированной H2O. Комбинированный стеклянный электрод ЭСК-10303 погружали в стакан с раствором и проводили титрование раствором K3[Fe(CN)6] (х.ч., ГОСТ 4207-75).
В ходе титрования измеряли потенциал системы Е, мВ при различном объеме добавленного титранта, и по полученным данным строили кривую потенциометрического титрования. Содержание кобальта определяли по формуле:
Для количественного описания равновесия сорбции ионов Со(II) полититанатом калия использованы модели Ленгмюра, Фрейндлиха, Темкина, БЭТ и Дубинина-Радушкевича. Линейная регрессия использована для определения наиболее подходящей модели среди всех вышеуказанных изотерм для исследуемого процесса. Линейные формы уравнений указанных моделей выражаются уравнениями (2)-(6) [9], [10], [11], [13]:
где Q – количество сорбированных ионов Со(II), ммоль/г; Q∞ – предельное количество сорбированных ионов Со(II) (емкость монослоя), ммоль/г; С – равновесная концентрация ионов Со(II) в растворе, ммоль/л; KL – константа сорбционного равновесия, характеризующая интенсивность процесса сорбции, л/ммоль; KF – константа изотермы Фрейндлиха, соответствующая сорбционной емкости, (л)1/n(ммоль)1-1/n/г; n – константа изотермы Фрейндлиха, показывающая интенсивность сорбции; А – константа равновесного связывания, соответствующая максимальной энергии связи, л/ммоль; B – коэффициент на наиболее сильно адсорбирующих центрах (постоянная уравнения Темкина); KS – константа сорбционного равновесия для полимолекулярного слоя, л/моль; k – константа, связанная с энергией адсорбции, моль2/кДж2; e – потенциал Поляни, кДж/моль, отражающий изотермическую работу переноса одного моля ионов свинца из объема равновесного раствора к поверхности сорбента и определяемый из выражения e = RT ln(1 + 1/Cравн.), где R – универсальная газовая постоянная (8,314×10−3 кДж/(моль·K)) и T – абсолютная температура (K).
3. Основные результаты и их обсуждение
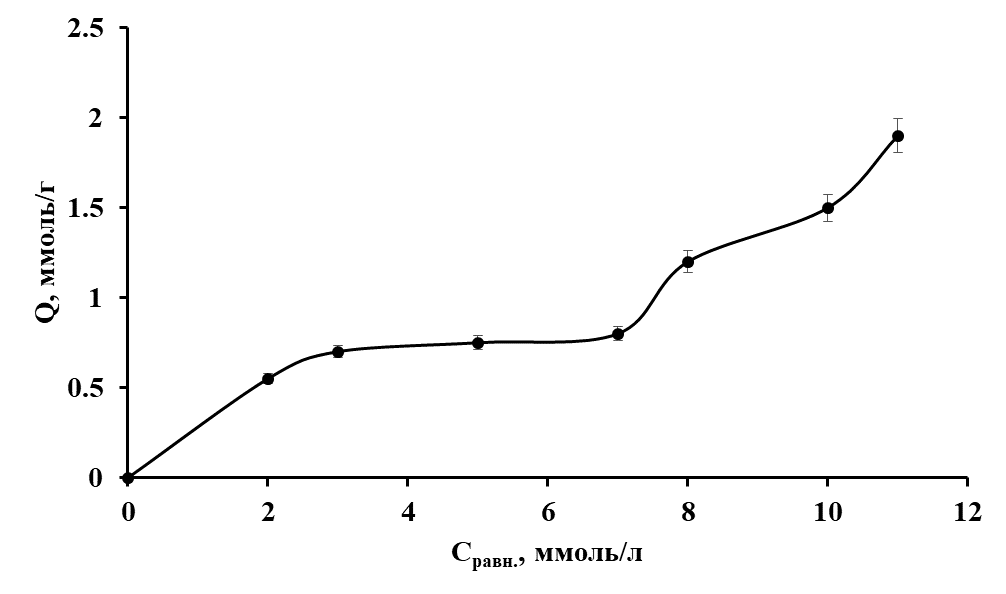
Рисунок 1 - Изотерма сорбции ионов Со(II) полититанатом калия
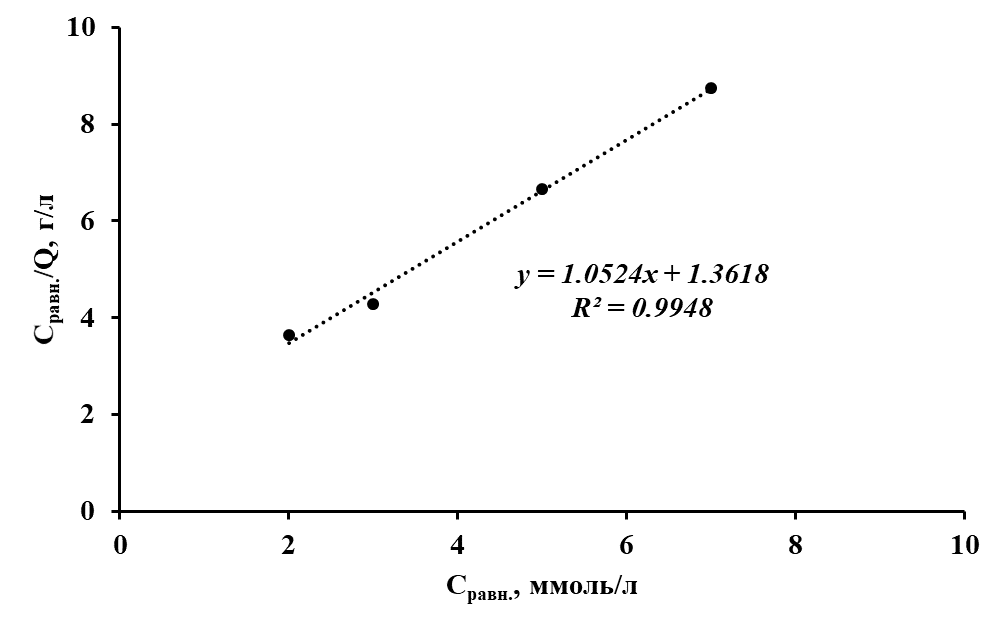
Рисунок 2 - Изотерма сорбции ионов Со(II) полититанатом калия в координатах линейного уравнения Ленгмюра
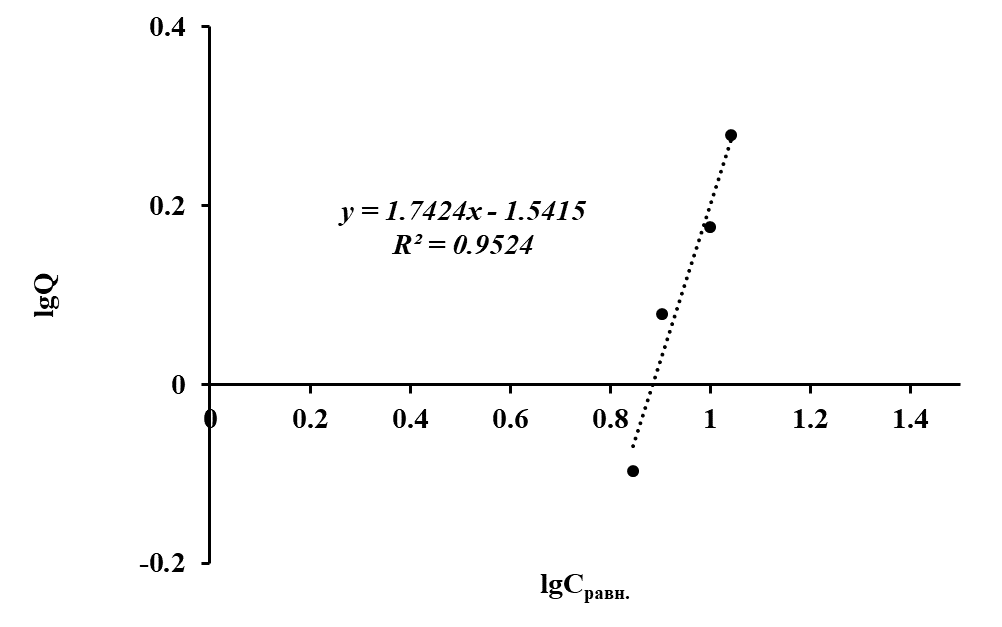
Рисунок 3 - Изотерма сорбции ионов Со(II) полититанатом калия в координатах линейного уравнения Фрейндлиха
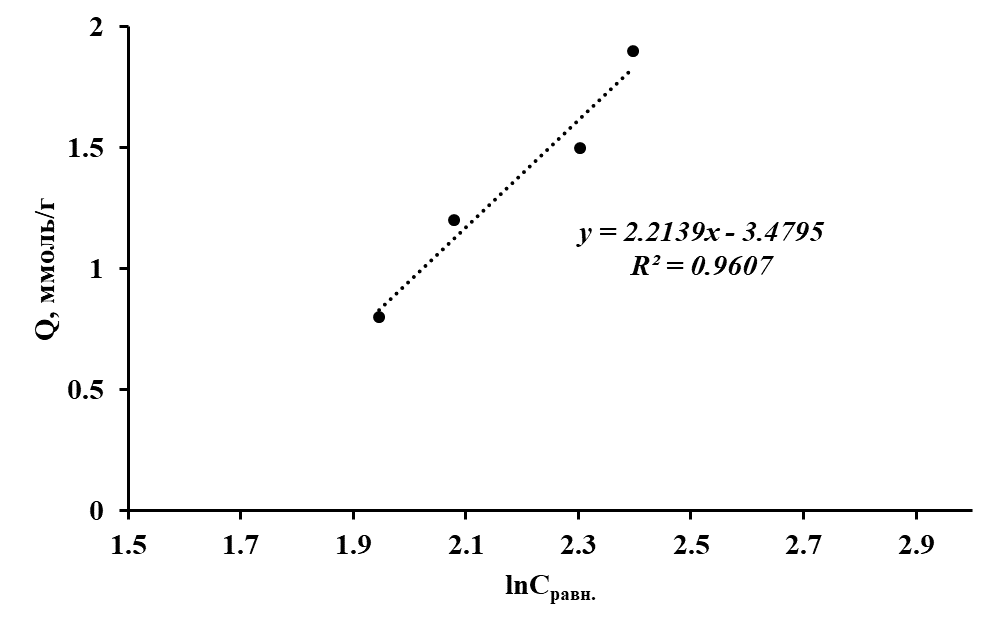
Рисунок 4 - Изотерма сорбции ионов Со(II) полититанатом калия в координатах линейного уравнения Темкина
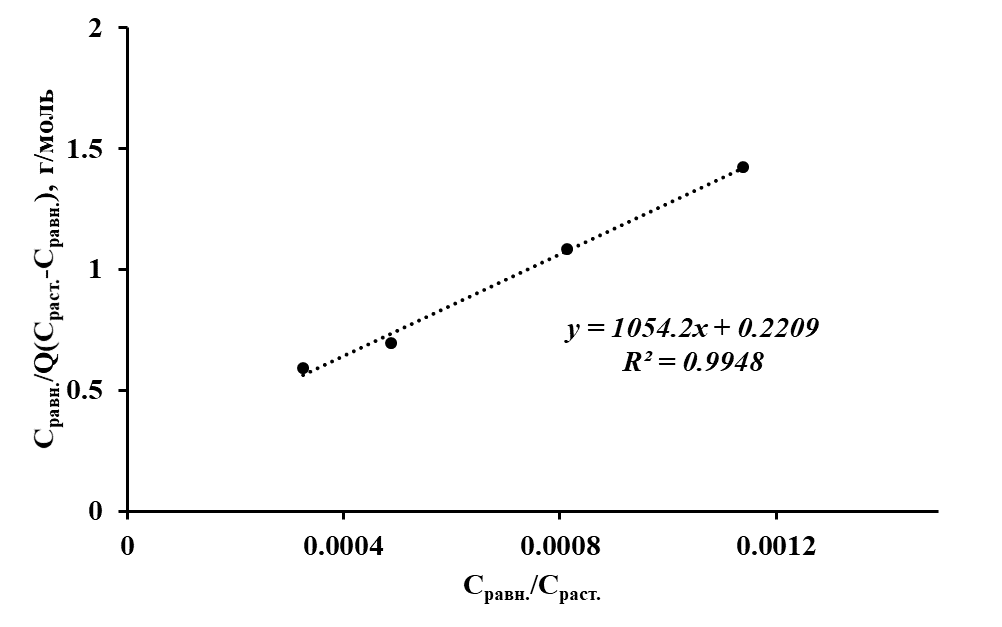
Рисунок 5 - Изотерма сорбции ионов Со(II) полититанатом калия в координатах линейного уравнения БЭТ
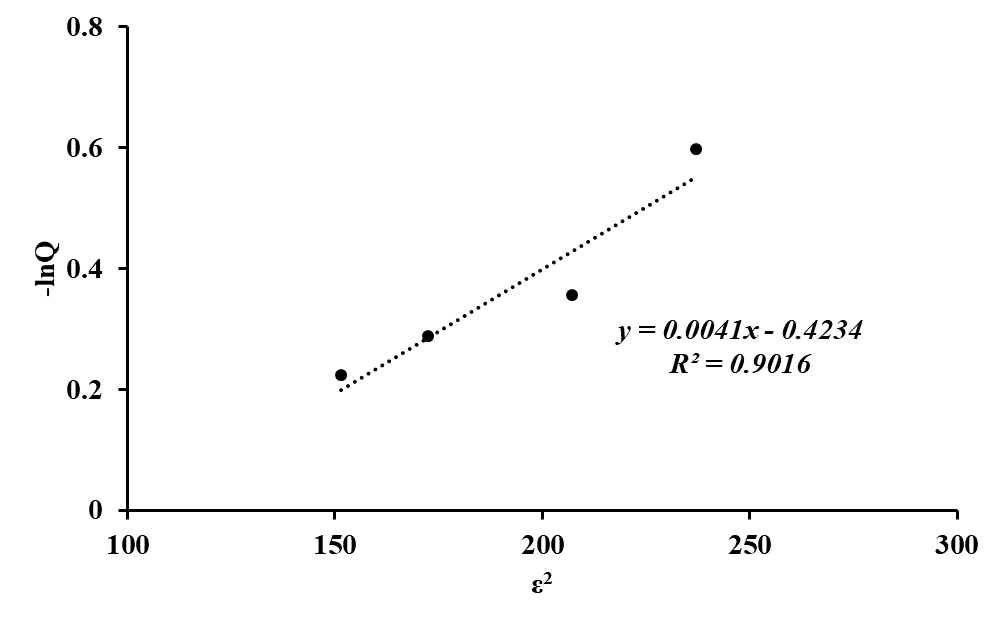
Рисунок 6 - Изотерма сорбции ионов Со(II) полититанатом калия в координатах линейного уравнения Дубинина-Радушкевича при низких концентрациях раствора
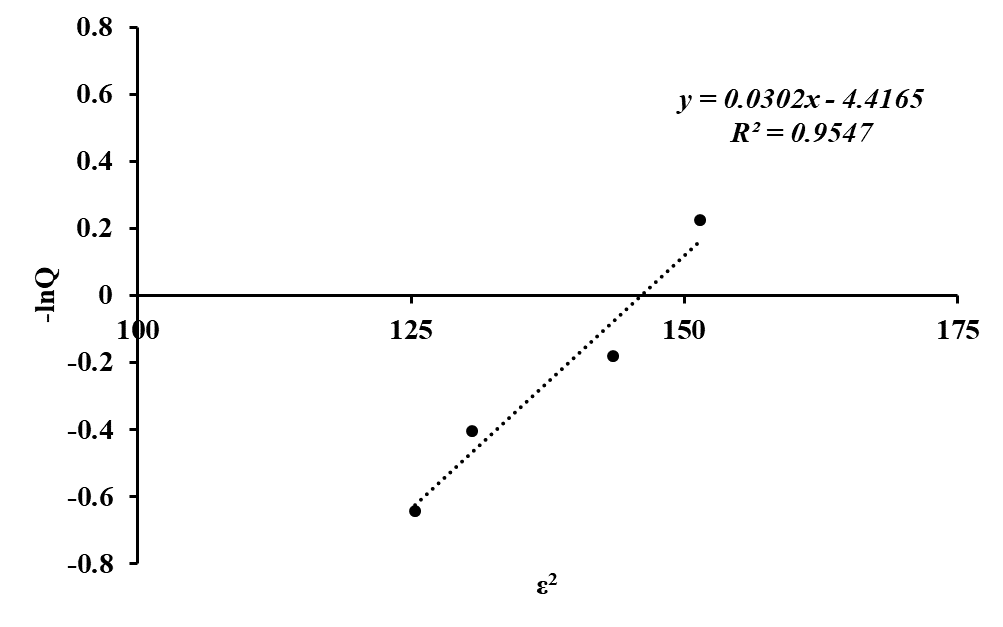
Рисунок 7 - Изотерма сорбции ионов Со(II) полититанатом калия в координатах линейного уравнения Дубинина-Радушкевича при высоких концентрациях раствора
Видно, что экспериментальные данные сорбции хорошо соответствуют изотерме Ленгмюра только при низких концентрациях ионов Со(II) в растворе. После превышения величины их равновесной концентрации в 7.0 ммоль/л полученные результаты не подчиняются уравнению сорбции Ленгмюра, поскольку наблюдается уменьшение отношения Сравн./Q с увеличением Сравн.. Убывание функции Сравн./Q свидетельствует о том, что при каком-либо значении равновесной концентрации ионов в растворе поглощается элемента больше, чем это происходило бы в случае соответствия поглощения элемента обычным представлениям о сорбции вещества на энергетически однородной поверхности. Согласно этим представлениям первоначально происходит взаимодействие сорбтива с самыми реакционноспособными сорбционными центрами с образованием наиболее прочных связей. По мере заполнения таких центров в процесс сорбции вовлекаются все более энергетически слабые центры.
Экспериментальные данные укладываются на прямую линию в координатах модели Фрейндлиха только для высоких концентраций ионов Со(II) в растворе. Предположительно, в этих случаях происходит взаимодействие сорбированных ионов тяжелого металла в реакциях поликонденсации с образованием сложных оксидно-гидроксидных комплексов кобальта на поверхности полититаната калия.
Аналогично случаю с моделью Фрейндлиха соответствие экспериментальных данных модели Темкина с наибольшим коэффициентом аппроксимации наблюдается при высоких концентрациях ионов Со(II) в растворе.
Отмечается, что при малых концентрациях сорбция ионов Со(II) полититанатом калия подчиняется модели БЭТ, что позволяет предположить тот факт, что после формирования монослоя начинают образовываться полислои сорбированных ионов тяжелого металла.
Модель Дубинина-Радушкевича позволяет предположить характер взаимодействия ионов Со(II) с ПТК. Очевидно наличие двух линейных участков в области низких и высоких концентраций ионов Со(II) в растворе, что указывает на присутствие в исследуемом сорбенте как микро-, так и макропор.
Определены равновесные параметры сорбции ионов Co(II) полититанатом калия с использованием моделей Ленгмюра, Фрейндлиха, Темкина, БЭТ и Дубинина-Радушкевича.
Таблица 1 - Значения равновесных сорбционных параметров, рассчитанных с использованием уравнений Ленгмюра, Фрейндлиха, Темкина, БЭТ и Дубинина-Радушкевича
Модель | Параметры модели | ||
Ленгмюра | Q∞, ммоль/г | KL, л/ммоль | R2 |
0,95 | 0,77 | 0,99 | |
Фрейндлиха | n | KF, (л)1/n(ммоль)1-1/n/г | R2 |
0,57 | 0,21 | 0,95 | |
Темкина | А | В | R2 |
0,21 | 2,21 | 0,96 | |
БЭТ | Q∞, ммоль/г | KS, л/ммоль | R2 |
0,95 | 4,78 | 0,99 | |
Дубинина – Радушкевича | Q∞, ммоль/г | k, ммоль2/кДж2 | R2 |
1,53 | 0,0041 | 0,90 | |
82,81 | 0,03 | 0,95 | |
Величина k в уравнении Дубинина-Радушкевича очень важна, так как по ее численному значению можно судить о природе сил взаимодействия между ионами Со(II) с активными центрами полититаната калия, то есть является ли закрепление ионов физическим процессом или имеет химический характер.
В нашем случае для полититаната калия эта величина равна 11,11 и 4,16 кДж/моль для области низких и высоких концентраций ионов Со(II) в растворе, соответственно. Следовательно, при небольшом содержании ионов тяжелого металла в растворе его взаимодействие с полититанатом калия носит химический ионообменный характер. При увеличении концентрации металла наибольшую роль приобретают физические силы, возникающие между сорбатом и сорбентом.
4. Заключение
Исследован процесс сорбционного взаимодействия полититаната калия с ионами Co(II) в диапазоне концентраций последнего 7,5-30 ммоль/л. На основании соответствия экспериментальных данных моделям Ленгмюра, Фрейндлиха, Темкина, БЭТ и Дубинина-Радушкевича предложен механизм формирования слоев сорбата и характер взаимодействия ионов Co(II) с полититанатом калия при различных концентрациях ионов металла в растворе. Определены равновесные параметры сорбции, характеризующие предельную сорбционную емкость ПТК (до 1 ммоль/г) и сродство к исследуемому сорбтиву.
