ANTIBIOTIC RESISTANCE OF THE GRASSHOPPER MICROFLORA
ANTIBIOTIC RESISTANCE OF THE GRASSHOPPER MICROFLORA
Abstract
Grasshoppers, including both short-horned and long-horned grasshoppers, are key herbivores in pasture ecosystems worldwide and are one of the most ecologically and economically important groups of insects. This article examines the antibiotic resistance of grasshopper microorganisms and the importance of grasshoppers as reservoirs of antibiotic-resistant microorganisms. The relative similarity of the microflora of the grasshoppers studied was established, which is probably due to their habitat and close interaction with plant microflora. In grasshoppers, Proteobacteria spp., Enterobacte spp., Lactococcus spp. and Bacillus spp are the most common. It was shown that the microorganisms of the studied grasshoppers have multiresistance to the used antibiotics. Such species as Bacillus spp. and Enterobacter spp. have the greatest multiresistance. Most frequently, the grasshoppers studied were resistant to fosfomycin, oxacillin, clarithromycin, lincomycin, and tobramycin. Our studies show that grasshoppers act as reservoirs of antibiotic-resistant microorganisms, which they subsequently spread in the environment, implementing horizontal gene transfer.
1. Введение
Кузнечики относятся к прямокрылым и являются основными травоядными в глобальной пастбищной экосистеме. Они имеют огромное экологическое и экономическое значение. Травоядные кузнечики используют свои кишечные бактерии для извлечения питательных веществ из неперевариваемых тканей растений [1]. Из-за потребления большого количества растительной биомассы кузнечики являются наиболее важными первичными потребителями и играют важную роль в поддержании экологического баланса [2]. Кузнечики также считаются ключевым индикатором стабильности пастбищных экосистем, особенно в местах обитания, находящихся под угрозой исчезновения, таких как луга [1].
Насекомые связаны с множеством различных микробов, роль которых в формировании взаимодействия насекомых и растений мы только начинаем понимать. Помимо прямой выгоды от симбиотического микробного метаболизма, насекомые получают и передают микробы в окружающей среде, что делает их идеальными переносчиками и потенциальными бенефициарами болезней растений и микробов, которые изменяют защитные свойства растений [3].
Взаимоотношения с микробными симбионтами наблюдаются у многих насекомых. Они имеют решающее значение для их выживания и развития. Эндосимбионты могут оказывать глубокое влияние на экологию и эволюцию насекомых и управлять совместной эволюцией растений и травоядных [4]. Но эндосимбионты могут быть носителями генов устойчивости к антибиотикам. Устойчивость к противомикробным препаратам является глобальной проблемой для здоровья, как животных, так и людей. Микроорганизмы способны реализовывать биохимические механизмы и генетические процессы, которые снижают эффективность антибиотиков [5], [6].
Инфекции, вызванные бактериями с множественной лекарственной устойчивостью, представляют собой растущую проблему из-за появления и распространения резистентности микробов к лекарственным препаратам и отсутствия разработки новых противомикробных препаратов.
Устойчивость к антибиотикам развивается в результате воздействия антимикробных агентов на популяции и сообщества бактерий. Аналогичный обмен на генетическом уровне происходит между антибиотико-резистентными микроорганизмами, попавшими в окружающую среду, и естественной бактериальной микрофлорой [7], [8], [9].
Бактерии выработали древние механизмы, позволяющие противостоять воздействию молекулы антибиотика. Устойчивость к антибиотикам кодируется несколькими генами, многие из которых могут передаваться между бактериями [10], [11], [12].
Таким образом, насекомые представляют собой возможный путь распространения детерминант устойчивости к антибиотикам в окружающей среде. Поэтому целью и задачами настоящего исследования является изучение микрофлоры кузнечиков и определение ее резистентности к антибиотикам.
2. Объекты и методы исследования
Объектами исследования служили следующие прямокрылые насекомые (n=10):
· Кузнечик серый (Decticus verrucivorus).
· Певчий кузнечик (Tettigonia cantans).
· Кузнечик Резеля (Metrioptera Roeselii).
· Кустолюбка пепельная (Pholidoptera Griseoaptera).
Насекомых вылавливали в парках, в луговых и лесных массивах. Пойманных насекомых стерильным пинцетом помещали в стерильные пробирки и выдерживали в течение 3 часов. После этого насекомых выпускали.
В лабораторных условиях в каждую пробирку заливали по 5 мл стерильного физиологического раствора. После встряхивания из каждой пробирки переносили стерильной пипеткой по 1 мл физиологического раствора в 2 пустые стерильные чашки Петри, которые заливали питательным агаром, остуженным до 40–45ОС. После застывания среды чашки переворачивали кверху дном и термостатировали при температуре 30ОС в течение 48 часов. Выделенные из образцов бактерии идентифицировали стандартными микробиологическими методами на основании их морфологических и биохимических характеристик, а также методом масс-спектрометрии на анализаторе MALDI-TOF MS autoflex speed (фирма Bruker).
Определение чувствительности бактерий к антибиотикам осуществляли диффузионным методом с использованием дисков, пропитанных антибиотиками (табл. 1).
Таблица 1 - Перечень использованных антибиотиков
№ п/п | Наименование | Концентрация, мкг | Обозначение |
1 | Оксациллин | 10 | ОКС |
2 | Кларитромицин | 15 | KTM |
3 | Бензилпенициллин | 10 | ПЕН |
4 | Тобрамицин | 30 | ТОВ |
5 | Фуразолидон | 5 | ФРН |
6 | Доксициклин | 30 | ДОК |
7 | Ломефлоксацин | 5 | ЛОМ |
8 | Фосфомицин | 200 | ФОС |
9 | Олеандомицин | 15 | ОЛЕ |
10 | Неомицин | 30 | НЕО |
11 | Тетрациклин | 30 | TET |
12 | Ампициллин | 10 | AMP |
13 | Левомицетин | 30 | ЛЕВ |
14 | Линкомицин | 15 | ЛИН |
После инкубации были измерены зоны ингибирования роста микроорганизмов (табл. 2).
Таблица 2 - Оценка чувствительности микроорганизмов к антибиотикам по зоне задержки роста
Уровни устойчивости к антибиотику | Диаметр зон ингибирования роста, мм |
Высокий | > 25 |
Средний | от 16 до 25 |
Низкий | <15 |
Статистическую обработку результатов исследования проводили с использованием табличного процессора Microsoft Excel.
3. Результаты и обсуждение
Общими для всех видов кузнечиков были Lactobacillus spp., Enterobacter spp., Bacillus spp. и Enterococcus spp. У некоторых кузнечиков были выделены Actinobacteria spp., Proteobacteria spp. и Firmicutes spp.
Общее количество микроорганизмов, выделенных из кузнечиков, варьировало от 10×4 КОЕ до 10×6 КОЕ. Исследования показали относительную схожесть микрофлоры исследованных насекомых (табл. 3). На это, вероятно, влияет связь микробиоты насекомых с местом обитания и тесным взаимодействием с растительной микрофлорой.
Таблица 3 - Микробный пейзаж кузнечиков
Наименование насекомых | Общее количество микроорганизмов, КОЕ | Выделенные микроорганизмы |
Decticus verrucivorus | 10×6 | Lactobacillus spp., Enterobacter spp., Bacillus spp., Enterococcus spp., Actinobacteria spp., Proteobacteria spp. |
Tettigonia cantans | 10×4 | Lactobacillus spp., Enterobacter spp., Bacillus spp., Enterococcus spp., Proteobacteria spp., Firmicutes spp. |
Metrioptera Roeselii | 10×5 | Lactobacillus spp., Enterobacter spp., Bacillus spp., Enterococcus spp., Proteobacteria spp., Firmicutes spp., Actinobacteria spp. |
Pholidoptera Griseoaptera | 10×4 | Lactobacillus spp., Enterobacter spp., Bacillus spp., Enterococcus spp., Proteobacteria spp. |
Соотношение микроорганизмов, входящих в микробиом кузнечиков, отличается более выраженным представительством Lactobacillus spp., Enterobacter spp, Bacillus spp., Enterococcus spp. (рис. 1).
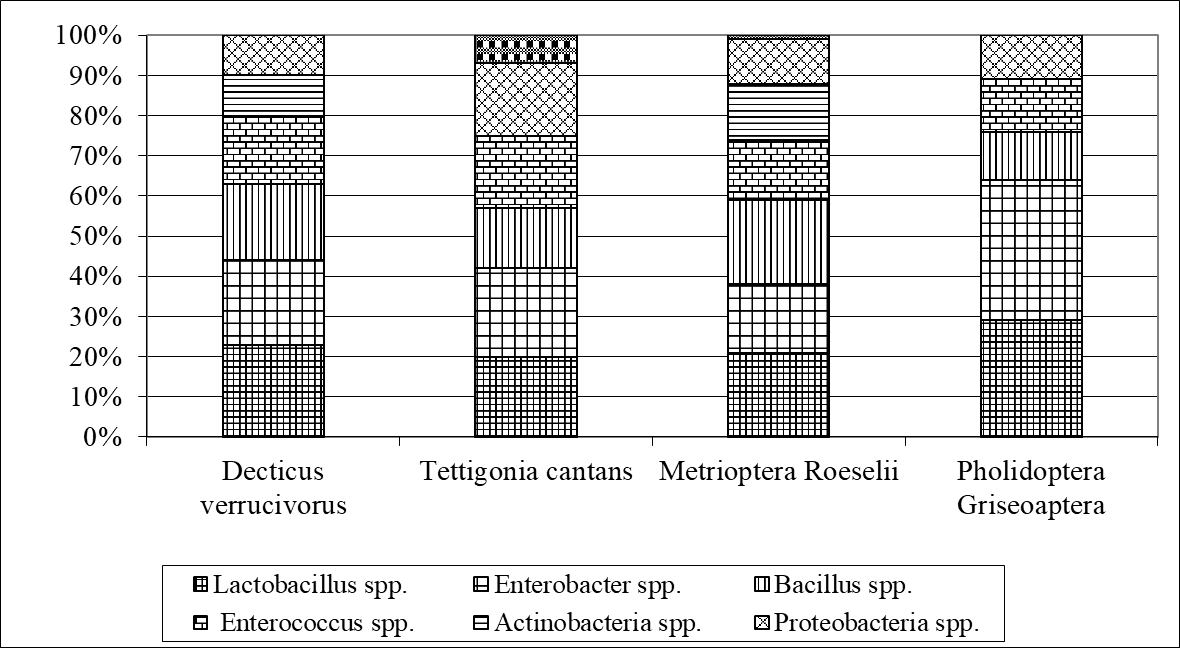
Рисунок 1 - Соотношение представителей микрофлоры, входящей в микробиом кузнечиков
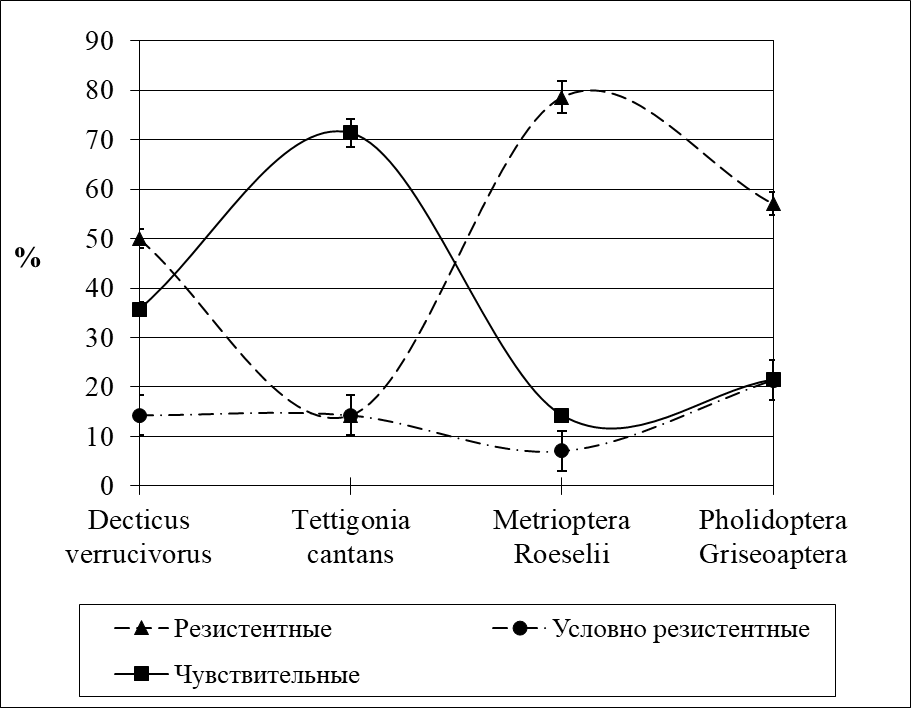
Рисунок 2 - Уровень резистентности кузнечиков к антибиотикам
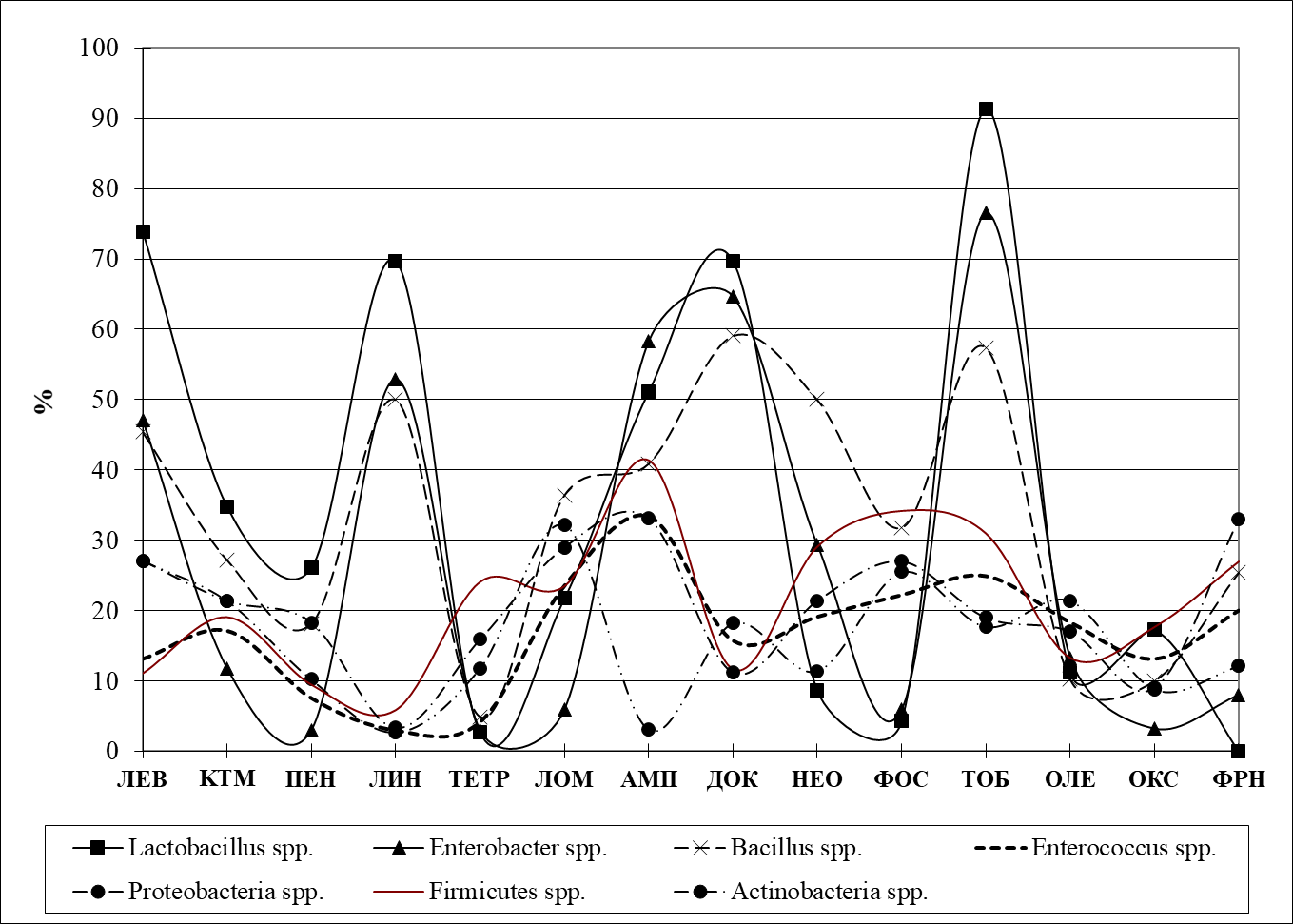
Рисунок 3 - Антибиотикограмма резистентности микрофлоры кузнечиков
4. Заключение
1. Общими для всех видов кузнечиков были Lactobacillus spp., Enterobacter spp., Bacillus spp. и Enterococcus spp.
2. Общее количество микроорганизмов, выделенных из кузнечиков, варьировало от 10×4 КОЕ до 10×6 КОЕ.
3. Соотношение микроорганизмов, входящих в микробиом кузнечиков, отличается более выраженным представительством Lactobacillus spp., Enterobacter spp, Bacillus spp., Enterococcus spp.
4. Чаще всего исследованные кузнечики обладали устойчивостью к фосфомицину, оксациллину, кларитромицину, линкомицину, ампициллину, бензилпенициллину, олеандомицину и тобрамицину.
5. Уровень резистентности изолятов к антибиотикам варьирует у кузнечиков от 14,3% до 78,6%.
