SYNTHESIS AND BIOLOGICAL PREDICTION SUBSTITUTED 3-SULFANYLMETHYLTHIAZOLO[3,2-a]BENZIMIDAZOLE
Дианов В. М.1, Александрова Е. Л.2
1 Доцент, доктор фармацевтических наук; 2 студент-интерн, Башкирский государственный медицинский университет.
СИНТЕЗ И БИОЛОГИЧЕСКИЙ ПРОГНОЗ ЗАМЕЩЕННЫХ 3-СУЛЬФАНИЛМЕТИЛТИАЗОЛО[3,2-а]БЕНЗИМИДАЗОЛА
Аннотация
Синтезированы замещенные 3-сульфанилметилтиазолобензимидазолы. Выполнен компьютерный прогноз биологической активности синтезированных соединений с помощью программы PASS.
Ключевые слова: синтез, биологическая активность, замещенные 3-сульфанилметилтиазолобензимидазолы.
Dianov V. M.1, Alexandrova E. L.2
1Doctor of pharmaceutical sciences, associate professor; 2 student-intern, Bashkir State Medical University
SYNTHESIS AND BIOLOGICAL PREDICTION SUBSTITUTED 3-SULFANYLMETHYLTHIAZOLO[3,2-a]BENZIMIDAZOLE
Abstract
Synthesized substituted 3-sulfanylmethylthiazolobenzimidazole. The computer-based prediction of the biological activity of the compounds synthesized using the PASS program.
Keywords: synthesis, biological activity, substituted 3-sulfanylmethylthiazolobenzimidazole.
Поиску биологически активных производных тиазоло[3,2-а]бензимидазола уделяется большое внимание [1, 2]. Среди синтезированных тиазоло[3,2-а]бензимидазолов обнаружены эффективные иммуномодуляторы [3], метастатики [4], противовоспалительные препараты [5].
Цель работы состояла в синтезе 3-сульфанилметилзамещенных тиазоло[3,2-а]бензимидазола и логичным продолжением проводимого сотрудниками кафедры фармацевтической химии медицинского университета исследований по поиску перспективных биологически активных гетероциклических соединений в ряду конденсированных тиазолоазолов [6, 7, 8].
Методика эксперимента. Спектры ЯМР 1Н записаны на приборе Bruker DRX300 с рабочей частотой 300 МГц, ИК-спектры сняты на приборе "Инфралюм-ФТ-02". Контроль хода реакций и чистоты полученных соединений осуществляли методом ТСХ на пластинах Silufol UV-254 в системе бутанол – уксусная кислота – вода, 4:1:2, визуализировали пятна парами йода.
Общий способ синтеза замещенных 3-сульфанилметилтиазоло[3,2-а]бензимидазола (II а-г). К раствору 10 ммоль соединения I в 30 мл этанола прибавляют 10 ммоль соответствующего тиола в 10 мл алкоголята натрия (в случаях II а,б использованы натриевая и калиевая соли). Реакционную смесь кипятят 1-2 часа, охлаждают до 5-7оС, выпавший осадок отфильтровывают, фильтрат обрабатывают водой, выпавший осадок фильтруют, сушат. Очищают кристаллизацией из смеси этанол-вода. Характеристики соединений II а-г представлены в табл. 1.
Обсуждение результатов. В качестве исходного продукта для синтеза указанных производных используют 3-хлорметилтиазоло[3,2-а]бензимидазол (I) [8], в котором атом хлора замещается на различные тиолы. При непродолжительном нагревании на водяной бане (I) в этаноле или и-пропаноле с эквимолярным количеством соответствующего нуклеофила были получены 3-сульфанилметилзамещенные тиазолобензимидазола (II a-г).
Строение синтезированных соединений подтверждено результатами спектрального анализа. В спектрах ЯМР 1Н замещенных 3-метилсульфанил-тиазолобензимидазола кроме мультиплета ароматических протонов бензольного кольца в слабом поле наблюдается сигнал протона тиазольного цикла, синглет метиленовой группы у 3С-атома. В спектрах также регистрируются поглощения S-алкильных радикалов (табл. 1). В ИК-спектрах соединений II б,в наблюдаются характерные полосы поглощений С=N, NH, CH-связей.
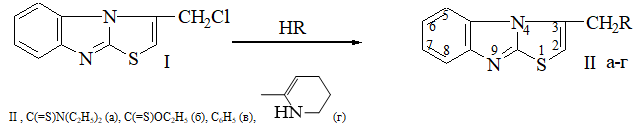
Таблица 1 - Физические и спектральные характеристики синтезированных соединений
| Соединение | Выход, % | Т. пл., оС | Брутто-формула | Спектры ЯМР 1Н (δ, м.д.) | ИК-спектры, см-1 |
| II а | 64 | 117-119 | C15H17N3S3 | 6,30-8,73 (5H, м, аром., SCH); 4,95 (2Н, с, 3-СН2); 1,25 (6Н, т, 2CH3), 3,67 (2Н, к, J 7,10 Гц, CH2), 4,02 (2Н, к, J 7,15 Гц, CH2) | - |
| II б | 68 | 229-232 | C13H12N2OS3 | 6,50-7,65 (5H, м, аром., SCH); 4,90 (2Н, с, 3-СН2); 1,35 (3H, т, CH3), 4,60 (2H, кв, СН2) | - |
| II в | 41 | 112-113 | C16H12N2S2 | - | 1600-1520 (С=N вал.), 3150-3100 (CH вал.) |
| II г | 55 | 134-136 | C15H15N3S2 | - | 1590-1520 (C=N вал.), 3050-2900 (CH вал.), 3440 (NH вал.) |
Нами выполнен компьютерный прогноз синтезированных соединений. Результаты предсказания можно рассматривать как первоначальный этап выявления возможной биологической активности. Прогноз осуществлялся с помощью программы PASS [9, 10]. Прогноз спектра биологической активности производится на основе структурной формулы химического соединения через Интернет.
Биологическая активность в PASS C&T описывается качественным образом (“наличие”/“отсутствие”). Выдаваемые результаты прогноза помимо названий активности включают в себя оценки вероятностей наличия (Pa) и отсутствия (Pi) каждой активности, имеющие значения от 0 до 1. Поскольку эти вероятности рассчитываются независимо, их сумма не равна единице.
При анализе полученных результатов было установлено, что замещенные 3-сульфанилметилтиазолобензимидазолы (II а-г) обладают различными видами биологической активности. При этом характерно преобладание одинаковых видов активности у разных соединений, что связано с особенностями их химической структуры. У всех замещенных 3-сульфанилметилтиазолобензимидазолов (II а-г) с высокой степенью вероятности (Ра=0,513-0,637) выражена противоязвенная активность. По данным прогноза (Ра=0,492-0,713) все они обладают антиканцерогенным, цитопротекторным действием, могут быть эффективными при лечении гипертонической болезни, аутоиммунных заболеваний.
По данным программы PASS синтезированные соединения (II а-г) не обладают мутагенностью и тератогенностью, вероятность проявления нежелательных эффектов сравнительно невысокая. Однако соединение IIв может обладать аритмогенным действием, а соединение IIа – способностью вызывать судороги. Данные прогноза могут быть использованы при планировании дальнейших экспериментальных исследований в системах in vitro и in vivo.
Заключение. Таким образом, проведенные исследования показывают хорошую вероятность (Ра=0,49-0,64) проявления химическими веществами противоязвенной, антинеопластической, цитопротекторной и антигипертензивной активностей и свидетельствуют о перспективности продолжения поиска новых высокоактивных соединений в данном ряду, путем модификации тиометильного радикала.
References
Thiazolobenzimidazoles / A. Chimirri, S. Grasso, G. Romeo, M. Zappala // Heterocycles. - 1988. - Vol. 27, No. 8. - P. 1975-2003.
Khalid, A. Thiazolo[3,2-a]benzimidazoles: synthetic strategies, chemical transformations and biological activities / A. Khalid, A.K. Al-Rashood, H.A. Abdel-Aziz // - 2010. - No. 15. - Р. 3775-3815.
The antiinflammatory activity of the immunomodulator WY-18,251 3-(p-chlorophenyl)tihiazolo[3,2-a]benzimidazole-2-acetic acid / S. Gilman, R. Carlson, J. Chang, A. Lewis // Agents Action. - 1985. - Vol. 17, No. 1. - P. 53-59.
Finichel, R.L. Antitumor and antimetastatiс aсtivity of 3-(p-сhlorophenyl)-2,3-dihydro-3-hydroxythiazolo[3,2-a]benzimidazole-2-acetic acid (Wy-13.876) / R.L. Finichel, P.J. Gregory, H.E. Alturn // Br. J. Cancer. - 1976. - Vol. 33, No. 3. - P. 329-335.
Gilman, S. Effects of tilomisol indometacin and levamisole on regulation of Epstein Barr virus-induced В cell proliferation by peripheral blood mononuclear cells from normal individuals and patients with rheumatoid arthritis / S. Gilman, H. Bluestein // Agents Action. - 1987. - Vol. 21, No. 3-4. - P. 266-268.
Тюрина, Л. А. Компьютерный анализ зависимости «структура–активность» производных тиазоло[3,2-а]бензимидазола с бронхолитическим действием / Л. А Тюрина, В. М. Дианов, Ф. С. Зарудий // Химико-фармацевтический журнал. - 2010. – Т. 44, № 4. - С. 31-34.
Дианов, В. М. Новый способ синтеза 3-аминометилзамещенных производных тиазоло[3,2-а]бензимидазола / В. М. Дианов, М. Х. Зелеев // Башкирский химический журнал. - 2011. - № 1. - С. 157-158.
Дианов, В. М. Синтез и иммунотропная активность производных тиазоло[3,2-а]бензимидазола / В. М. Дианов, С. В. Сибиряк, Ю. В. Строкин, Р. Ф. Садыков, С. Ф. Хайбуллина // Химико-фармацевтический журнал. - 1991. - Т. 25, № 1. - С. 40-42.
Поройков, В. В. Компьютерный прогноз биологической активности химических соединений как основа для поиска и оптимизации базовых структур новых лекарств / В. В. Поройков, Д. А. Филимонов // Азотистые гетероциклы и алкалоиды. – М.: Иридум-пресс. – 2001. – Т.1. – С. 123-129.
PASSonline URL: http://pharmaexpert.ru/PASSOnline/predict.php (date accessed 09/05/2013).
