Determination of metal and 12Х18Н10Т steel corrosion rate in NaCl-KCl melt by electrochemical methods
Determination of metal and 12Х18Н10Т steel corrosion rate in NaCl-KCl melt by electrochemical methods
Abstract
Corrosion rates of metals and 12Х18Н10Т steel in equimolar molten NaCl-KCl mixture have been determined using electrochemical methods. Individual metals Ni, Mo, Fe, Zr and corrosion-resistant steel 12Х18Н10Т were chosen as the studied materials. The limitations and possibilities of traditional electrochemical methods such as Tafel extrapolation, polarisation resistance method and calculation of corrosion rate through stationary potential have been analysed. It is shown that polarisation methods give corrosion rates overestimated by several orders of magnitude in comparison with the gravimetric method, which is associated with the specifics of the kinetics of molten chloride salts. The method of calculation through the stationary potential demonstrated the most adequate results, correlating in values with the results of the gravimetric method. The obtained findings indicate the necessity of adaptation of electrochemical methods for correct determination of corrosion rate of metals and steels in high-temperature chloride melts.
It is important still to emphasise the prospects of using electrochemical methods for assessing the corrosion resistance of structural materials in molten salts. The most important tasks in the development of these methods of corrosion rate determination should be the search for solutions for the correct application of the laws of kinetics of electrode processes in molten salts and ensuring the expressiveness of electrochemical analysis.
1. Введение
Развитие ряда отраслей современной техники связано с поиском новых сред для осуществления технологических процессов при более высоких температурах и иных условиях, которые невозможно достичь в традиционно используемых водных растворах. В этой связи широкое применение находят расплавленные солевые смеси. Они разнообразны по составу и позволяют проводить технологические операции при температурах до 1000 ºС и выше.
Расплавленные соли широко используются при производстве и хранении энергии, а также при получении некоторых металлов, например, Li, Mg, Be, Ti, Zr, Hf, Nb, Mo, U и ряда других, которые невозможно выделить электролизом из водных растворов.
Перспективно создание жидкосолевого ядерного реактора, выгодно отличающегося от других ядерно-энергетических установок внутренней безопасностью, отсутствием необходимости проводить операции по изготовлению тепловыделяющих элементов, упрощенной схемой переработки облученного ядерного топлива и возможностью утилизации минорных актинидов.
Однако применение солевых расплавов сопряжено с трудностями, вызванными коррозией конструкционных материалов в этих средах. Повышенная коррозионная активность солевых расплавов связана с их химической агрессивностью, то есть способностью реагировать с различными материалами, включая металлы, сплавы, керамические и композиционные материалы. Задача выбора конструкционного материала для использования в расплавленных средах решается на основании исследования его коррозионных характеристик.
Перспективными являются электрохимические методы определения характеристик коррозионных процессов, они позволяют экспрессно оценить скорость и механизм коррозии, а также могут быть использованы для контроля процессов в режиме реального времени. В настоящее время подробно разработаны методики для электрохимического экспресс-контроля коррозии различных металлических объектов в водных растворах , , , . Однако электрохимические методы, такие как экстраполяция Тафелевских участков поляризационных кривых, измерение поляризационного сопротивления, электрохимическая импедансная спектроскопия, измерение электрохимического шума, могут быть использованы для исследования коррозионных процессов и в солевых расплавах.
Так, исследования никелевого суперсплава IN 740H при 700–800°C в расплаве NaCl-KCl показали, что электрохимические методы дают сопоставимые результаты с гравиметрическими методами, хотя точность этих данных может варьироваться в зависимости от условий испытаний. В то же время при изучении коррозионной стойкости сплавов класса Hastelloy в хлоридных средах было выявлено, что электрохимические методы позволяют достаточно точно определить скорость разрушения, однако наличие пассивирующих слоев и продуктов коррозии может искажать реальные значения скорости коррозии.
Несмотря на свою практическую применимость, электрохимические методы имеют ряд ограничений, влияющих на точность измерений в расплавах солей. Так, при исследовании коррозии стали 316L в расплавах LiCl-KCl показано, что высокая температура приводит к нестабильности электродных потенциалов, а растворение в расплаве сразу нескольких компонентов материала усложняет интерпретацию данных. Кроме того, исследования коррозии в системах NaCl-LiCl, являющихся теплоносителем для солнечной энергетики , выявили значительные расхождения между скоростью коррозии, измеренной электрохимическими методами, и данными гравиметрического анализа, что ставит под сомнение возможность использования этих методов без дополнительной верификации.
Еще одним важным фактором является влияние продуктов коррозии на результаты электрохимических измерений. В ряде работ отмечается, что в хлоридных расплавах образование оксидных и хлоридных соединений на поверхности образцов может искажать реальные значения скорости коррозии и приводить к заниженной оценке интенсивности разрушения , .
Таким образом, несмотря на перспективность электрохимических методов, получаемые с их помощью результаты могут значительно отличаться от данных, получаемых прямыми методами исследования коррозии, а значения устанавливаемых скоростей коррозии могут варьироваться в широких диапазонах. В связи с этим целью данных исследований являлась оценка применимости электрохимических методов для исследования коррозионных процессов в среде расплавов солей.
2. Методы и принципы исследования
2.1. Исследуемые материалы
Для проведения гравиметрических испытаний использовали пластины или прутки из выбранных материалов (железо в виде стали 10895 (содержание железа не менее 99%), никель марки НП-2 (чистота 99,5%), молибден марки МЧ-1 (чистота 99,96%)), йодидный цирконий ТУ 95-46-97 (чистота 99,75%), сталь 12Х18Н10Т (ООО «ТМК-ИНОКС»)), из которых вырезали образцы в форме параллелепипедов или цилиндров.
Образцы изготовили на специальном отрезном станке «Struers Discotom-6» с жидкостным охлаждением во избежание локального перегрева металлов и стали.
Шлифовку и полировку образцов производили поэтапно (4 этапа) на шлифовально-полировальном станке «Struers TegraPol-15», начиная со шлифовальной бумаги с зернистостью Р240 и заканчивая зернистостью Р2500.
Для проведения электрохимических испытаний рабочий электрод изготавливали из исследуемого материала в форме цилиндра диаметром 5 мм с помощью токарной обработки. С одного торца электрода нарезали внутреннюю резьбу для надежного электрического контакта с молибденовым токоподводом, с другого торца зашлифовывали рабочую поверхность. Боковую поверхность электрода экранировали при помощи алундовой трубки.
Индивидуальные соли NaCl и KCl, используемые при проведении экспериментов, предварительно подготавливали по методике, применяемой для приготовления эвтектической смеси 3LiCl-2KCl . Сплавление и последующее хранение эквимолярной композиции NaCl-KCl осуществляли в перчаточном боксе с контролируемой инертной атмосферой высокочистого аргона Glovebox Systemtechnik Gmbh. Концентрации контролируемых примесей в исходной NaCl-KCl приведены в таблице 1.
Таблица 1 - Содержание примесей в исходной соли NaCl-KCl
Элемент | Массовая доля, % |
Ni | 5,3·10-3 |
Mo | 4·10-5 |
Cr | 1,1·10-3 |
Fe | 6,6·10-3 |
О | 0,021 |
2.2. Установка для проведения измерений
Для проведения электрохимических коррозионных тестов было необходимо создать инертную атмосферу над расплавом, чтобы исключить влияние атмосферных газов, главным образом, кислорода, на результаты измерений.
Для поддержания инертной атмосферы и для доступа к электродам тигель с солью помещали в реторту из нержавеющей стали 12Х18Н10Т, специально подготовленную для проведения электрохимических тестов (см. рисунок 1). Реторта представляла собой цилиндрическую емкость с рубашкой водяного охлаждения в верхней части. Крышка реторты соединена с ее корпусом через фланцевое болтовое соединение, герметизированное прокладкой из вакуумной резины. В состав крышки входят три экрана из нержавеющей стали для ослабления теплового излучения и четыре отверстия для крепления чехла термопары и держателей электродов (рабочего, вспомогательного и хлорного электрода сравнения (ХЭС)), через которые также происходит отвод избыточного аргона. В ходе проведения экспериментов через собранную и герметизированную ячейку пропускали аргон высокой чистоты (марка 5.5 по ТУ 2114-006-45905715-2010). Также на дно реторты устанавливали центратор из алунда, который позволял дополнительно исключить электрический контакт тигля с ретортой.
Нагрев реторты осуществляли в шахтной печи с силитовыми нагревателями. Температуру в печи, задаваемую на регуляторе температуры, выбирали таким образом, чтобы регистрируемая внутренней термопарой температура расплава составляла 750±5 ˚С.
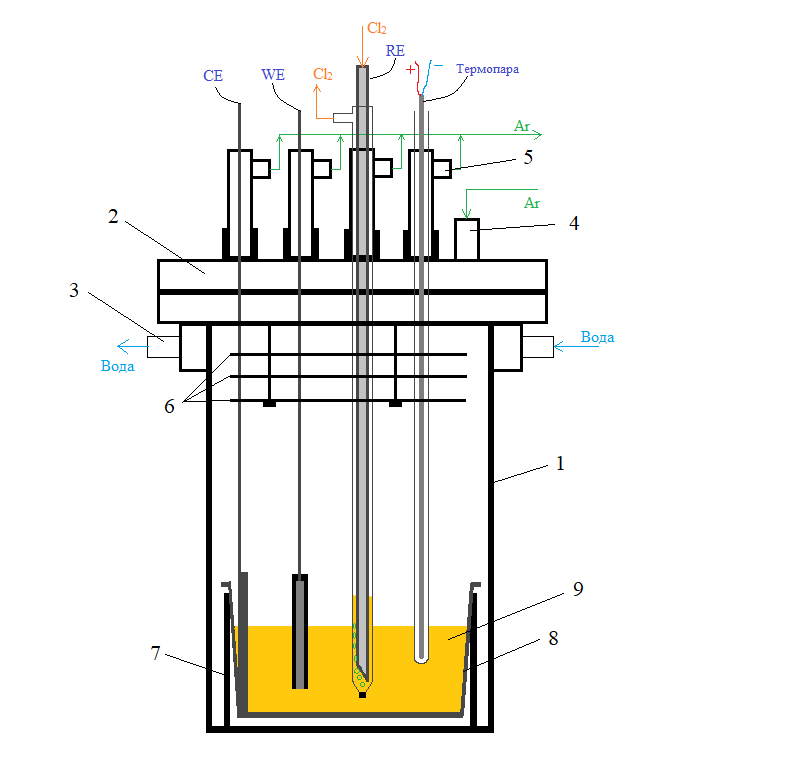
Рисунок 1 - Ячейка для проведения электрохимических измерений в сборе
Примечание: WE – рабочий электрод; CE – вспомогательный электрод; RE – электрод сравнения; 1 – реторта из нержавеющей стали; 2 – крышка реторты; 3 – отверстия для подачи-отвода охлаждающей воды; 4 – отверстие для подачи аргона; 5 – сдувки для отвода газов; 6 – теплоотражающие экраны; 7 – алундовый центратор; 8 – стеклоуглеродный тигель; 9 – солевой расплав
В качестве электрода сравнения (RE) использовали хлорный электрод сравнения, отделенный от основной массы электролита асбестовой диафрагмой. В ходе проведения электрохимических экспериментов хлор, получаемый электролизом хлорида свинца марки ЧДА, барботировали через расплав NaCl-KCl с помощью трубки из высокоплотного графита марки GS-1900, скорость подачи газа — 10 см3/мин.
2.3 Гравиметрическое определение скорости коррозии
Наиболее распространенным способом, позволяющим надежно определить скорость коррозии конструкционных материалов в расплавленных солях, является гравиметрический метод. Данный метод может быть использован для верификации сведений о скоростях коррозии, полученных электрохимическими методами. Подготовку образцов для испытаний проводили, опираясь на ГОСТ Р 9.905-2007 «Методы коррозионных испытаний» и ASTM-G54-84 .
После полировки образцов измеряли их размеры при помощи штангенциркуля. Далее образцы последовательно промывали в дистиллированной воде и этиловом спирте, после чего высушивали и взвешивали на электронных аналитических весах «Sartorius Cubis MSA225P» с чувствительностью 10-5 г.
Подготовленные образцы помещали в алундовые тигли и засыпали солью. Тигли накрывали алундовыми крышками и помещали на дно реторты. Реторту герметизировали и после трехкратной промывки создавали в ней атмосферу аргона высокой чистоты. Печь обеспечивала нагрев и поддержание заданной температуры в течение 100 часов эксперимента.
После коррозионных тестов образцы отмывали от солей в проточной воде. Затем образцы промывали в дистиллированной воде, спирте и сушили, после чего проводили их взвешивание и рассчитывали скорость сплошной коррозии CRm в [г/(м2·ч)] и глубинный показатель скорости коррозии CRd в [мм/год] по формулам (1) и (2):
где m0 и m1 — масса образца до и после коррозионных испытаний соответственно (г);
S — площадь поверхности образца (см2);
t — время выдержки (сек);
ρ — плотность исследуемого металла (г/см3).
2.4. Электрохимические тесты
Перед началом электрохимических тестов все элементы экспериментальной ячейки были тщательно очищены от возможных примесей и высушены. Солевой плав извлекали из перчаточного бокса с атмосферой высокочистого аргона Glovebox Systemtechnik Gmbh и помещали в тигель из стеклоуглерода марки СУ-2000, который, в свою очередь, вместе с хлорным электродом сравнения устанавливали в электрохимическую ячейку для проведения электрохимических измерений (см. рисунок 1). Затем осуществляли сборку и герметизацию ячейки, после чего ее трёхкратно вакуумировали и промывали аргоном высокой чистоты, оставляя после последней промывки под атмосферой инертного газа. После включения печи и последующего расплавления электролита последовательно в расплав опускали термопару и кварцевый чехол ХЭС с загруженной солью, внутри которого поддерживалась атмосфера хлора. По мере расплавления соли в чехле ХЭС опускали графитовую трубку и начинали барботировать хлор через расплав внутри электрода сравнения. После достижения внутри чехла ХЭС парциального давления хлора, равного 1 атм, в расплав погружали рабочий и вспомогательный электроды. Электрохимические измерения потенциала (WE vs RE по трехэлектродной схеме) начинали по мере достижения изотермичности в рабочей зоны внутри экспериментальной ячейки.
После установления стабильного стационарного потенциала (потенциала коррозии) фиксировали его значение для дальнейшего расчета скорости коррозии. Далее осуществляли последующие вольтамперные измерения.
Линейные вольтамперные кривые в потенциодинамическом режиме снимали следующим образом: сначала выполняли съемку анодной ветви, после чего прекращали поляризацию электрода для возвращения потенциала рабочего электрода к стационарным значениям и затем регистрировали катодную поляризационную ветвь кривой.
Поляризацию электрода производили до +0,5 В в анодном и до -0,5 В в катодном направлении относительно стационарного значения потенциала. Для каждого материала вольтамперные кривые снимались несколько раз при различных скоростях развертки потенциала: 0,1, 0,01 и 0,005 В/с.
После завершения измерений все электроды из тигля поднимали выше уровня расплава и отключали печь. После охлаждения экспериментальной ячейки ее разбирали, в ходе чего извлекали замороженный плав электролита и переносили его в перчаточный бокс с инертной атмосферой высокочистого аргона. В инертной среде пробу измельчали, усредняли, запрессовывали в таблетку и отправляли на химический анализ, который выполняли на рентгенофлуоресцентном спектрометре ADVANT’X 4200.
2.4.1. Метод экстраполяции Тафеля
Наиболее распространенным электрохимическим методом определения скорости коррозии является метод экстраполяции Тафеля. Данный метод является графическим и основан на эмпирическом уравнении Тафеля (3), которое описывает электрохимическую кинетику реакции в областях перенапряжений, где существует линейная зависимость логарифма плотности тока от потенциала
где а — постоянная Тафеля;
ba(c) — анодный или катодный коэффициент Тафеля;
ia(c) — плотность анодного или катодного тока.
Для определения плотности тока коррозии производят экстраполяцию линейных областей катодных и анодных зависимостей η = f(i) до пересечения с потенциалом коррозии — точкой, где перенапряжение равно нулю. Так как коррозионные процессы практически необратимы, то их характеризует главным образом анодная ветвь на вольтамперной кривой. За величину плотности тока коррозии принимают плотность тока, при которой линейная часть экстраполяционной зависимости η = f lg(ia) пересекает перпендикулярную линию, отвечающую значению стационарного потенциала. Таким образом, по описанному выше алгоритму, определяли плотность тока коррозии по вольтамперным кривым, снятым при скорости сканирования 0,1 В/с.
2.4.2. Метод поляризационного сопротивления
Используя полученные вольтамперные зависимости, можно определить скорость коррозии методом поляризационного сопротивления. В основе метода лежит зависимость тока, протекающего через исследуемый металл, от приложенного к нему потенциала при малых перенапряжениях (порядка ±20 мВ), которая выражается величиной поляризационного сопротивления Rp. Для расчета тока коррозии с помощью данного метода также необходимы сведения о процессах при высоких перенапряжениях (такие как коэффициенты Тафеля , ).
Значение тока коррозии будет рассчитываться по уравнению Штерна-Гири (4)
Поделив полученное значение тока коррозии, на площадь поверхности электрода S, получаем плотность тока коррозии icorr.
2.4.3. Расчет тока коррозии через стационарный потенциал
Из значений стационарных потенциалов Eстац. также можно рассчитать значения плотности коррозионного тока . Данный метод основан на зависимости величины отклонения стационарного потенциала от условного стандартного Е*Men+ / Me (следовательно применим лишь для разбавленных электролитов, где соблюдается условие постоянства коэффициентов активности) и некоторых физических свойств среды, таких как молярная масса соли Mkx, её плотность dkx, а также коэффициента диффузии D и толщины диффузионного слоя δ . Уравнение для расчета плотности коррозионного тока имеет следующий вид (5)
где R — универсальная газовая постоянная (8,314 Дж/(моль*К);
F — постоянная Фарадея (96485 Кл/моль);
Т — температура (К).
3. Основные результаты
3.1. Результаты гравиметрического определения скорости коррозии
По результатам гравиметрического определения скорости коррозии можно сделать вывод, что никель и молибден являются весьма стойкими металлами в расплаве NaCl-KCl при 750 ºС, что подтверждают исследования и . Железо и нержавеющая сталь 12Х18Н10Т уступают по коррозионной стойкости никелю и молибдену, но все ещё являются стойкими, что подтверждается в .
Полученные в результате определения гравиметрическим методом скорости коррозии (см. таблицу 2) были приняты в качестве реперных/опорных значений при последующем анализе данных, полученных электрохимическими методами.
Таблица 2 - Результаты расчетов скорости коррозии (CR) гравиметрическим методом
Материал | CR, г/(м2·ч) | CR, мкм/год |
Ni | 0,9·10-3 | 0,9 |
Mo | 9,6·10-3 | 8,2 |
Fe | 13,8·10-3 | 15,3 |
Zr | 8,0 | 11·103 |
12Х18Н10Т | 4,3·10-2 | 47 |
3.2. Результаты определения скорости коррозии методом экстраполяции Тафеля
Для определения плотности тока коррозии icorr использовали вольтамперные кривые, снятые при максимальной скорости развертки потенциала 0,1 В/с. За счет высокой скорости поляризации было сокращено время воздействия на электрод, а следовательно, и были минимизированы изменения, вызванные данным воздействием. В результате были получены катодные и анодные волны вольтамперных кривых, характеризующие схожее состояние поверхности электрода (площадь, шероховатость, химический состав). Кроме того, использование одной и той же скорости развертки потенциалов позволяет сравнивать между собой вольтамперные кривые различных материалов (см. рисунок 2).
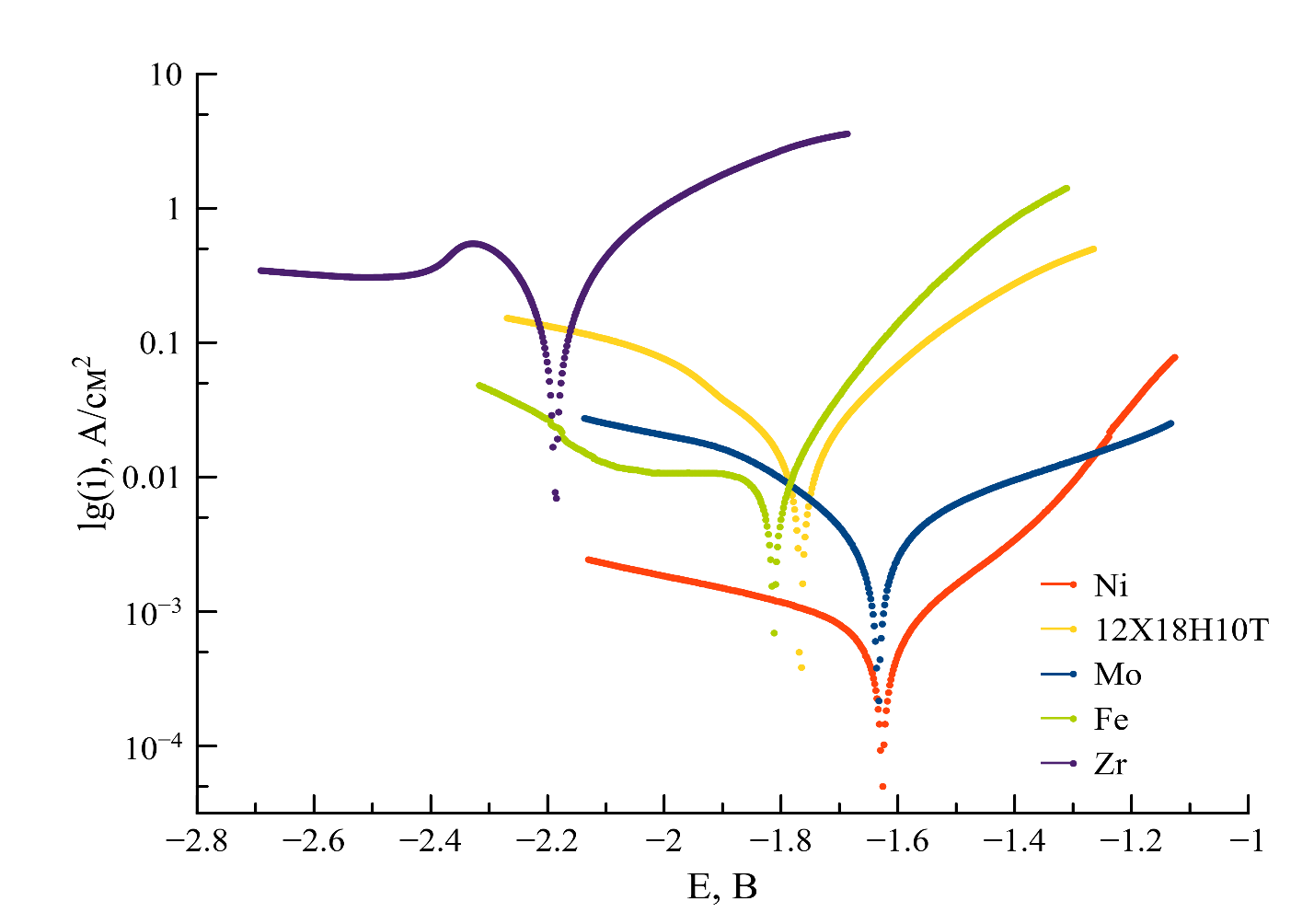
Рисунок 2 - Тафелевские зависимости логарифма плотности тока от приложенного потенциала (относительно ХЭС) для различных материалов, снятые при скорости сканирования 0,1В/с в расплаве NaCl-KCl при 750 °C
Таблица 3 - Плотности тока коррозии (icorr) и скорости коррозии различных материалов в расплаве NaCl-KCl при 750 °C, определенные методом экстраполяции Тафеля
Материал | iсorr, A/см2 | CRd, мкм/год | CRm, г/(м2·ч) |
Mo | 3,2·10-3 | 5,6·104 | 57 |
Ni | 4,6·10-3 | 2,9·104 | 33 |
Fe | 1·10-2 | 1,2·105 | 110 |
Zr | 4,1·10-1 | 9,3·106 | 6900 |
12Х18Н10Т | 1,5·10-2 | 1,7·105 | 160 |
Скорости коррозии металлов и стали, полученные методом экстраполяции Тафеля, завышены на 4–5 порядков по сравнению со значениями, полученными гравиметрическим методом. Это может быть связано с тем, что данный метод был разработан для определения скорости коррозии в растворах, где лимитирующей стадией электрохимического процесса является замедленный перенос электронов через границу электрод-электролит, т.е. коррозия подчиняется законом электрохимической поляризации. В расплавленных солях токи обмена значительны, в результате чего процессы коррозии лимитируются стадией массопереноса, а законы электрохимической кинетики не вполне применимы к расчету параметров коррозии. Разработке кинетических моделей скоростей коррозии следует уделить отдельное внимание.
Сделанный вывод о неприменимости уравнения Тафеля для оценки скоростей коррозии в расплавленных солях подтверждает факт того, что результат определения тока коррозии в значительной степени зависит от параметров съемки, таких как: направление развертки потенциала, диапазон и скорость сканирования, которые никак не учитываются при расчете скоростей коррозии. Это наглядно продемонстрировано на рисунке 3, на котором представлены вольтамперные кривые, полученные при разных скоростях поляризации никелевого электрода. При этом важно отметить, что разные исследователи используют метод Тафеля при различных скоростях поляризации: например, в работах и скорость развертки потенциала при измерении токов коррозии составляла 0,001 В/с, в — 0,01 В/с, а в — 0,0002 В/с.
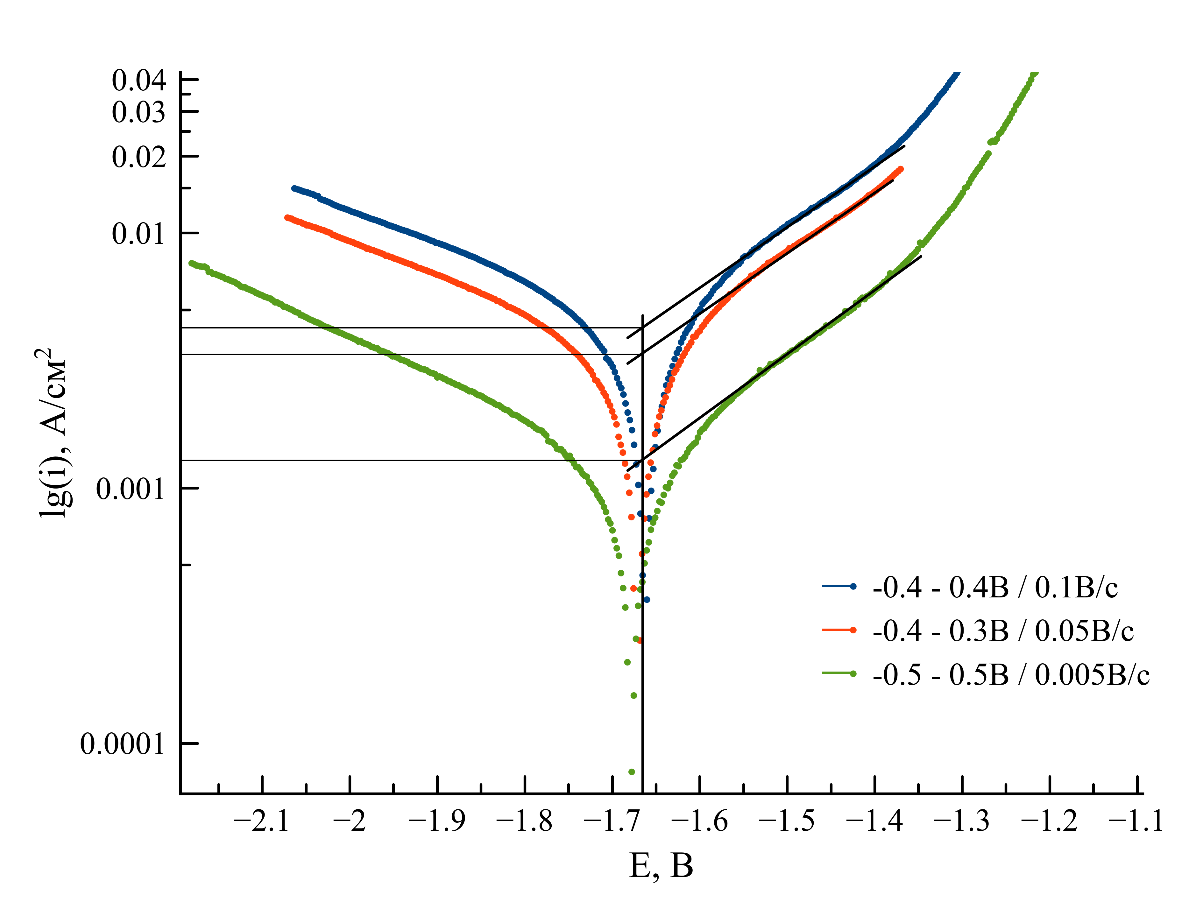
Рисунок 3 - Тафелевские зависимости логарифма плотности тока от приложенного потенциала (относительно ХЭС) для никеля, снятые при разных скоростях сканирования в расплаве NaCl-KCl при 750 °C
Таким образом, в классическом виде метод экстраполяции Тафеля неприменим для определения скорости коррозии в хлоридных расплавах. Необходимы дополнительные исследования для оценки влияния особенностей кинетики электродных процессов в расплавленных солях, а также параметров съемки вольтамперных зависимостей на результаты определения плотностей токов коррозии, что, в дальнейшем очевидно потребует установления новых закономерностей протекания коррозии в расплавленных хлоридах.
3.3. Результаты определения скорости коррозии методом поляризационного сопротивления
Согласно литературным данным, используя полученные вольтамперные кривые, можно определить скорость коррозии материалов методом поляризационного сопротивления.
Для определения токов коррозии рассчитывали величину поляризационного сопротивления Rp на основании полученной ранее зависимости i=f(E), (см. рисунок 4). Далее определяли коэффициенты ba и bc, линеаризуя вольтамперные кривые в координатах E=f(lg(i)) (см. рисунок 2), как ΔE/Δlgia. Используя полученные данные, рассчитывали ток коррозии Icorr по формуле Штерна-Гири (4).
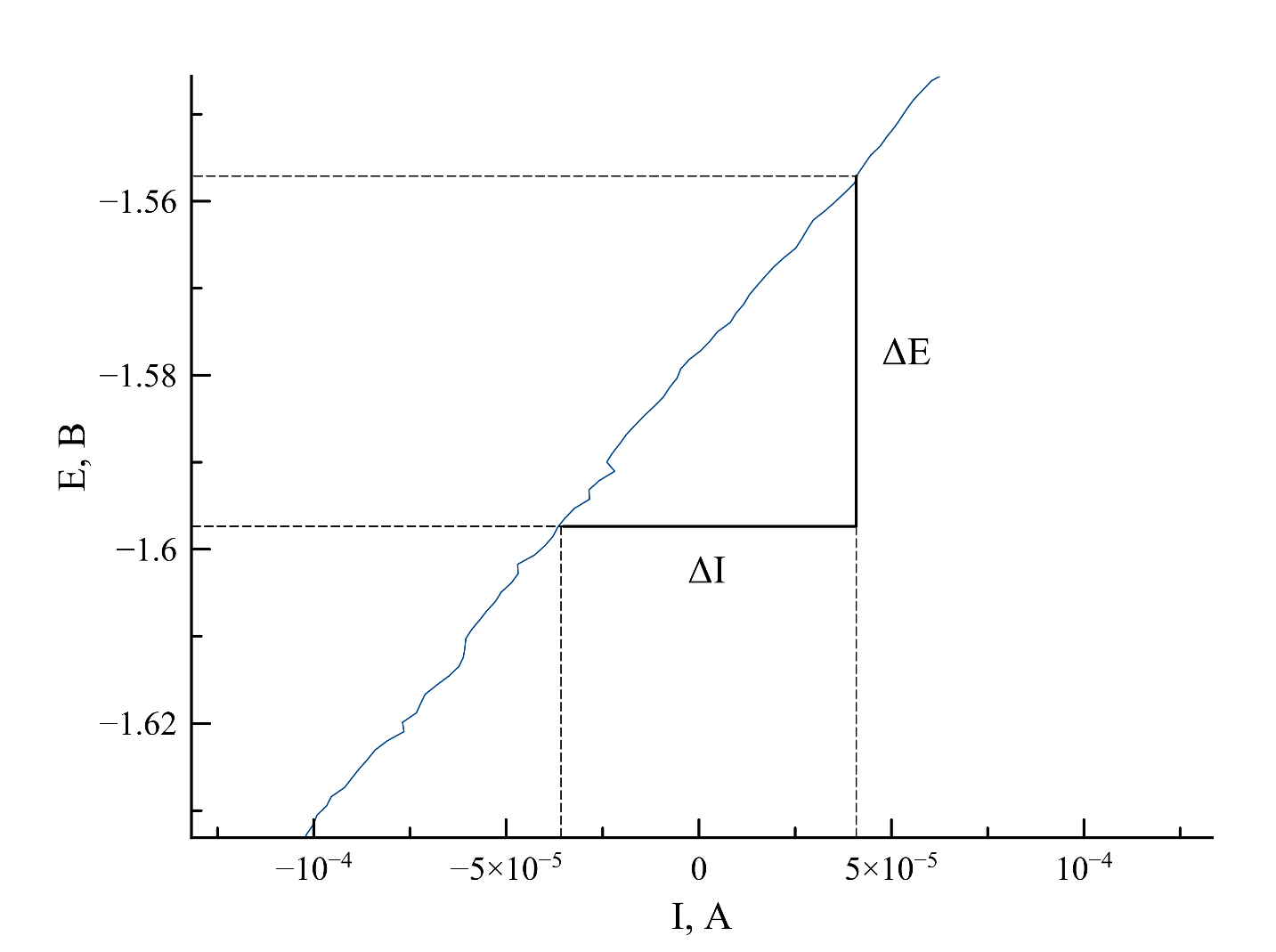
Рисунок 4 - Пример определения поляризационного сопротивления при коррозии никеля в расплаве NaCl-KCl при 750 °C
Таблица 4 - Плотности тока коррозии и скорость коррозии различных материалов в расплаве NaCl-KCl при 750 °C, определенные методом поляризационного сопротивления
Материал | iсorr, A/см2 | CRd, мкм/год | CRm, г/(м2·ч) |
Mo | 1,4·10-2 | 2,4·105 | 250 |
Ni | 5,4·10-3 | 5,1·104 | 59 |
Fe | 1,4·10-1 | 1,6·106 | 1,5·103 |
Zr | 1,4 | 3,1·107 | 2,3·104 |
12Х18Н10Т | 4,1·10-1 | 4,7·106 | 4,3·103 |
На данный метод меньше влияют параметры съемки вольтамперной кривой, так как плотность тока коррозии зависит только от угла наклона вольтамперных кривых. Вероятнее всего, причины завышения полученных значений скоростей коррозии те же, что и для метода экстраполяции Тафеля, поскольку в основе данного способа также лежат представления о замедленности стадии разряда-поляризации. Для корректного использования применительно к солевым расплавам и высоким температурам метод поляризационного сопротивления также требует детальной проработки с учетом особенностей кинетики процессов в солевых расплавах и выбора параметров съемки вольтамперных кривых.
3.4. Результаты расчета скорости коррозии с использованием значений стационарного потенциала
Метод расчета скорости коррозии с использованием значений стационарного потенциала основан на положениях диффузионной кинетики. Для расчета плотности тока коррозии на основе значений стационарного потенциала по формуле (5) необходимы некоторые справочные данные, такие как коэффициенты диффузии
Таблица 5 - Справочные данные для расчета скорости коррозии с использованием значений стационарного потенциала
Материал | E*Men+/Me, В | DMen+, см2/с·10-5 | n |
Mo | -0,871 | 2,1 | 3 |
Ni | -0,985 | 3,1 | 2 |
Fe | -1,118 | 3,5 | 2 |
Zr | -1,865 | 3,5 | 2 |
12Х18Н10Т1 | -1,270 | 0,7 | 2 |
Примечание: 1 - значения приведены для пары Cr2+/Cr и ионов Cr2+ [17]
Результаты расчетов плотностей тока коррозии и соответствующих им скоростей коррозии приведены ниже (см. таблицу 6).
Таблица 6 - Плотности тока коррозии и скорости коррозии материалов в расплаве NaCl-KCl при 750 °C, на основе значений стационарного потенциала
Материал | Eстац., В | iсorr, A/см2 | CRd, мкм/год | CRm, г/(м2·ч) |
Mo | -1,635 | 3,9·10-11 | 8,5·10-5 | 4,6·10-7 |
Ni | -1,625 | 6,9·10-7 | 6,5 | 7,6·10-3 |
Fe | -1,723 | 3,5·10-7 | 4,0 | 3,6·10-3 |
Zr | -2,16 | 4,1·10-3 | 4,4·104 | 69 |
12Х18Н10Т | -1,780 | 3·10-6 | 34 | 3,1·10-2 |
Результаты расчета скорости коррозии для никеля (см. таблицу 2 и 6), в равновесии с которым в расплаве находятся только ионы Ni2+, коррелируют с данными, полученными гравиметрическим методом (см. таблицу 2).
Рассчитанные на основании значений стационарного потенциала скорости коррозии железа в расплаве NaCl-KCl при 750 °C также близки к опорным значениям, полученным гравиметрией (см. таблицы 2 и 6).
Таким образом, использование значений стационарного потенциала для расчета скоростей коррозии металлических никеля и железа, с которыми в равновесии находятся ионы Me2+, приводит к получению более адекватных значений по сравнению со способами, основанными на применении уравнений Тафеля и Штерна-Гири. Вместе с тем неясно, почему скорость коррозии более электроотрицательного железа в данном случае ниже, чем таковая для никеля.
Полученная в результате расчета с использованием значений стационарного потенциала скорость коррозии для молибдена на несколько порядков ниже опорного значения (см. таблицы 2 и 6). Данные результаты, на наш взгляд, обусловлены возможностью образования в приэлектродном слое двойной тугоплавкой соли K3MoCl6, следствием чего будет уменьшение концентрации ионов Mo3+, равновесных с металлическим молибденом, определяющих стационарный потенциал электрода. Вместе с тем, нельзя исключить, что на молибденовом электроде устанавливается равновесие, характеризующее не пару Mo3+/Mo, а окислительно-восстановительный потенциал среды, определяющийся примесными компонентами (например, ионами кислорода).
При определении скорости коррозии циркония в расплаве NaCl-KCl считали, что цирконий в разбавленных хлоридных расплавах имеет преимущественно степень окисления «+2» , поэтому для расчета нами были использованы справочные значения для ионов Zr2+ (см. таблицу 5). Порядок величины скорости коррозии, полученной с использованием значений стационарного потенциала, совпадает с результатами определения скоростей коррозии, найденных гравиметрическим методом (см. таблицы 2 и 6). Отличия в результатах могут быть обусловлены тем, что при расчетах нами не была учтена возможность образования ионов Zr4+ в процессе коррозии и их влияние на результаты вычислений плотности тока коррозии.
В специальном эксперименте нами было выполнено изучение коррозии нержавеющей стали марки 12Х18Н10Т в расплаве NaCl-KCl при 750 °C потенциометрическим методом. Так как компоненты стали находятся в ней не как зерна индивидуальных металлов, а в виде твердого раствора, и условный стандартный потенциал сплава не имеет физического смысла, то в качестве используемых в расчетах электрохимических характеристик (условный стандартный потенциал, коэффициент диффузии, число участвующих в электрохимической реакции электронов) были выбран параметры металла, имеющего наиболее отрицательный потенциал среди компонентов стали, а именно хрома (см. таблицу 5), который в первую очередь растворяется в процессе коррозии . Результаты проведенного расчета скорости коррозии с использованием условного стандартного потенциала хрома (Cr2+/Сr0) удовлетворительно согласуются с данными гравиметрии (см. таблицы 2 и 6).
Полученные результаты указывают на то, что метод определения скорости коррозии с использованием значений стационарного потенциала является более надежным по сравнению со способами, основанными на уравнении Тафеля и закономерностями электрохимической кинетики. Более того метод расчета через стационарный потенциал позволяет анализировать кинетику коррозионных процессов, а его применение не приводит к какому-либо внешнему электрохимическому воздействию на изучаемый объект. Однако, данный способ определения скорости коррозии требует достоверных справочных величин, зачастую требующих уточнения в ходе отдельных исследований, а также не является экспрессным. Тем не менее следует отметить перспективы потенциометрического способа изучения коррозионных процессов, во многом связанные с наличием дополнительного объема данных по сравнению с информацией, полученной гравиметрическим и аналитическим методами.
4. Заключение
В ходе проведения настоящей работы выполнена оценка применимости электрохимических методов (методы экстраполяции Тафеля, способ поляризационного сопротивления, расчет скорости коррозии с использованием значений стационарного потенциала) для расчета скорости коррозии конструкционных материалов в хлоридных расплавах.
Показано, что классические «быстрые» электрохимические методы в том виде, как они применяются для определения параметров коррозии в водных растворах, не могут быть использованы в хлоридных расплавах. Необходимы дополнительные исследования для оценки влияния особенностей кинетики электродных процессов в расплавленных солях, а также параметров съемки вольтамперных зависимостей на результаты определения плотностей токов коррозии, что в дальнейшем очевидно потребует установления новых закономерностей протекания коррозии в расплавленных хлоридах.
Наиболее корректные результаты были получены при использовании метода расчета через стационарный потенциал, в основе которого лежит расчет плотности тока коррозии из стационарного потенциала и некоторых физико-химических характеристик, таких как условные стандартные потенциалы, коэффициенты диффузии толщина диффузионного слоя и плотность солевого расплава. Потенциометрический метод позволяет анализировать кинетику коррозионных процессов, а его применение не приводит к какому-либо внешнему электрохимическому воздействию на изучаемый объект. Однако данный способ определения скорости коррозии требует достоверных справочных величин, зачастую требующих уточнения в ходе отдельных исследований, а также не является экспрессным.
Тем не менее важно подчеркнуть перспективы использования электрохимических методов оценки коррозионной стойкости конструкционных материалов в расплавленных солях. Наиболее важными задачами при доработке данных способов определения скорости коррозии должны быть поиск решений по корректному применению законов кинетики электродных процессов в расплавленных солях и обеспечению экспрессности электрохимического анализа.
