BIOCOMPATIBILITY OF IMPLANTS BASED ON P-NEMA HYDROGEL
BIOCOMPATIBILITY OF IMPLANTS BASED ON P-NEMA HYDROGEL
Abstract
The work is devoted to studying the response of regional lymph nodes (LN) to the implantation of poly-2-hydroxyethyl methacrylate (p-HEMA) hydrogel for the replacement of osteochondral defects in animals (rabbits) with the aim of determining the biocompatibility of the synthetic polymer in in vivo experiments and its subsequent use for biomedical technology applications. Biomaterial drugs for morphometric analysis of LU were obtained immediately after the animals were removed from the experiment. The reference values were the indicators obtained in the study of LN in three intact animals (intact series — IS, number of LN: n=6). Two rabbits with four defects not replaced with implants constituted the control series (CS) of the study (n=4). In two other animals, the defects were replaced with p-NEMA implants — the experimental series (ES, n=4). LN drugs for the research were prepared using standard methods. 30 days after the operation, the animals in the CS and ES showed signs of increased lymph circulation and lymphopoiesis activation compared to the ES. A moderate increase in the activity of B-dependent zones was also observed, as well as an increase in the number of eosinophils and plasma cells in all morphofunctional zones. The most significant changes in LN in CS and ES animals compared to intact rabbits were found mainly in the cortical substance. At the same time, the differences between CS and ES were not significant, i.e., no reaction in regional LN directly to the introduction of the p-HEMA implant was established. It was concluded that the identified signs of reactive changes in the LN during p-HEMA implantation are likely to be the morphological substrate of an adaptive immune response to surgical intervention and are associated with the development of osteochondral defects.
1. Введение
Гидрогели представляют собой системы, образованные сшитыми полимерными цепями с трехмерной сетчатой структурой, способные поглощать большое количество жидкости. Благодаря высокому содержанию воды, мягкой структуре и пористости, гидрогели могут имитировать физические, химические и биологические свойства нативных тканей организма
, , . Такие особенности гидрогелей оказались востребованными в различных областях биомедицины. В частности, это создание новых биоматериалов, адресная доставка лекарственных средств, инженерия тканей и регенеративная медицина , .Большое разнообразие синтетических и природных гидрогелей позволяет выбрать наиболее подходящие полимеры для решения той или иной задачи. Среди прочих, гидрогель поли-2-гидроксиэтилметакрилата (р-HEMA) является перспективным материалом для аппликации в различных областях медицины
, . Анализ биосовместимости гидрогеля p-HEMA с различными типами клеток in vitro показал обнадеживающие результаты. Так, выявлено отсутствие цитотоксичности, быстрое прорастание пористой матрицы полимера элементами соединительной ткани и клетками крови, низкий уровень воспалительных маркеров, эффективная дифференцировка мезенхимальных стволовых клеток, успешная пролиферация хондроцитов и фибробластов , .Вместе с тем текущие стандарты исследований in vitro и in vivo (ISO-10993) для оценки биологической реакции на материалы имплантатов не достаточны для прогнозирования приемлемости их использования в качестве медицинских изделий в клинике
. Использование любых имплантатов может приводить к появлению ряда проблем в организме, которые влекут за собой повреждение тканей и возможную потерю их функциональности . Неблагоприятные эффекты, вызванные иммунным ответом пациента на инородное тело, являются серьезной проблемой на пути к успеху использования новых материалов в клинической практике , .Синтетические материалы, используемые для создания имплантатов, как правило, не являются антигенными и, следовательно, не индуцируют образование специфических антител, участвующих в адаптивном иммунном ответе. Однако молекулярная структура полимеров может значительно повлиять на функциональную активность фагоцитов (нейтрофилов, макрофагов, дендритных клеток), ответственных за реализацию врожденного иммунитета
, . Адаптивные иммунные реакции на имплантат сопряжены с развитием хронического воспаления с участием клеток иммунной системы, презентирующих антигены. Таким образом, врожденные и адаптивные иммунные реакции на имплантат могут перекрещиваться и зависеть от его материала .Настоящая работа посвящена изучению реакции регионарных лимфатических узлов в ответ на имплантацию гидрогеля р-НЕМА в костно-хрящевые дефекты дистальных эпиметафизов бедренной кости с целью выяснения биосовместимости синтетического полимера. Объектом исследования послужили результаты морфометрического анализа структурной организации и клеточного состава морфофункциональных зон лимфатических узлов в области лимфосбора. Такой подход является незаменимым в изучении реакции организма как единой биологической системы. Подколенные лимфатические узлы относятся к узлам первого порядка, по ареалу лимфосбора — соматическими.
2. Материалы и методы
2.1. Материалы исследования
Настоящая работа является логическим продолжением и опирается на материалы предварительного исследования, выполненного с целью оценки особенностей репаративного хондрогенеза и остеогенеза при имплантации p-HEMA в костно-хрящевые дефекты у кроликов
. Препараты лимфатических узлов для морфологического исследования были получены непосредственно после выведения животных из эксперимента. Эксперимент был выполнен на семи кроликах. В качестве референсных значений, использовали показатели, полученные при исследовании лимфоузлов трех интактных животных (интактная серия — ИС; количество исследованных лимфоузлов, n=6). Четырем кроликам создавали стандартные большие костно-хрящевые дефекты на пателлярной поверхности дистального эпиметафиза бедренной кости в области поверхности пателло-феморального сочленения. Дефекты имели форму цилиндра, диаметром 5 мм, высотой 5,5 мм. Два кролика с четырьмя дефектами, незамещенными имплантатами, составили контрольную серию (КС) исследования (n=4). Еще у двух животных дефекты были замещены имплантатами р-НЕМА — опытная серия (ОС) (n=4).Детали оперативного вмешательства, имплантации гидрогеля р-НЕМА, а также его физико-химические свойства подробно изложены нами ранее
. Кратко, были использованы половозрелые кролики самцы (возраст 5 месяцев, вес 2,8–3,5 кг) породы «Советская Шиншилла». Содержание, оперативные вмешательства и эвтаназия животных проводились в соответствии с требованиями и принципами биомедицинских исследований с участием позвоночных животных (European Convention, 1986; 1998) и были одобрены этическим комитетом Уральского государственного медицинского университета (протокол № 2 от 28 февраля 2020 года).Цилиндрические имплантаты р-НЕМА диаметром 5 мм, высотой 5,5 мм были изготовлены методом радикальной полимеризации в водном растворе мономера (гидроксиэтилметакрилата — HEMA) при 70 °С в присутствии сшивающего агента – N,N’-метилендиакриламида. Концентрации мономера и сшивающего агента обеспечили формирование сетчатой полимерной структуры, в которой мольное соотношение узлов сетки и звеньев в линейных фрагментах составляло 1:100.
Продолжительность эксперимента составляла 30 суток. В течение этого срока, гибели и гнойных осложнений у оперированных животных не наблюдалось.
2.2. Методы исследования
Материал для морфологического исследования (подколенные лимфатические узлы) отделяли от окружающей жировой клетчатки, оценивали размер, форму и окраску; фиксировали 48–72 часа в 10% нейтральном забуференном формалине (BioOptica, Италия). Для гистологической проводки использовали методику «Изопропанол — минеральное масло»
, образцы уплотняли парафином (Биовитрум, Россия).Срезы готовили на микротоме МЗП-01 «ТЕХНОМ» (Россия). Серии срезов лимфоузлов, толщиной 5 микрометров, проводили по длинной оси органа, на уровне ворот и полюсов. В качестве обзорной окраски использовали гематоксилин и эозин. Для выявления компонентов соединительной ткани срезы окрашивали по методу Ван-Гизона.
Для описательной морфологии использовали световой микроскоп Micros MS300 (Австрия). Оцифровку препаратов выполняли на сканирующем микроскопе 3DHISTECH PANNORAMIC Midi (Венгрия) с использованием программы Pannoramic Viewer (Венгрия).
Для изучения соотношения площадей структурных элементов лимфатических узлов и их клеточного состава применяли морфометрию и дифференцированный подсчет клеточных элементов в различных функциональных зонах. В каждой зоне подсчитывали 500 клеток. При подсчете численной плотности клеток площадь поля составляла 0,025 мм2.
2.3. Статистический анализ
Результаты представлялись в виде X±m, где Х — среднее арифметическое, m — ошибка среднего арифметического. При оценке различий между двумя независимыми выборками использовали параметрический критерий Стьюдента. Допустимым уровнем статистической значимости принимали p≤0,05. Статистический анализ данных был выполнен с использованием лицензионного программного обеспечения «Statistica 6.0».
3. Результаты и обсуждение
Анализ структурной организации и клеточного состава анатомо-функциональных зон лимфатических узлов способен дать объективную оценку реакции лимфатической системы на дестабилизирующие факторы. Подколенные лимфатические узлы, животных всех исследуемых серий, макроскопически имели овально-бобовидную форму, с разной степенью выраженности рельефа поверхности, от гладких и бугристых (преимущественно ИС, КС) до сильно бугристых (преимущественно ОС). Окраска органов имела неоднородность, соответственно, от бежевого и коричневого до темно-коричневого. Это обусловлено количеством капилляров и степенью наполнения структур органа кровью, а также количеством и размером лимфоидных узелков в корковом веществе.
Гистологическая структура регионарных лимфатических узлов была сохранена, клеточная атипия отсутствовала у животных всех исследуемых серий. Примеры визуализации лимфоузлов интактной и двух экспериментальных серий приведены на рис. 1.
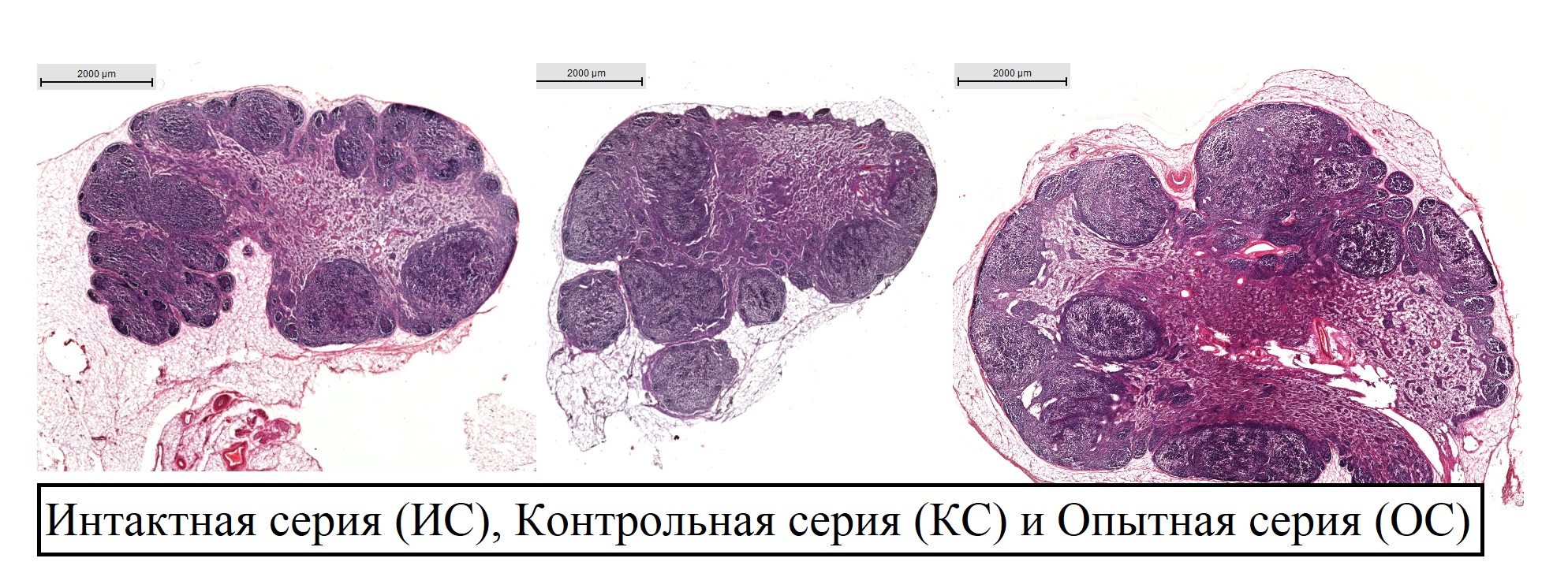
Рисунок 1 - Подколенные лимфатические узлы кроликов
Примечание: световая микроскопия; окраска гематоксилином и эозином; микрометрическая линейка гистологических сканов откалибрована на 2000 мкм
Таблица 1 - Микроанатомическая организация подколенных лимфатических узлов кроликов
Серия | Площадь лимфатического узла, мм2 | Площадь коркового вещества, мм2 | Площадь паракортикальной области, мм2 | Площадь мозгового вещества, мм2 | Площадь стромы, мм2 |
ИC n=6 | 27,7 ± 5,1 | 9,9 ± 1,1 | 6,8 ± 2,0 | 8,4 ± 3,1 | 2,6 ± 0,9 |
КС n=4 | 25,2 ± 1,5 | 9,9 ± 0,4 | 5,4 ± 1,5 | 6,4 ± 1,7 | 3,5 ± 0,4 |
ОС n=4 | 36,4 ± 0,6 * | 16,3 ± 2,8 | 7,8 ± 2,7 | 9,6 ± 0,5 | 2,7 ± 0,7 |
Примечание: звездочкой (*) отмечены статистически достоверные отличия ОС по сравнению с КС, p < 0,05
Площадь лимфатических узлов была примерно одинаковой в ИС и КС. В ОС этот показатель был значимо увеличен, прежде всего, за счет сегментарного расширения коркового вещества. Капсула лимфатических узлов образована плотной соединительной тканью, напряжена, пучки коллагеновых волокон расположены параллельно поверхности. Толщина капсулы в ОС оказалась меньше, чем в ИС и КС примерно в 2,0 и 2,7 раза, соответственно. Это может быть обусловлено растяжением капсулы за счет увеличения объёма лимфоузла. Потенциально, возможно вовлечение более тонких механизмов, например, прямое ингибиторное влияние провоспалительного интерлейкина IL-1β на гладкие миоциты капсулы лимфатических узлов вплоть до полного прекращения спонтанной фазной их активности при высоких дозах IL-1β
, .У всех прооперированных животных были выявлены признаки небольшого увеличения интенсивности циркуляции лимфы (небольшое расширение краевых синусов). Площадь коркового вещества (включающего узелковую и диффузную части) в ИС и КС не различались, в ОС данный показатель имел тенденцию к увеличению (p > 0,05).
В строении лимфоидных узелков животных экспериментальных серий (КС и ОС) по сравнению с ИС были выявлены некоторые отличия. Количество вторичных лимфоидных узелков, относительно их общего числа, во всех сериях не различалось и составляло ~70%. Вместе с тем, часть узелков в КС и ОС была расширена, формируя бугристый рельеф поверхности лимфатического узла. Морфологически, граница между внутриузелковыми структурами в экспериментальных сериях имела четко дифференцированную границу. Герминативные центры были выражены, в ОС с отчетливо выявляемой мантийной зоной. Было отмечено увеличение плотности клеток герминативных центров и абсолютного количества центробластов (лимфобластов) и центроцитов (пролимфоцитов) в КС (лимфобласты 192,3±12,1/0,025 мм2, пролимфоциты 158,4±14/0,025 мм2) и ОС (лимфобласты 160,3±36,1/0,025 мм2, пролимфоциты 143,8±31,1/0,025 мм2) по сравнению с ИС (лимфобласты 83,4±12,9/0,025 мм2, пролимфоциты 73,0±6,1/0,025 мм2). При этом в группе КС по отношению ИС установленные различия были статистически значимыми (p<0,05).
Таким образом, были установлены признаки фолликулярной гиперплазии, которая ассоциируется преимущественно с активацией В-клеточного компартмента
. Характер и сроки развития выявленных изменений в узелках коркового вещества соответствуют описанным в литературе изменениям в регионарных лимфоузлах при травме большеберцовой кости. Системный ответ организма, включающий и изменения в регионарных лимфоузлах (лимфаденопатию, реакцию центров размножения, активацию В-лимфоцитов, зависимую от Т-фолликулярных хелперов — Tfh) характеризуется как посттравматический «адаптивный аутоиммунный ответ» , .У животных экспериментальных серий ОС и КС в диффузной части коркового вещества, относящейся к тимус-зависимой зоне, было выявлено значительное увеличение количества пролимфоцитов по отношению к ИС: 12,6±3,9/0,025 мм2, 13,1±1,0/0,025 мм2 (p <0,05) и 5,0±0,6/0,025 мм2, соответственно. В ОС и КС в сравнении с ИС наблюдалась тенденция к увеличению количества макрофагов: 10,6±4,3/0,025 мм2, 11,2±3,1/0,025 мм2 и 6,2±1,3/0,025 мм2, соответственно. Кроме того, у кроликов экспериментальных серий были выявлены плазмоциты (0,6±0,6/0,025 мм2 в ОС и 4,8±1,5/0,025 мм2 в КС) и эозинофилы (2,5±0,8/0,025 мм2 в ОС и 11,3±3,5/0,025 мм2 в КС), чего не наблюдалось у животных интактной серии. Рисунок 2 иллюстрирует пример эозинофилии коркового вещества лимфатического узла в КС.
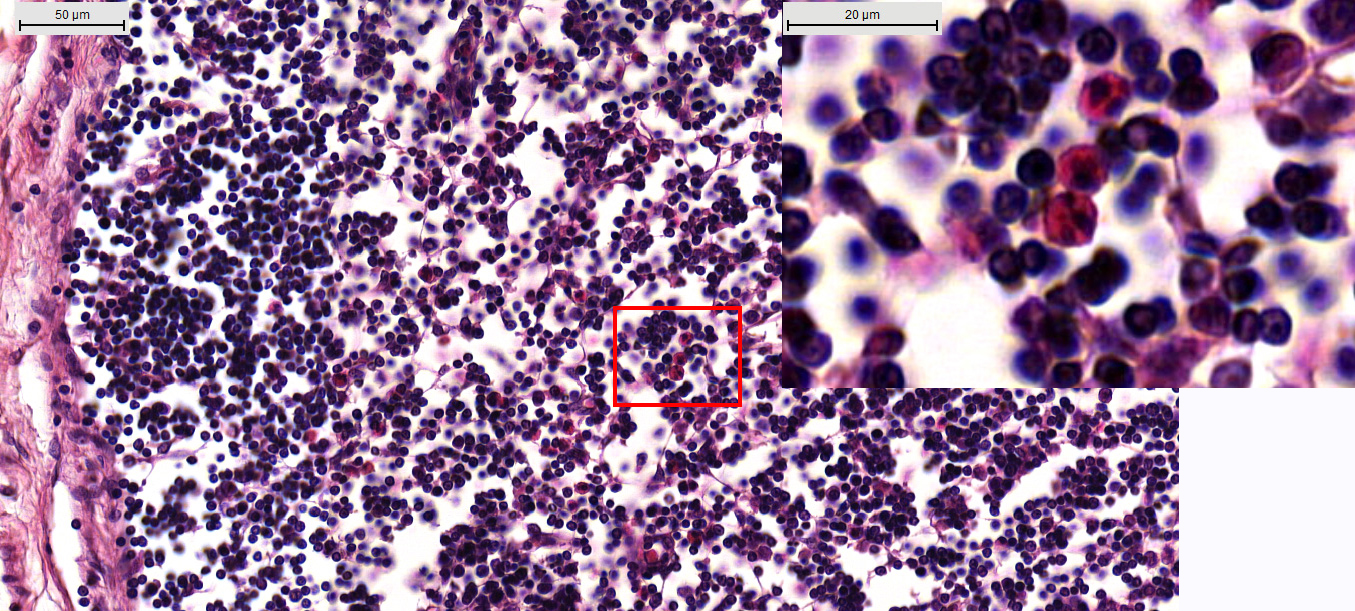
Рисунок 2 - Эозинофилия коркового вещества лимфатического узла (контрольная серия)
Примечание: на вставке визуализируется скопление эозинофилов. Окраска гематоксилином и эозином. Микрометрическая линейка откалибрована на 50 мкм (вставка – 20 мкм)
Тяжи мозгового вещества были хорошо выражены. Количество молодых лимфоидных элементов (лимфобласты и пролимфоциты) в мозговом веществе имело тенденцию к увеличению, однако статистически значимых отличий ни в одной из групп нами не выявлено. По аналогии с другими функциональными зонами было отмечено появление эозинофилов: 4,2±1,4/0,025 мм2 в группе КС и 5,0±2,2/0,025 мм2 в группе ОС, тогда как в группе ИС эозинофилы не были обнаружены в срезах ни в одной из зон лимфатических узлов.
Во всех морфофункциональных зонах лимфоузла обращает на себя внимание увеличение количества эозинофилов, важнейших участников аллергического воспаления. Вместе с тем в настоящее время эозинофилы рассматривают в качестве клеток, осуществляющих иммунорегуляторные реакции, вызывающие как развитие, так и ограничение иммунного ответа
.Таким образом, выявленные морфологические изменения и количественные различия клеточного состава в герминативных центрах, диффузной части коркового вещества, паракортикальной области, а также в мозговом веществе в экспериментальных сериях имели одинаковую направленность и незначительно отличались своей выраженностью. Следовательно, данные изменения не обусловлены имплантацией гидрогеля р-НЕМА в костно-хрящевые дефекты. Вероятно, установленные факты связаны с высвобождением молекулярных паттернов, ассоциируемых с повреждением (damageassociated molecular patterns — DAMPs) тканей и клеточного стресса во время операции и в послеоперационном периоде, которые скрыты от распознавания клетками иммунной системы в физиологических условиях
. DAMPs являются ключевыми молекулами, запускающими стерильное воспаление, участвуют в формировании реакций адаптивного иммунитета и аутоиммунных процессов .4. Заключение
В рамках экспериментальной модели на животных по оценке биосовместимости синтетического гидрогеля р-НЕМА, имплантированного в костно-хрящевые дефекты на бедренной кости, был установлен ряд закономерностей. А именно, у всех прооперированных кроликах (КС и ОС) по отношению к ИС в регионарных подколенных лимфатических узлах имели место признаки увеличения интенсивности циркуляции лимфы (небольшое расширение краевых синусов), активации лимфопоэза (увеличение количества молодых лимфоидных клеток, преимущественно в корковом веществе и паракортикальной области), умеренного повышения активности В-зависимых зон (расширение части лимфоидных узелков и их герминативных центров, возрастание плотности клеток фолликулов и «омоложение» их клеточного состава), увеличения количества эозинофилов и плазмоцитов во всех морфофункциональных зонах. Наиболее значимые изменения по сравнению с интактными животными выявлены преимущественно в корковом веществе. Установленные факты указывают на преобладание пролиферативных процессов над деструктивными в послеоперационный период.
Вместе с тем различия между КС и ОС не были значимыми, то есть реакции в регионарных лимфатических узлах непосредственно на внедрение имплантата из p-HEMA через 30 суток после операции не было выявлено. Предположено, что выявленные признаки реактивного изменения в лимфоузлах при имплантации р-НЕМА, вероятно, являются морфологическим субстратом адаптивного иммунного ответа на оперативное вмешательство и связаны с формированием костно-хрящевого дефекта.
Хорошая биосовместимость р-НЕМА на системном уровне открывает возможности использования этого материала для нужд биомедицинских технологий. В частности, нами рассматривается возможность аппликации микросфер р-НЕМА в качестве платформы для дендритных клеток, предварительно загруженных магнитными наночастицами оксида железа
. Предполагается, что адресная доставка таких композитов в лимфатические узлы с помощью внешнего магнитного поля позволит увеличить эффективность иммунотерапии.