METHODOLOGY FOR QUANTITATIVE DETERMINATION OF FLAVONOIDS IN PEPPERMINT
METHODOLOGY FOR QUANTITATIVE DETERMINATION OF FLAVONOIDS IN PEPPERMINT
Abstract
The aim of this work was a qualitative and quantitative study of flavonoid compounds of peppermint. Plant material was air-shadow dried. Dried peppermint (Mentha piperita, Lamiaceae) was used as an object of study. Four samples of mint raw materials of different origin were examined: №1 (Azure), №2 (Udaychanka), №3 (Zagrava), №4 (Bergamotnaya). Cultivated in the Penza region. The purpose of this work is to determine the content of the sum of flavonoids in peppermint by spectrophotometry. The quantitative estimation of the sum of flavonoids in peppermint by differential spectrophotometry was carried out. Thin layer chromatography (TLC) was used to confirm the presence of flavonoids in peppermint herb, Rf adsorption zone (retention factor) of about 0.77 at the standard luteolin sample level and Rf adsorption zone (retention factor) of about 0.64 at the standard sample (CO) cinaroside solution level were detected. The method of differential spectrophotometry confirmed the presence of flavonoids in peppermint extracts, identifying the analytical maximums of the studied compounds at 387±2 nm. The optimum conditions of flavonoid extraction from the plant raw material were determined (the extractant - 70 % ethyl alcohol; the ratio "raw material - extractant" - 1:50; extraction time - 60 minutes; crushing degree of raw material - 1.0 mm). It was found that the average error in determining the content of flavonoids in peppermint with a confidence probability of 95% is ± 0.44%. It was revealed that the content of flavonoids in peppermint raw material varies in the range of 1,50-2,07%.
1. Введение
В настоящее время происходит активное развитие фармацевтической промышленности. Разрабатываются новые конкурентоспособные импортозамещающие лекарственные препараты, в том числе растительного происхождения. Лекарственные растения содержат большое количество биологически активных соединений, так как эфирные масла, флавоноиды, дубильные вещества, полисахариды и т.д., проявляют различные фармакологические эффекты, что определяет их применение в фармацевтической промышленности, медицине, косметологии [1], [2].
Структурное разнообразие флавоноидов определяют фармакологические эффекты. Как известно, флавоноиды проявляют антиоксидантное, ангиопротекторное, гепатопротекторное, желчегонное и другие свойства. За последнее несколько лет увеличилось число фармакопейных растений, содержащих флавоноиды [3], [4], [5]. Актуален поиск и исследование лекарственных растений, как перспективных источников флавоноидов. Мята - лекарственное растение, богатое эфирными маслами, помимо эфирных масел листья мяты содержат флавоноиды в количестве от 1,2 до 1,8%. В последнее время появились новые сорта мяты перечной, такие как мята Ажурная, Удайчанка, Заграва, Бергамотная, которые можно рассматривать не только как источник эфирного масла, но и как источник флавоноидов [6], [9], [10], [12].
В настоящее время для идентификации и количественного определения флавоноидов в лекарственных растениях используют спектрофотометрические методы [13], [14], [15]. Они быстры, удобны и не требуют сложного оборудования.
Целью исследования: качественное и количественное изучение флавоноидных соединений травы мяты перечной.
2. Методы и принципы исследования
В качестве объекта исследования использовали 4 образца высушенной травы мяты перечной, выращенной в условиях Пензенской области.
Извлечение флавоноидов из травы мяты перечной проводили путем однократной экстракции спиртом этиловым различной концентрацией при нагревании на кипящей водяной бане в течение 60 мин. Регистрировали спектры на спектрофотометре СФ-101 в кювете с толщиной слоя 10 мм (растворитель спирт этиловый).
Присутствие, в водно-спиртовых извлечениях из сырья, флавоноидов доказывали методом тонкослойной хроматографии и спектрофотометрии [1], [3], [19]. На линию старта хроматографической пластинки «Сорбфил-ПТСХ-АФ-Ф-УФ», предварительно активированной в сушильном шкафу при температуре 100-105оС, микропипеткой наносили 0,02 мкл водно-спиртового извлечения из травы мяты. В качестве веществ-свидетелей на ту же пластинку наносили спиртовой раствор СО гиперозида, спиртовый раствор рутина, спиртовой раствор СО цинарозида, спиртовой раствор СО лютеолина. Качественный анализ флавоноидов проводили тонкослойной хроматографией восходящим способом в системе хлороформ – этиловый спирт 70 % – вода (26:16:3).
В полученном извлечении оценивали содержание суммы флавоноидов, в работе использовали метод дифференциальной спектрофотометрии в пересчете на цинарозид [1], [3], [13]. В колбу помещали около 1,0 г (точная навеска) измельченного сырья, использовалась колба со шлифом вместимостью 100 мл, далее в колбу прибавляли 50 мл спирта в некоторых концентрациях (40%, 70% и 95%) и взвешивали с погрешностью ± 0,01 г. Полученное в ходе опыта извлечение фильтровали через бумажный фильтр, по методике фильтр смачивали тем же спиртом, что использовали для экстрагирования, отбрасывая первые 10 мл фильтрата (раствор А). После фильтрования, через 30 минут после приготовления, измеряли оптическую плотность раствора. 1 мл раствора А помещали в мерную колбу вместимостью 25 мл, прибавляли 3 мл алюминия хлорида 3% в спирте 95% и через 10 мин 2 капли разведенной кислоты уксусной. После реакции с алюминия хлоридом, объем полученного раствора доводили такой же концентрацией этилового спирта (40%, 70% 95%) до метки, перемешивали и оставляли на 10 минут (раствор Б). Для определения оптической плотности, полученный раствор Б помещали в кварцевые кюветы с толщиной слоя 10 мм и измеряли полученный раствор на спектрофотометре при длине волны 385 нм, в качестве раствора сравнения использовали раствор полученный в нашей методике. Содержание суммы флавоноидов в пересчете на цинарозид в процентах (Х) вычисляли по формуле:
где: A –оптическая плотность раствора;
361 –удельный показатель поглощения цинарозида с алюминия хлоридом при длине волны 385 нм;
а – навеска сырья, г;
W –влажность сырья, %.
3. Основные результаты
Для подтверждения присутствия флавоноидов в изучаемом сырье использовали ТСХ-анализ (тонкослойная хроматография). Полученные хроматограммы просматривали при дневном свете, в УФ-свете детектировали при λ=366 нм и λ=254 нм, а также обрабатывали щелочным раствором ДСК и фосфорно-молибденовой кислоты (рис.2) [1], [3].
Результаты исследования водно-спиртового извлечения методом ТСХ (тонкослойная хроматография) свидетельствуют о том, что доминирующим флавоноидом травы мяты является цинарозид. На хроматограмме видно, что в извлечении из травы мяты обнаруживается пятно Rf (фактор удерживания) около 0,77 на уровне стандартного образца (СО) лютеолина, а также пятно с Rf (фактор удерживания) около 0,64 на уровне раствора стандартного образца (СО) цинарозида (рис.1). Таким образом, рациональным подходом при проведении качественного анализа травы мяты и ее препаратов методом тонкослойной хроматографии является использование в качестве вещества-стандарта цинарозида с последующим расчетом значений Rf.
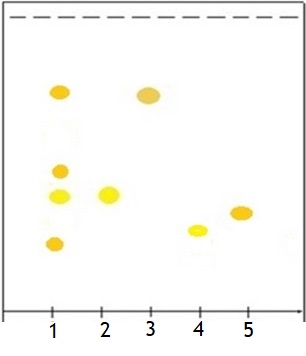
Рисунок 1 - Схема хроматограммы извлечения из травы мяты. Система хлороформ – этиловый спирт 70 % – вода (26:16:3):
1 – извлечение из травы мяты; 2- СО цинарозида; 3 - СО лютеолина; 4 - рутин; 5 - СО гиперозида
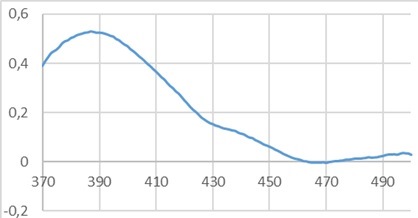
Рисунок 3 - УФ-спектр извлечения из мяты травы (1:1250) в присутствии AlCl3
Таблица 1 - Влияние различных факторов на полноту извлечения флавоноидов
Экстрагент | Соотношение «сырье – экстрагент» | Степень измельченности, мм | Время экстракции, мин | Содержание суммы флавоноидов в пересчете на цинарозид |
Влияние концентрации спирта | ||||
Спирт 40% | 1:50 | 2 мм | 90 мин | 1,51 ±0,04 |
Спирт 70% | 1:50 | 2 мм | 90 мин | 1,56 ±0,03 |
Спирт 95% | 1:50 | 2 мм | 90 мин | 1,37 ±0,03 |
Влияние соотношения «сырье – экстрагент» | ||||
Спирт 70 % | 1:25 | 2 мм | 90 мин | 1,54 ± 0,03 |
Спирт 70 % | 1:50 | 2 мм | 90 мин | 1,56 ± 0,04 |
Спирт 70 % | 1:100 | 2 мм | 90 мин | 1,52 ± 0,05 |
Влияние степени измельченности | ||||
Спирт 70 % | 1:50 | 1 мм | 90 мин | 1,60 ± 0,03 |
Спирт 70 % | 1:50 | 2 мм | 90 мин | 1,58 ± 0,04 |
Спирт 70 % | 1:50 | 3 мм | 90 мин | 1,53 ± 0,02 |
Влияние времени экстрагирования | ||||
Спирт 70% | 1:50 | 1 мм | 30 мин | 1,48±0,06 |
Спирт 70 % | 1:50 | 1 мм | 60 мин | 1,61 ± 0,03 |
Спирт 70 % | 1:50 | 1 мм | 90 мин | 1,59 ± 0,05 |
С целью разработки проекта методики количественного определения суммы флавоноидов мы определили оптимальные условия экстракции при которых осуществляется наибольший выход действующих веществ:
- экстрагент – спирт этиловый 70%;
- соотношение «сырье – экстрагент» - 1:50;
- время экстракции – 60 минут;
- степень измельченности сырья – 1 мм.
В ходе проделанного исследования определили, что степень измельчения от 1 до 3 мм не оказывает влияния на выход веществ при экстрагировании. В качестве оптимальной нами выбрана степень измельчения 1 мм.
Следует отметить, что положение максимумов не меняется при использовании разных концентраций этанола и травы мяты различного происхождения. Таким образом, при реакции с хлоридом алюминия флавоноиды мяты образуют комплексное соединение с максимумом поглощения 385 нм.
В результате использования данной методики определения флавоноидов были проанализированы образцы мяты различного региона произрастания. Установлено, что содержание флавоноидов в траве мяты (по СО цинарозида) варьирует от 1,50 до 2,07 % (табл.2).
Таблица 2 - Содержание суммы фенилпропаноидов в траве мяты
№ п\п | Сорт мяты | Этанол, % | Содержание флавоноидов, % (по удельному показателю цинарозида при λ=385 нм) |
1 | Ажурная | 70 | 1,61± 0,03 |
2 | Удайчанка | 70 | 1,27± 0,04 |
3 | Заграва | 70 | 1,50± 0,04 |
4 | Бергамотная | 70 | 2,07± 0,05 |
Результаты статистической обработки полученных результатов исследования показывают, что ошибка единичного определения с доверительной вероятностью 95% составляет не более ± 1,67 % при определении суммы флавоноидов методом дифференциальной спектрофотометрии в пересчете на цинарозид (табл.3).
Таблица 3 - Метрологические характеристики методики количественного определения суммы флавоноидов в траве мяты
ЛРС | N | F | Х | S2 | S | P, % | t (P, f) | ∆Х | E, % |
Трава мяты (сорт Бергамотная) | 5 | 4 | 2,07 | 0,00077 | 0,027749 | 95 | 2,776 | ±0,099 | ±1,67 |
4. Заключение
Установлены оптимальные условия методики экстракции травы мяты:
- экстрагент – 70% спирт этиловый;
- соотношение «сырье и экстрагент» – 1:50;
- степень измельченности сырья – 1 мм;
- время экстракции – 60 мин.
Выявлено, что содержание флавоноидов в сырье мяты варьирует в интервале 1,50-2,07%. Полученные результаты позволяют поставить траву мяты, по содержанию флавоноидов, в один ряд с известными лекарственными растениями – источниками флавоноидов (Зверобой продырявленный, бессмертник песчаный, эрва шерстистая). Целесообразными являются дальнейшие исследования по изучению травы мяты.
