Solid Electrolytes of Potassium and Sodium Sulfate Solvatocomplexes in Porous Layers of Amorphous Silicon Dioxide and Aminoacetate Derivatives of PVC on Cellulose Fabric Fibers
Solid Electrolytes of Potassium and Sodium Sulfate Solvatocomplexes in Porous Layers of Amorphous Silicon Dioxide and Aminoacetate Derivatives of PVC on Cellulose Fabric Fibers
Abstract
Two lines of solid electrolytes were synthesized which consist of a donor solvent in the form of a porous layer of glycinate PVC derivatives grafted to aerosil microparticles and to cellulose fabric fibers, and aqua complexes of sodium sulfate dissolved in it in the first case and potassium sulfate in the second. The solvent sorption amount and solubility of sodium and potassium sulfate increase with increasing mass fraction of aerosil. For each solvent, the content of potassium sulfate was found to be greater than that of sodium sulfate. The dependence of current on the voltage in the circuit Pt (+) - K2SO4 solution - solid electrolyte bridge - K2SO4 Pt (-) solution and the internal resistance of the studied solutions were studied. The length of the bridge is 20 cm, the width is 10 cm. In the investigated voltage ranges (up to 25 V) the resulting electrolytes are linear ionic conductors. It was found that the limiting step of charge movement in the circuit is their transfer through the electrolyte. For each solvent with potassium sulfate, the voltage of the beginning of ion motion was found to be lower and the speed of ion motion higher than that of the electrolytes with sodium sulfate.
1. Введение
Сформированные на волокнах целлюлозной ткани пористые слои из микрочастиц аморфного диоксида кремния, к развитой поверхности которых привиты аминоацетатные производные ПВХ, и сульфата натрия, сорбированного из водного раствора, представляют собой твердые электролиты [1], [2]. Их электропроводность и поляризуемость зависят от состава раствора и растворителя и возрастают пропорционально массовой доле оксида кремния в растворителе и содержанию соли [2]. Аналогом Na2SO4является K2SO4. В этом аспекте представлял интерес проследить влияние природы катиона на электропроводность твердых растворов 2:1 электролитов в донорном растворителе [2]. Интересующие нас данные в литературе отсутствуют.
Цель исследования - синтезировать и измерить электропроводность твердых электролитов сульфатов калия и сульфата натрия, сорбированных из водных растворов, в растворителе с разным содержанием аэросила.
2. Материалы и методы исследования
Материалы и реактивы: тетрагидрофуран, бензиловый спирт «ч», глицин «ч», гидроокись калия «хч», натрий сернокислой безводный «чда». калий сернокислый, смола ПВХ, марка SG-7, содержание ПВХ 88% пластификатор – эфиры терефталевой кислоты – около 10 %, хлопковая марля, медицинская, отмытая в ТГФ, содержание целлюлозы 97,0-97,5%, плотность 1,45 г/см3, аморфный оксид кремния (аэросил марки А300).
Были приготовлены: 3,33 моль/л раствор глицината калия, 1,5 моль/л сернокислого натрия и 0,6 моль/л сернокислого калия.
Методы исследования - химический анализ, измерение сопротивления (мультиметр Robiton Master DMM-850, погрешность измерения ± 0,8%), вольт-амперометрия по методике [1], [2], погрешность измерения тока при заданном напряжении 0.5 мкА.
3. Основные результаты
По методике [2] были синтезированы три растворителя ГАI, ГАII и ГАIII: масса слоя на волокнах ткани и массовая доля оксида кремния в слое указаны в [2].
Электролиты синтезированы по методике [1], [2] путем выдержки образцов в растворах 1,5 моль/л сульфата натрия или 0,6 моль/л сульфата калия, с последующим удалением окклюдированной жидкости с помощью фильтровальной бумаги, сушкой до постоянной массы при 110-115оС и выдержкой на воздухе со 100 % влажностью. Электролиты сульфата натрия обозначены как ГАIН, ГАIIН и ГАIIIН, а сульфата калия - как ГАIК, ГАIIК и ГАIIIК. Содержание сульфатов (Ссул) и воды (Сaq) в ГАIК – 3.11 и 2.04 ммоль/г, в ГАIIК – 5.22 и 3.90 ммоль/г, а в ГАIIIК – 6.84 и 5.85 ммоль/г. Соответствующие показатели для электролитов с сульфатом натрия приведены в [2].
Во всех случаях Ссул и Сaq возрастает с увеличением массовой доли оксида кремния. Для каждого растворителя содержание сульфата натрия меньше, чем сульфата калия.
Измерение электропроводности электролитов, как электрохимических мостиков проводили по методике [2]. Была сформирована электрохимическая ячейка из двух стаканов с 1.5 М раствором сульфата натрия или с 0.6 М раствором сульфата калия с платиновыми электродами, соединенными с источником постоянного тока и мостиком из твердого электролита (длина 20 см, ширина 10 см), концы которого опущены в растворы на 0.3 см. Задавали напряжение U и измеряли ток J в цепи. Зависимости J от U приведены на рисунке 1. Предварительно были измерены внутренние сопротивления растворов между электродом и концом мостиков. Сопротивление раствора сульфата натрия 2,9 кОм, а раствора сульфата калия 3.6 кОм. Сопротивление мостиков ГАIН -5 кОм, ГАIК – 9 кОм, ГАIIН – 9.8 кОм, ГАIIК – 12 Ком, ГАIIIН – 10.6 кОм, а ГАIIIК – 15 кОм.
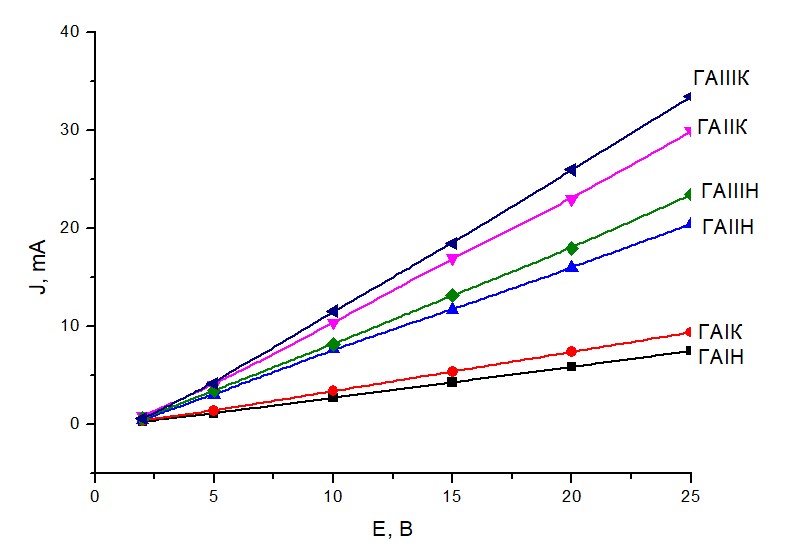
Рисунок 1 - Электропроводность полученных электролитов.
В изученном диапазоне напряжений (до 25 В) величины J/U практически зависит от U, это означает, что электролиты как электрохимические мостики ведут себя как линейные проводники. Поскольку внутреннее сопротивление растворов меньше, чем у электролитов, то лимитирующей стадией движения зарядов в цепи является их перенос через электролит. В таком случае величина тока в цепи соответствует скорости переноса зарядов через электролит и равна Vпер = J/F, где, F – число Фарадея. Установлено, что зависимость V от U отвечает уравнению V= kск(U-U0), где U0 – напряжение, при котором начинается перенос зарядов в электролите, kск - константа скорости переноса зарядов. Их значения приведены в таблице 1.
Таблица 1 - Напряжение начала движения зарядов в цепи и константа скорости переноса заряда в твердом электролите
Электролит | U0, B | Kск*106, г-экв/B*сек |
ГАIH | 0,12 | 1,86 |
ГАIIH | 0,21 | 2,90 |
ГАIIIH | 0,28 | 3,83 |
ГАIК | 0,1 | 3,94 |
ГАIIК | 0,2 | 8,08 |
ГАIIIК | 0,22 | 12,4 |
Видно, что для каждого растворителя напряжение начала движения зарядов в цепи меньше у сульфата калия, а константа скорости переноса заряда в электролите с сульфатом калия выше, чем с сульфатом натрия. С увеличением доли оксида кремния одновременно возрастают как U0, так и kск.
4. Заключение
Влияние природы катиона щелочного металла на состав и электропроводность электролитов можно объяснить следующим образом. В стенках пор производных ПВХ имеются >N-СН2-СОО- * М+ группы [1], [2], производные через O=Si(-O-)-О- СН< группы привиты к развитой поверхность оксида кремния, в стенах пор которых имеются O=Si(O-)2 и O=Si(-O-)-ОН группы [3]. Группы адекватны молекулам жидких неводных донорных и амфипротонных растворителей и ионных жидкостей [4], [5], [6], [7]. При сорбции сульфатов в порах образуются многоядерные сольватокомплексы общей формулы {[M(H2O)jL]2SO4}n где M+= Na+ или K+, L - группировки донорных атомов, построенные как ассоциаты контактных и сольваторазделенных ионных структур [8], [9], [10]. Вокруг Na+ и K+ могут находиться только донорные атомы азота аминогрупп и кислорода из SO42-, -СОО-, O=Si(O-)2, O=Si(-O-)-ОН и O=Si(-O-)-О- СН< групп, причем в оболочку Na+ может входить до 6 -, а и К+ - до 8 атомов донорных атомов. Согласно [11], в кристаллогидратах каждый SO42- как мостик связан с двумя катионами. Судя по величинам отношения Сaq/2Ссул, равного среднему числу атомов кислорода из молекул воды, очевидно, что молекул воды недостаточно для насыщения первой оболочки. Катионы, связанные с группировками растворителя, дислоцированы у стенок пор. С увеличением массовой доли оксида кремния увеличивается содержание O=Si(O-)2, O=Si(-O-)-ОН. В каждом растворителе Сaq/2Ссул для Na+ больше, чем К+. Это указывает на то, что одни и те же группировки связывают большее К+, чем Na+. Молекулы воды и амфипртонные группы одновременно связаны с катионом и с SO42- с образованием развитой системы водородной связи. При подключении источника тока, на платиновом катоде происходит реакция 2Н2О +2е =Н2 +2ОН-, а на аноде - реакция 2Н2О -4е =О2 + 4Н+. В таких условиях движение Na+ или K+ от анода к катоду, а SO42- от катода к аноду исключено. Подвижность Н+ больше ОН- [8]. Перенос Н+ из раствора с анодом в раствор с катодом происходит через систему водородных связей по эстафетному механизму. Как отмечалось выше kск растет с увеличением доли оксида кремния. Это позволяет предположить, что в электролите имеются два канала проводимости – один с участием комплексов, сольватированных группами полимера, а другой - группами оксида кремния. Подвижность Н+ в первом ниже, чем во втором. В первом систему водородных связей формируют молекулы воды, а во втором - молекулы воды и Si-О-Н группы. Значение kск в электролите с сульфатом калия выше, чем с сульфатом натрия. Ионный радиус K+ больше, чем Na+. Это позволяет предположить, что лабильность водородных связей в комплексах калия выше, чем натрия.
