THE SYNTHESIS OF NEW ORGANOSELENIUM COMPOUNDS BASED ON CATECHOL AND SELENIUM
Куркутов Е.О.
Кандидат химических наук,
Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект №16-33-00627).
СИНТЕЗ НОВЫХ СЕЛЕНОРГАНИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ ПИРОКАТЕХИНА И СЕЛЕНА
Аннотация
Разработана удобная методика получения 2-(аллилокси)фенола из пирокатехина и аллилбромида, позволяющая получить индивидуальный продукт с высокой чистотой. Изучена реакция дибромида селена с 2-(аллилокси)фенолом, приводящая к образованию линейного продукта присоединения по правилу Марковникова: бис[2-бром-3-(2-гидроксифенокси)пропил]селенида с выходом 97%. При действии основания (K2CO3) на это соединение образуется ряд продуктов, в том числе целевой ди(2,3-дигидро-1,4-бензодиоксин-2-илметил)селенид - результат внутримолекулярного замещения с образованием двух 2,3-дигидро-1,4-бензодиоксиновых циклов. Основным продуктом реакции является 2-(аллилокси)фенол, образующийся в результате элиминирования дибромида селена из бис[2-бром-3-(2-гидроксифенокси)пропил]селенида.
Ключевые слова: дибромид селена, 2-(аллилокси)фенол, пирокатехин, электрофильное присоединение, реакция селеноциклофункционализации.
Kurkutov E.O.
PhD in Chemistry,
E. Favorsky Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences
THE SYNTHESIS OF NEW ORGANOSELENIUM COMPOUNDS BASED ON CATECHOL AND SELENIUM
Abstract
Convenient method for preparation of 2-(allyloxy)phenol from catechol and allylbromide permitting to obtain the product in high purity has been developed. The reaction of selenium dibromide with 2-(allyloxy)phenol leading to the formation of linear Markovnikov product, bis[2-bromo-3-(2-hydroxyphenoxy)propyl]selenide in 97% yield has been studied. The action of a base (K2CO3) on this compound led to a number of products including the target compound bis(2,3-dihydro-1,4-benzodioxin-2-ylmethyl)selenide - the result of intramolecular substitution with the formation of two 2,3-dihydro-1,4-benzodioxine cycles. The major product is 2-(allyloxy)phenol as a result of elimination of selenium dibromide from bis[2-bromo-3-(2-hydroxyphenoxy)propyl]selenide.
Keywords: selenium dibromide, 2-(allyloxy)phenol, catechol, electrophilic addition, selenocyclofunctionalization reaction.
Введение
Дихлорид и дибромид селена - новые электрофильные реагенты органического синтеза, которые интенсивно изучаются в последнее время. Несмотря на то, что дихлорид и дибромид селена в растворах медленно диспропорционируют, реакции со свежеприготовленными дигалогенидами селена протекают хемоселективно, приводя к селеноорганическим соединениям с высоким выходом. Реакции дигалогенидов селена с алкенам приводят к образованию гетероциклических соединений и симметричных селенидов [1]. Хорошо известна и активно применяется в органическом синтезе реакция селеноциклофункционализации алкенов [2], заключающаяся в присоединении электрофильного реагента селена к алкену, содержащему нуклеофильную группу и последующему внутримолекулярному замещению с образованием цикла. Однако, большинство этих реагентов содержат арильную группу при атоме селена (PhSeCl, PhSeBr) и могут присоединять только одну молекулу алкена.
Мы впервые использовали дихлорид и дибромид селена в реакциях селеноциклофункционализации с алкенолами (пент-4-ен-1-олом и гекс-5-ен-1-олом) и 2-аллилфенолом, в результате которых нами получены с высокими выходами симметричные селениды, содержащие в своем составе два пяти- или шестичленных гетероцикла с атомом кислорода [3-5]. Установлено, что сначала происходит присоединение дибромида селена к двум молекулам алкена с образованием бисаддукта по правилу Марковникова, а затем идет внутримолекулярная циклизация, которая протекает быстрее и селективнее в присутствии таких оснований, как NaHCO3, Na2CO3, K2CO3 [4] (рис 1.).
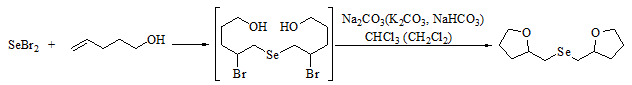
Рис. 1 - Схема образования бис(тетрагидрофуран-2-илметил)селенида
Однако, до настоящего времени в реакциях селеноциклофункционализации не использовались фенолы, содержащие аллилоксигруппу и способные привести к новым соединениям, содержащим 2,3-дигидро-1,4-бензодиоксиновый гетероцикл с двумя атомами кислорода [2]. Сведения о реакции электрофильных селенсодержащих реагентов с 2-(аллилокси)фенолом в литературе отсутствуют.
Материалы и методы исследования
Дибромид селена синтезирован из элементного селена и брома [1-4].
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400.13, и 100.61 МГц, соответственно) в CCl4, внутренний стандарт – ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Синтез 2-аллилоксифенола (1) и 1,2-бис(аллилокси)бензола (2). К раствору 11 г пирокатехина в 100 мл диметилсульфоксида добавили 6.6 г KOH и перемешивали при нагревании 70 οС в течение 1 ч до полного растворения KOH. После охлаждения до комнатной температуры добавили 16 г аллилбромида в течение 1 ч и перемешивали 3 суток при комнатной температуре. Смесь разбавили водой (150 мл), экстрагировали гексаном (2 раза по 100 мл), и этилацетатом (3 раза по 50 мл). Экстракт этилацетата промывали водой (2 раза по 25 мл), сушили MgSO4, и отгоняли растворитель на роторном испарителе. Остаток представляет собой соединение 1 массой 8.9 г. Выход 60%. Экстракт гексана сушили MgSO4, гексан отгоняли на роторном испарителе. Остаток массой 3.4 г (выход 18%) представляет собой соединение 4.
2-(Аллилокси)фенол (1) маслообразное вещество.
Спектр ЯМР 1Н d, м.д.: 4.63 д (2Н, СH2), 5.34 (1H, =CH2, 3JНН(цис)=10.5 Гц), 5.45 (1H, =CH2, 3JНН(транс) =17.4 Гц), 5,65 с (1Н, ОН), 6.05-6.11 м (1Н, =СН), 6.69-6.81 (4 Н, аром.).
Спектр ЯМР 13С, δ, м.д.: 69.80, 112.40 (СH, Ph), 114.80 (СH, Ph), 115.54 (CH2=), 120.99 (СH, Ph), 121.71 (СH, Ph), 132.75 (-CH=), 145.50 (ОС, Ph), 145.54 (ОС, Ph).
1,2-Бис(аллилокси)бензол (2) Спектр ЯМР 1Н (400.13 МГц, CDCl3, d, м.д.): 4.58 д (2Н, СH2), 5.30 (1H, =CH2, 3JНН(цис)=9.8 Гц), 5.47 (1H, =CH2, 3JНН(транс) =17.4 Гц), 6.07-6.14 м (1Н, =СН), 6.69-6.89 (4 Н, аром.).
Спектр ЯМР 13С, δ, м.д.: 69.68, 116.05, 118.80, 123.15, 132.84, 145.60.
Бис[2-бром-3-(2-гидроксифенокси)пропил]селенид (3). Раствор дибромида селена [получен из элементного селена (0.084 г, 1.1 ммоль) и брома (0.172 г, 1.1 ммоль) [1-4]] в 5 мл CCl4 добавили по каплям к раствору 2-(аллилокси)фенола (0.33 г, 2.2 ммоль) в 5 мл CCl4 в течение 1 ч и перемешивали 16 ч при комнатной температуре. Смесь фильтровали, растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Выход 0.575 г (97%).
Спектр ЯМР 1Н d, м.д.: 3.28-3.23 м (4H, CH2Se), 4.14-4.42 м (6H, CH2O, CHBr), 5.89 уш. с (2H, OH), 6.79-6.93 м (8H, Ph).
Спектр ЯМР 13С, δ, м.д.: 29.97, 30.11 (CH2Se), 49.55 (CHBr), 72.04 (CH2O), 115.67, 120.60, 121.30, 143.74, 145.06.
Найдено, %: С 39.89; H 3.70; Se 14.82. С8Н14O4Se. Вычислено, %: C 40.10, H 3.74, Se 14.65.
Ди(2,3-дигидро-1,4-бензодиоксин-2-илметил)селенид (4).
Спектр ЯМР 1Н, d, м.д.: 2.72-2.91 м (4H, CH2Se), 3.76-3.81 м (2H, CH2О), 4.30-4.51 м (4H, CH2O, CHO), 6.60-6.81 м (8Н, Ph).
Результаты и обсуждение
Известен метод получения 2-(аллилокси)фенола (1) путем взаимодействия пирокатехина и свежеперегнанного бромистого аллила в присутствии КOH. Однако, этот способ имеет существенный недостаток, так как соединение 1 не было получено в индивидуальном виде. Это связано с тем, что наряду с соединением 1 образуется 1,2-бис(аллилокси)бензол (2). Мы усовершенствовали методику получения соединения 1 из пирокатехина и аллилбромида, которая позволяет получить индивидуальный 2-(аллилокси)фенол с высокой чистотой.
Реакция пирокатехина с аллилбромидом приводит к образованию соответствующих моноаддукта 1 и диаддукта 2, процесс протекает при комнатной температуре в ДМСО (рис. 2).
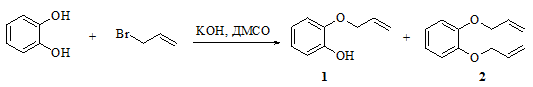
Рис. 2 -Схема реакции пирокатехина с аллилбромидом
Нами разработана удобная методика получения индивидуальных моно- и диаддуктов 1 и 2, которая заключается в разбавлении реакционной массы водой и экстракции сначала гексаном (экстрагируется чистый диаддукт 2), а затем этилацетатом извлекается моноаддукт 1 с выходом 60%. Экстракт гексана содержит чистый продукт 2 (выход 18%).
Соединение 1 представляет интерес поскольку имеют нуклеофильную гидроксигруппу и может быть использовано в реакции селеноциклофункционализации с дигалогенидами селена.
Нами изучена реакция дибромида селена с фенолом 1. Установлено, что реакция протекает с высокой региоселективностью и приводит к образованию продукта присоединения дибромида селена по правилу Марковникова - бис[2-бром-3-(2-гидроксифенокси)пропил]селениду 3 (рис. 3). Соединение 3 является ранее неизвестным, его строение доказано с помощью 1H и 13С ЯМР спектроскопии, и подтверждено данными элементного анализа.
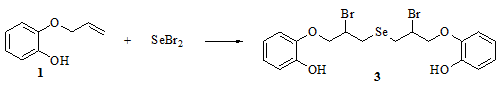
Рис. 3 - Схема реакции дибромида селена с 2-(аллилокси)фенолом
Полученный селенид 3 является достаточно стабильным и ожидаемая внутримолекулярная циклизация не происходит даже в присутствии NaHCO3 (в растворе СHCl3 или ССl4). При взаимодействии с более сильными основаниями, такими как K2CO3, наблюдается образование многокомпонентной смеси, основным продуктом которой является фенол 1, образующийся в результате элиминирования дибромида селена. Ди(2,3-дигидро-1,4-бензодиоксин-2-илметил)селенид - результат внутримолекулярного замещения с образованием двух 2,3-дигидро-1,4-бензодиоксиновых циклов, обнаружен в реакционной смеси (выход около 5%) и охарактеризован с помощью 1H ЯМР (рис. 4).
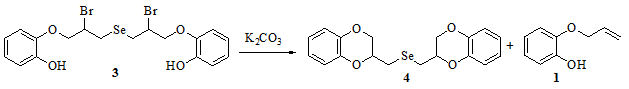
Рис. 4 - Схема реакции бис[2-бром-3-(2-гидроксифенокси)пропил]селенида с карбонатом калия
Предполагаемый путь образования фенола 1 можно объяснить следующей схемой (рис. 5).
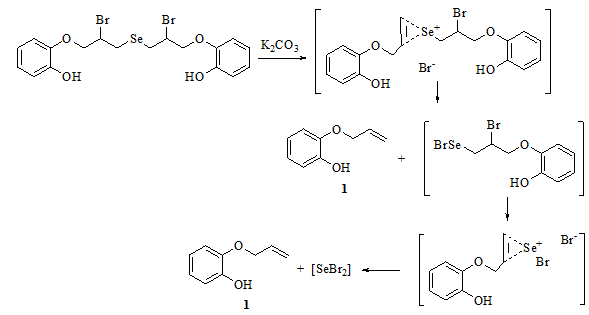
Рис. 5 - . Предполагаемый путь образования 2-(аллилокси)фенола
Список литературы / References
- Potapov V. A. Reactions of selenium dichloride and dibromide with divinyl sulfone: synthesis of novel four- and five-membered selenium heterocycles/ V. A. Potapov, E. O. Kurkutov, M. V. Musalov, S. V. Amosova // Tetrahedron Letters. − 2010. – Vol. 51., No 40. – P. 5258-5261.
- Petragnani N. Recent advances in selenocyclofunctionalization reactions/ N. Petragnani, H. A. Stefani, C. Valduga // Tetrahedron. - 2001. - Vol. 57. - P. 1411.
- Мусалов М. В. Региоселективный синтез бис[(2,3-дигидро-1-бензофуран-2-ил)метил]селенида / М. В. Мусалов, В. А. Потапов, М. В. Мусалова и др. // Журнал органической химии. - 2014. - Т. 50. – № 11. - С. 1712-1713.
- Потапов В. А. Синтез функциональных селеноорганических соединений на основе реакции гетероциклизации дигалогенидов селена с пент-4-ен-1-олом / В. А. Потапов, М. В. Мусалов, Е. О. Куркутов и др. // Журнал органической химии - 2016. - Т. 50, № 3. - С. 360-363.
- Потапов В. А. Эффективный метод синтеза бис(тетрагидро-2Н-пиран-2-илметил)селенида / В. А. Потапов, Е. О. Куркутов, М. В. Мусалов и др. // Известия АН Серия химическая - 2015. - № 12. - С. 2973.
Список литературы на английском языке / References in English
- Potapov V.A. Reactions of selenium dichloride and dibromide with divinyl sulfone: synthesis of novel four- and five-membered selenium heterocycles/ V.A. Potapov, E.O. Kurkutov, M.V. Musalov, S.V. Amosova // Tetrahedron Letters. − 2010. – Vol. 51., No 40. – P. 5258-5261.
- Petragnani N. Recent advances in selenocyclofunctionalization reactions/ N. Petragnani, H. A. Stefani, C. Valduga // Tetrahedron. - 2001. - Vol. 57. - P. 1411.
- Musalov M. V. Regioselektivnyj sintez bis[(2,3-digidro-1-benzofuran-2-il)metil]selenida [Regioselective Synthesis of Bis[(2,3-dihydro-1-benzofuran-2-yl)methyl]selenide]/ M. V. Musalov, V. A. Potapov, M. V. Musalova and others // Zhurnal organicheskoj himii [Journal of Organic Chemistry]. - 2014. - Vol. 50. - No. 11. – P. 1712–1713. [in Russian]
- Potapov V. A. Sintez funkcional'nyh selenoorganicheskih soedinenij na osnove reakcii geterociklizacii digalogenidov selena s pent-4-en-1-olom [Synthesis of New Functionalized Organoselenium Compounds by Heterocyclization of Selenium Dihalides with Pent-4-en-1-ol] / V. A. Potapov, M. V. Musalov, Е.О. Kurkutov and others. // Zhurnal organicheskoj himii [Journal of Organic Chemistry]. - 2016. - Vol. 50. - № 11. - P. 360-363. [in Russian]
- Potapov V. A. Jeffektivnyj metod sinteza bis(tetragidro-2H-piran-2-ilmetil)selenida [Efficient Method for The Sinthesis bis(tetrahydro-2H-pyran-2-ylmethyl)selenide] / V. A. Potapov, Е. О. Kurkutov, M. V. Musalov and others // Izvestija Akademii Nauk Serija Himicheskaja [Bulletin of Academy of Sciences. Chemical Series]. - 2015. - № 12. - P. 2973. [in Russian]
