MINIMALLY INVASIVE THYROID SURGERY
Майстренко Н.А.1, Ромащенко П.Н.2, Криволапов Д.С.3, Пришвин А.П.4, Михальченко Г.В.5
1ORCID: 0000-0002-1405-7660, Доктор медицинских наук, Профессор, Академик РАН, заведующий кафедрой и клиникой факультетской хирургии им. С.П. Федорова, Военно-медицинская академия им. С.М. Кирова, 2ORCID: 0000-0001-8918-1730, Доктор медицинских наук, Профессор, заместитель начальника кафедры факультетской хирургии им. С.П. Федорова, Военно-медицинская академия им. С.М. Кирова, 3ORCID: 0000-0002-9499-2164, Адъюнкт кафедры факультетской хирургии им. С.П. Федорова, Военно-медицинская академия им. С.М. Кирова, 4ORCID: 0000-0002-1570-5199, Кандидат медицинских наук, главный врач Многопрофильной клиники им. Н.И. Пирогова, Санкт-Петербург, 5Заведующий операционным блоком, ГБУЗ Ленинградская областная клиническая больница
МИНИМАЛЬНОИНВАЗИВНАЯ ХИРУРГИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Аннотация
В статье проанализированы результаты обследования и лечения больных хирургическими заболеваниями щитовидной железы, которые были прооперированы с использованием современных малоинвазивных методик. Проведенное исследование позволило обосновать основные критерии дифференцированного подхода к отбору пациентов для выполнения минимальноинвазивных вмешательств на щитовидной железе. Аргументированный выбор позволяет уменьшить частоту специфических осложнений, минимизировать операционную травму, снизить сроки пребывания больных в стационаре, улучшить косметические результаты и повысить качество жизни больных.
Ключевые слова: Минимальноинвазивная хирургия щитовидной железы, минимальноинвазивная видеоассистированная тиреоидэктомия, минимальноинвазивная неэндоскопическая тиреоидэктомия, эндоскопическая тиреоидэктомия.
Maistrenko N.A.1, Romashchenko P.N.2, Krivolapov D.S.3, Prishvin A.P. 4, Mihal'chenko G.V.5
1ORCID: 0000-0002-1405-7660, MD, Рrofessor, head of the Department and Clinic of Faculty Surgery, Kirov Military Medical Academy, 2ORCID: 0000-0001-8918-1730, MD, Рrofessor, deputy head of the Department and Clinic of Faculty Surgery, Kirov Military Medical Academy, 3ORCID: 0000-0002-9499-2164, Рostgraduate student of the Department and Clinic of Faculty Surgery, Kirov Military Medical Academy, Head of the operational unit of Leningrad regional clinical hospital, 4ORCID: 0000-0002-1570-5199, MD, chief physician, Multidisciplinary clinics named after N.I. Pirogov, Saint-Petersburg, 5Head of the operational unit, Leningrad regional clinical hospital
MINIMALLY INVASIVE THYROID SURGERY
Abstract
The article analyzes the results of the examination and surgical treatment of patients with the surgical diseases of the thyroid gland, which underwent a variety of minimally invasive techniques. The study has allowed to clarify the main criteria of the differentiated approach to the selection of the patients for minimally invasive interventions on the thyroid. Such a reasoned choice helps to avoid increasing of the frequency of specific complications, reduces surgical trauma and duration of stay in hospital, improves cosmetic outcome and enhances the quality of life of the patients.
Keywords: мinimally invasive thyroid surgery, minimally invasive video-assisted thyroidectomy, minimally invasive nonendoscopic thyroidectomy, endoscopic thyroidectomy.
В последние годы в хирургии щитовидной железы (ЩЖ) широкое распространение получили малоинвазивные вмешательства с использованием эндоскопических и роботизированных технологий. Предпосылки к их применению обусловлены увеличением числа больных с хирургической патологией ЩЖ, совершенствованием диагностических возможностей и ранним выявлением злокачественных новообразований, развитием эндовидеохирургических технологий и отработкой критериев выбора миниинвазивных вмешательств, стремлением улучшить качество жизни больных, ускорить их трудовую и социальную реабилитацию (Billmann F. et al., 2014; Duke W.S. et al., 2014). Общеизвестными малоинвазивными доступами к ЩЖ в последние 10-15 лет стали минидоступы на передней поверхности шеи, подмышечные, передние грудные, параареолярные, позадиушные, трансоральные, различные варианты робот-ассистированных. Вместе с тем, возникают вопросы целесообразности выполнения оперативных вмешательств из ряда отдаленных доступов (трансорального, трансфарингеального, позадиушного), при которых хирургическая травма тканей и риск развития осложнений существенно выше. Наибольшее признание и распространение в клинической практике получили видеоассистированные вмешательства из срединного шейного доступа и эндоскопические, сочетающие преимущества подмышечных доступов и параареолярных. Однако, общепризнанных и утвержденных рекомендаций (протоколов) по применению данных вмешательств, по-прежнему, нет, показания и противопоказания остаются предметом дискуссии и опираются на опыт отдельных авторов. Таким образом, появление большого выбора малоинвазивных технологий определило вполне очевидные проблемы, связанные с выбором оптимального видеоассистированного или эндоскопического доступа для вмешательств на ЩЖ в зависимости от клинической и морфологической формы заболевания.
Цель исследования – уточнить критерии отбора больных для выполнения видеоассистированных, эндоскопических, а также оперативных вмешательств на ЩЖ из открытого мини-доступа.
Проанализированы результаты обследования и хирургического лечения 155 больных хирургическими заболеваниями ЩЖ, прооперированных с применением различных миниинвазивных методик. Обследование больных осуществлялось в соответствии с клиническими рекомендациями, касающимися не только перечня лабораторно-инструментального обследования, но и интерпретации полученных результатов согласно общепринятым классификациям – TIRADS и Bethesda (Horvath E. et al., 2009; Kwak J.Y. et al., 2011; Cibas E.S. et al., 2009). Критерии отбора пациентов соответствовали общепринятым и учитывали основные факторы: размер узловых образований, объем ЩЖ, наличие экстратиреоидного распространения при высокодифференцированном раке ЩЖ и поражение регионарных лимфатических узлов (Решетов И.В. и соавт., 2014; Слепцов И.В., 2012; Billmann F. et al., 2014; Duke W.S. et al., 2014; Miccoli P. et al., 2016).
Показаниями к хирургическому лечению являлись: фолликулярная опухоль ЩЖ у 78 (50,3%) больных, нетоксический узловой зоб с компрессией органов шеи – у 29 (18,7%), узловой токсический зоб – у 15 (9,7%), диффузный токсический зоб – у 6 (3,9%), высокодифференцированные формы рака ЩЖ – у 27 (17,4%).
Оценены возможности технического выполнения миниинвазивных оперативных вмешательств с использованием основных методик, которые позволили разделить больных на три группы: 1-ю (n=23) составили пациенты, прооперированные с использованием видеоассистированного минидоступа (minimally invasive video-assisted thyroidectomy, MIVAT) на передней поверхности шеи; 2-ю (n=53) – с применением трансаксиллярного трансареолярного эндовидеохирургического доступа (axillo-bilateral-breast approach - АВВА), 3-ю (n=79) – минимально инвазивного неэндоскопического (minimally invasive nonendoscopic thyroidectomy, MIT) (табл.1):
Таблица 1 – Показания и варианты миниинвазивных вмешательств у больных хирургическими заболеваниями ЩЖ (n=155)
| Показания | Методика оперативного вмешательства | ||
| MIVAT (n=23) | ABBA (n=53) | MIT (n=79) | |
| Фолликулярная опухоль (n=78) | 12 | 31 | 35 |
| Нетоксический узловой зоб с компрессией органов шеи (n=29) | - | 14 | 15 |
| Узловой токсический зоб (n=15) | 1 | 4 | 10 |
| Диффузный токсический зоб (n=6) | 1 | 2 | 3 |
| Высокодифференцированный рак ЩЖ (n=27) | 9 (T1a-bN0M0) | 2 (T1a-bN0M0) | 16 (T1a-bN0M0 – 11; T1a-bN1аM0 – 3; T3N0M0 – 2) |
При проведении видеоассистированных оперативных вмешательств использовали два монитора, специальный набор инструментов, предложенный P. Miccoli, оборудование для выполнения интраоперационного нейромониторинга (рис. 1). Горизонтальный разрез кожи по срединной линии протяженностью 1,5-2,5 см выполняли на 2-4 см выше яремной вырезки по кожной складке. После разделения коротких мышц шеи по белой линии устанавливали пластинчатые ретракторы, позволяющие формировать рабочее пространство. Под контролем эндоскопа диаметром 5 мм с 30-градусным наклоном оптики, распатора-отсасывателя, ультразвукового гармонического скальпеля и биполярной коагуляции выделяли верхние щитовидные сосуды (рис. 2), которые электролигировали (рис. 4.), контролируя визуально и посредством нейромониторинга наружную ветвь верхнего гортанного нерва (рис. 3). Далее последовательно производили мобилизацию доли ЩЖ и после пересечения перешейка начинали открытый этап операции – долю выводили в рану под нейромониторным контролем возвратного гортанного нерва и визуальным – паращитовидных желез (рис. 5), лигировали нижнюю щитовидную артерию в месте ее входа в ткань ЩЖ, пересекали связку Бери и удаляли препарат. При выполнении тиреоидэктомии описанные выше этапы операции повторяли с другой стороны. После контроля гемостаза рану послойно ушивали с формированием внутрикожного косметического шва (рис. 6).
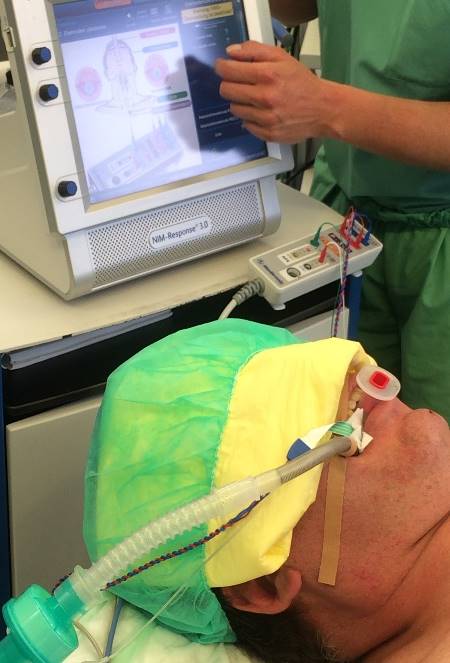
Рис. 1 – Аппарат «Medtronic» NIM-Neuro 3.0 со специальной интубационной трубкой
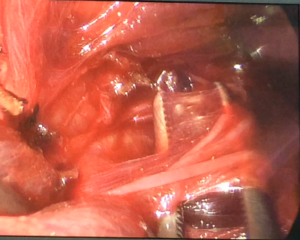
Рис. 2 – Выделение верхних щитовидных сосудов
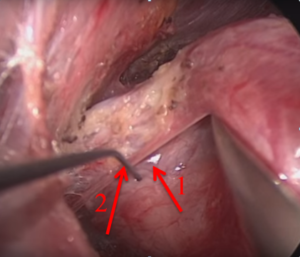
Рис. 3 – Интраоперационный нейромониторинг наружной ветви верхнего гортанного нерва (1) при помощи электрода (2)
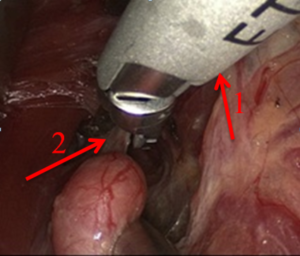
Рис. 4 – Электролигирование гармоническим скальпелем (1) верхних щитовидных сосудов (2)
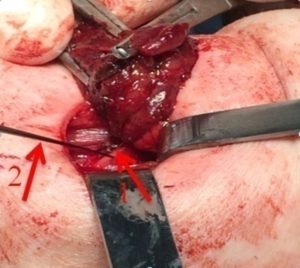
Рис. 5 – Интраоперационный нейромониторинг возвратного гортанного нерва (1) при помощи электрода (2)
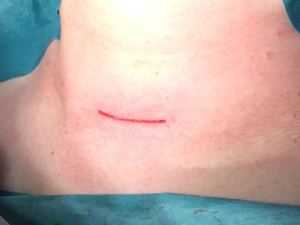
Рис. 6 – Вид операционной раны после ушивания
При проведении эндоскопических вмешательств использовались специальные ножницы для выполнения подкожной диссекции, два длинных троакара диаметром 5 мм и один диаметром 10 мм, 10 мм эндоскоп с 45-градусным наклоном оптики, гармонический скальпель, обычные зажимы и ножницы для эндоскопических операций, оборудование для интраоперационного нейромониторинга. Первый разрез кожи протяженностью до 2 см производили по кожной складке на уровне передней подмышечной линии (рис. 7). Затем выполняли подкожную диссекцию тканей до уровня яремной вырезки для постановки троакара диаметром 10 мм (рис. 8). После инсуфляции углекислого газа под давлением 8-10 мм рт. ст. выполняли два разреза протяженностью 5 мм вдоль верхнего края ареол и устанавливали два троакара для инструментов (рис. 9). С помощью гармонического скальпеля в сформированном операционном пространстве производили разделение коротких мышц шеи по белой линии (рис. 10). Дальнейшая последовательность действий по мобилизации доли ЩЖ идентична видеоассистированному этапу предшествующей методики. С целью профилактики повреждения наружной ветви верхнего гортанного и возвратного гортанного нервов выполняли интраоперационный нейромониторинг (рис. 11). После удаления препарата и контроля гемостаза короткие мышцы шеи соединялись по белой линии непрерывным обвивным швом. С целью предотвращения развития выраженных подкожных гематом выполнялось однодневное дренирование туннелированной клетчатки с ушиванием ран косметическим внутрикожным швом (рис.12).
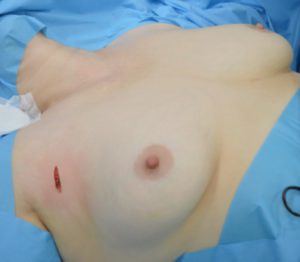
Рис. 7 – Разрез для троакара диаметром 10 мм
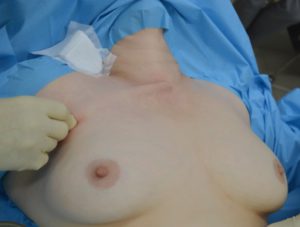
Рис. 8 – Выполнение подкожной диссекции тканей
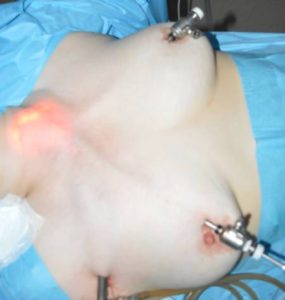
Рис. 9 – Расположение троакаров при операциях по методике АВВА
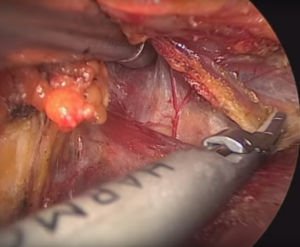
Рис. 10 – Разделение коротких мышц шеи с использованием гармонического скальпеля
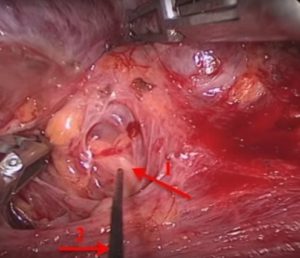
Рис. 11 – Интраоперационный нейромониторинг возвратного гортанного нерва (1) при помощи электрода (2)
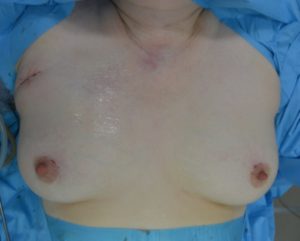
Рис. 12 – Вид операционных ран и области вмешательства после ушивания
Результаты исследования и их обсуждение. Реализация диагностической программы позволила определить показания к выбору миниинвазивных методик и объему хирургического лечения (табл. 2). Объем оперативных вмешательств определялся согласно Российским и международным клиническим рекомендациям (Бельцевич Д.Г. и соавт., 2015; Gharib H. еt al., 2016).При выполнении минимальноинвазивных неэндоскопических вмешательств выполняли срединный разрез кожи протяженностью от 2,5 до 5 см на 3 см выше яремной вырезки (немного выше чем для традиционных вмешательств для удобства работы на сосудах верхнего полюса ЩЖ в условиях небольшого рабочего пространства). После этого короткие мышцы шеи разделяли по белой линии на протяжении 3 см и без пересечения отводили пластинчатыми ретракторами на стороне поражения латерально. Мобилизацию ЩЖ осуществляли с использованием современных энергетических устройств под контролем интраоперационного нейромониторинга. Закрытие раны аналогичное видеоассистированным вмешательствам без дренирования зоны операции.
Таблица 2 – Объем и варианты миниинвазивных вмешательств у больных хирургическими заболеваниями ЩЖ (n=155)
|
Диагноз |
Методика оперативного вмешательства | ||
| MIVAT (n=23) | ABBA (n=53) | MIT (n=79) | |
| Тиреоидэктомия (n=55) | 18/4* | 15 | 22/4* |
| Гемитиреоидэктомия (n=69) | 5 | 24 | 40 |
| Удаление доли ЩЖ (n=19) | - | 9 | 10 |
| Субтотальная резекция ЩЖ (n=12) | - | 5 | 7 |
Интраоперационные осложнения возникли у 3 (1,9%) больных, прооперированных по методике АВВА и явились основанием для конверсии доступа в связи с развитием в двух случаях кровотечения из ткани ЩЖ на фоне аутоиммунного воспаления тканей, в одном – из притока наружной яремной вены с риском возникновения газовой эмболии. Послеоперационные осложнения развились у 10 (6,5%) больных (при технике MIVAT у 3, АВВА – у 4, MIT – у 3).
Несмотря на прецизионный характер вмешательств, не удалось избежать транзиторного пареза возвратного гортанного нерва (ВГН) у 5 (3,2%) больных. Детальный анализ причин повреждений ВГН в условиях ограниченного операционного пространства позволил установить, что их развитие было связано с чрезмерной тракцией и давлением на ткани, обусловленными загрудинным распространением многоузлового коллоидного зоба объемом 110 см3 при диаметре узла 68 мм с компрессией органов шеи при MIT; повышенной кровоточивостью ткани ЩЖ на фоне аутоиммунного воспаления при диффузном токсическом зобе объемом 24 см3 – при MIVAT, узловом токсическом зобе объемом 52 см3 с узлом диаметром 48 мм и раке ЩЖ T1bN0M0 в сочетании с аутоиммунным тиреоидитом – при АВВА. Полученные результаты частоты данного осложнения и причин его возникновения согласуются с литературными данными (Billmann F. et al., 2014; Wang C. et. al., 2014; Miccoli P. et al., 2016). Одной из причин развития пареза при выполнении центральной лимфодиссекции явилось дистантное электрокоагуляционное повреждение при нерациональном использовании энергетических устройств в непосредственной близости возвратного гортанного нерва. Такие термические повреждения описаны в мировой литературе, отражая тот факт, что в настоящее время при мобилизации ЩЖ для пересечения сосудов просветом до 4-5 мм большинство хирургов используют гармонический скальпель и биполярную коагуляцию. С целью профилактики данного осложнения некоторые авторы для пересечения даже мелких сосудов рекомендуют применение миниатюрных (3 мм) титановых скоб (Miccoli P. et al., 2016).
Анализ частоты и причин возникновения послеоперационного гипопаратиреоза свидетельствует о том, что его возникновение сопряжено с трудностями визуализации паращитовидных желез при выполнении центральной лимфодиссекции и операциях на плотной ткани ЩЖ с ее повышенной кровоточивостью при аутоиммунном воспалении. Данный фактор побуждает к использованию методики интраоперационной фотодинамической визуализации околощитовидных желез, предлагаемой некоторыми авторами (Кирпа Е.А. и соавт., 2013; Akasu H. et al., 2006; Takeuchi S. et al., 2014).
Недостаточный гемостаз энергетическими устройствами привел к возникновению в каждой группе по одному случаю гематом в области оперативного вмешательства, которые потребовали в одном случае повторной операции с перевязкой источника кровотечения в виде нижней щитовидной артерии, в двух других – проведения пункционного лечения. Данное осложнение по различным данным встречается с частотой от 0,12% при видеоассистированных вмешательствах до 4,8% – при эндоскопических (Ban E.J. et al., 2014 Lee D.Y. et al., 2015 Anuwong A., 2015).
Парез ВГН у 5 пострадавших представлял транзиторный характер и разрешился самостоятельно в сроки до 7 месяцев. Послеоперационный гипопаратиреоз, развившийся у двух пациентов, на фоне лечения препаратами кальция был устранен в течение месяца.
Ретроспективный анализ и оценка результатов оперативного лечения больных хирургическими заболеваниями щитовидной железы позволили установить, что основными факторами, обуславливающими выбор рационального миниинвазивного вмешательства являются: 1) размер узловых образований; 2) объем щитовидной железы; 3) аутоиммунное воспаление тиреоидной ткани на фоне узлового токсического и диффузного токсического зоба; 4) проявления аутоиммунного тиреоидита; 5) загрудинное расположение зоба; 6) необходимость выполнения центральной лимфодиссекции при метастатическом поражения лимфатических узлов.
Полученные данные свидетельствую о том, что МIVAТ является операцией выбора при фолликулярных опухолях и коллоидных узлах с компрессией органов шеи диаметром <40 мм и объеме ЩЖ <20 см3. Методика «АВВА» оправдана при более крупных узловых образованиях (диаметром <50 мм) и большем объеме щитовидной железы (<50 см3). Локализованные формы высокодифференцированного рака ЩЖ (T1N0M0) не являются противопоказанием для выполнения видеоассистированных и эндоскопических вмешательств. Выполнение МIТ целесообразно при узловых образованиях диаметром >50 мм без загрудинного распространения, объеме щитовидной железы >50 см3 и высокодифференцированных формах рака с минимальным распространением и регионарными метастазами в 6 группу лимфатических узлов (T1-3N0-1aM0).
Противопоказаниями к применению видеоассистированных и эндоскопических операций являются высокодифференцированные формы рака диаметром >20 мм, наличие регионарных метастазов, ретростернальное расположение зоба, аутоиммунный тиреоидит с компрессией органов шеи, токсические формы зоба, предшествующие операции и лучевая терапия в области шеи. При наличии этих противопоказаний за исключением загрудинного зоба оперативное вмешательство целесообразно выполнять по методике МIТ.
Таким образом, результаты проведенного исследования позволят обоснованно и дифференцированно подойти к отбору пациентов с хирургическими заболеваниями ЩЖ для выполнения миниинвазивных оперативных вмешательств. Обеспечение методичности и безопасности выполнения технических приемов с обязательным использованием интраоперационного нейромониторинга и визуализацией паращитовидных желез будет способствовать уменьшению частоты развития специфических осложнений, минимизации хирургической травмы и сроков пребывания прооперированных в стационаре, улучшению косметических результатов и качества жизни больных.
Список литературы / References
- Видеоассистированная резекция щитовидной железы из одностороннего подмышечного доступа/ И.В. Решетов, Ф.Е. Севрюков, А.К. Голубцов и др.// Голова и шея. Российское издание. Журнал общероссийской общественной организации "Федерация специалистов по лечению заболеваний головы и шеи". – 2014. – №3. – С. 15-19.
- Методы визуализации паращитовидных желез/ Е.А. Кирпа, И.В. Решетов, А.К. Голубцов и др.// Онкохирургия. – 2013. – Т.5, №1. – С. 66-72.
- Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению узлового зоба (новая редакция 2015 года)/ Д.Г. Бельцевич, В.Э. Ванушко, Г.А. Мельниченко и др.// Эндокринная хирургия. – 2015. – Т. 8, №1. – С. 15-21.
- Российские клинические рекомендации по диагностике и лечению дифференцированного рака щитовидной железы у взрослых. Проект. Редакция 2016 г./ Д.Г. Бельцевич, В.Э. Ванушко, Г.А. Мельниченко и др.// Эндокринная хирургия. – 2015. – Т. 9, №3. – С. 7-14.
- Слепцов, И.В. Методы малоинвазивного лечения заболеваний щитовидной и околощитовидных желез: Дис… докт. мед. наук / И.В. Слепцов; СПБГУ. – Санкт-Петербург, 2012. – 300 с.
- American association of clinical endocrinologists, Аmerican college of endocrinology, and Associazione medici endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules – 2016 update/ Gharib, E. Papini, J.R. Garber et al.// Endocrine practice. – 2016. – Vol. 22. – 60 р.
- Anuwong, А. Transoral Endoscopic Thyroidectomy Vestibular Approach: A Series of the First 60 Human Cases/ А. Anuwong// World J. Surg. – 2016. – Vol. 40, №3. – P. 491-497.
- An Ultrasonogram Reporting System for Thyroid Nodules Stratifying Cancer Risk for Clinical Management / E. Horvath, S. Majlis, R. Rossi et al.// The Journal of Clinical Endocrinology & Metabolism. – 2009. – 94, № 5. – P. 1748-1751.
- Cibas E.S. The Bethesda System for Reporting Thyroid Cytopathology/ E.S. Cibas, S.Z. Ali// Thyroid. – 2009. – 19. – P. 1159-1165.
- Duke, W.S. Alternative approaches to the thyroid gland/ W.S. Duke, J. Terris// Endocrinol. Metab. Clin. North Am. – 2014. – Vol. 43, №2. – P. 459-474.
- Endoscopic thyroidectomy via areola approach: summary of 1,250 cases in a single institution/ C. Wang, Z. Feng, J. Li et al.// Endosc. – 2015. – Vol. 29, №1. – P. 192-201.
- Identification of pathological and normalparathyroid tissue by fluorescent labeling with 5-aminolevulinic acid during endocrine neck surgery/ Takeuchi, K. Shimizu, K. Jr. et al.// J. Nippon Med. Sch. –2014. – Vol. 81, №2. – Р. 84-93.
- Minimal-access video-assisted thyroidectomy for benign disease: a retrospective analysis of risk factors for postoperative complications/ F. Billmann, T. Bokor-Bilmann, H. Lapshyn et al.// J. Surg. – 2014. – Vol. 12. – P. 1306-1309.
- Minimally invasive video-assisted thyroidectomy: reflections after more than 2400 cases performed/ P. Miccoli, Biricotti,V. Matteucci et al.// Surg. Endosc. – 2016. – Vol. 30, №6. – P. 2489-2495.
- Photodynamic identification of human parathyroid glands with 5-aminolevulinic acid/ Akasu ,T. Igarashi , K. Tanaka et al.// J. Nippon Med. Sch. – 2006. – Vol. 73, №5. – Р.246-247.
- Surgical complications after robotic thyroidectomy for thyroid carcinoma: a single center experience with 3,000 patients/ E.J. Ban, J.Y. Yoo, W.W. Kim et al.// Surg Endosc. – – Vol. 28, №9. – P. 2555-2563.
- Thyroid Imaging Reporting and Data System for US Features of Nodules: A Step in Establishing Better/ J.Y. Kwak, K.H. Han, J.H. Yoon et al.// – 2011. – Vol. 260, № 3. – P. 892-899.
Список литературы на английском языке / References in English
- Videoassistirovannaja rezekcija shhitovidnoj zhelezy iz odnostoronnego podmyshechnogo dostupa [Video assisted resection of thyroid from unilateral axillary approach]/ I.V. Reshetov, F.E. Sevrjukov, A.K. Golubcov and others// Golova i sheja. Rossijskoe izdanie. Zhurnal obshherossijskoj obshhestvennoj organizacii "Federacija specialistov po lecheniju zabolevanij golovy i shei [Head&Neck. Journal of the russian federation of treatment specialists in head&neck pathology]. – 2014. – №3. – P. 15-19. [in Russian]
- Metody vizualizacii parashhitovidnyh zhelez [Methods of imaging of the parathyroid glands]/ E.A. Kirpa, I.V. Reshetov, A.K. Golubcov and others// Onkohirurgija [Oncosurgery]. – 2013. – T.5, №1. – P. 66-72. [in Russian]
- Klinicheskie rekomendacii Rossijskoj associacii jendokrinologov po diagnostike i lecheniju uzlovogo zoba (novaja redakcija 2015 goda) [Russian Association of Endocrinologists Clinic Guidelines for Thyroid Nodules Diagnostic and Treatment]/ D.G. Bel'cevich, V.Je. Vanushko, G.A. Mel'nichenko and others // Jendokrinnaja hirurgija [Endocrine Surgery]. – 2015. – T. 8, №1. – P. 15-21. [in Russian]
- Rossijskie klinicheskie rekomendacii po diagnostike i lecheniju differencirovannogo raka shhitovidnoj zhelezy u vzroslyh. Proekt. Redakcija 2016 g. [Russian clinical practice guidelines for diagnosis and treatment of differentiated thyroid cancer.]/G. Bel'cevich, V.Je. Vanushko, G.A. Mel'nichenko i dr.// Jendokrinnaja hirurgija [Endocrine Surgery]. – 2015. – T. 9, №3. – P. 7-14. [in Russian]
- Slepcov, I.V. Metody maloinvazivnogo lechenija zabolevanij shhitovidnoj i okoloshhitovidnyh zhelez [Methods of minimally invasive treatment of diseases of the thyroid and parathyroid glands]: …of MD: 14.01.17./ I.V. Slepcov; SPBGU. – Sankt-Peterburg, 2012. – 300 p. [in Russian]
- American association of clinical endocrinologists, Аmerican college of endocrinology, and Associazione medici endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules – 2016 update/ Gharib, E. Papini, J.R. Garber et al.// Endocrine practice. – 2016. – Vol. 22. – 60 р. [in English]
- Anuwong, А. Transoral Endoscopic Thyroidectomy Vestibular Approach: A Series of the First 60 Human Cases/ А. Anuwong// World J. Surg. – 2016. – 40, №3. – P. 491-497. [in English]
- An Ultrasonogram Reporting System for Thyroid Nodules Stratifying Cancer Risk for Clinical Management / E. Horvath, S. Majlis, R. Rossi et al.// The Journal of Clinical Endocrinology & Metabolism. – 2009. – 94, № 5. – P. 1748-1751. [in English]
- Cibas E.S. The Bethesda System for Reporting Thyroid Cytopathology/ E.S. Cibas, S.Z. Ali// Thyroid. – 2009. – 19. – P. 1159-1165. [in English]
- Duke, W.S. Alternative approaches to the thyroid gland/ W.S. Duke, J. Terris// Endocrinol. Metab. Clin. North Am. – 2014. – Vol. 43, №2. – P. 459-474. [in English]
- Endoscopic thyroidectomy via areola approach: summary of 1,250 cases in a single institution/ C. Wang, Z. Feng, J. Li et al.// Endosc. – 2015. – Vol. 29, №1. – P. 192-201. [in English]
- Identification of pathological and normalparathyroid tissue by fluorescent labeling with 5-aminolevulinic acid during endocrine neck surgery/ Takeuchi, K. Shimizu, K. Jr. et al.// J. Nippon Med. Sch. – 2014. – Vol. 81, №2. – Р. 84-93. [in English]
- Minimal-access video-assisted thyroidectomy for benign disease: a retrospective analysis of risk factors for postoperative complications/ F. Billmann, T. Bokor-Bilmann, H. Lapshyn et al.// J. Surg. – 2014. – Vol. 12. – P. 1306-1309. [in English]
- Minimally invasive video-assisted thyroidectomy: reflections after more than 2400 cases performed/ P. Miccoli, Biricotti,V. Matteucci et al.// Surg. Endosc. – 2016. – Vol. 30, №6. – P. 2489-2495. [in English]
- Photodynamic identification of human parathyroid glands with 5-aminolevulinic acid/ Akasu ,T. Igarashi , K. Tanaka et al.// J. Nippon Med. Sch. – 2006. – Vol. 73, №5. – Р. 246-247. [in English]
- Surgical complications after robotic thyroidectomy for thyroid carcinoma: a single center experience with 3,000 patients/ E.J. Ban, J.Y. Yoo, W.W. Kim et al.// Surg Endosc. – – Vol. 28, №9. – P. 2555-2563. [in English]
- Thyroid Imaging Reporting and Data System for US Features of Nodules: A Step in Establishing Better/ J.Y. Kwak, K.H. Han, J.H. Yoon et al.// – 2011. – Vol. 260, № 3. – P. 892-899. [in English]
