PHOSPHATIDYLCHOLINE COMPLEX WITH 7,3', 4'-TRYOXIFLAVONOL (FISETIN)
Насибуллин Р.С.1, Сетченков М.С.2, Галеева Р.И.3, Хайбуллина И.Р.4
1 Профессор,2 Доцент, 3 Соискатель, 4 Соискатель,
Башкирский государственный медицинский университет
КОМПЛЕКС ФОСФАТИДИЛХОЛИНА С 7,3', 4'-ТРИОКСИФЛАВОНОМ (ФИЗЕТИН)
Аннотация
Методами квантовой химии и ЯМР 13С исследован механизм комплексообразования лецитин-физетин.
Ключевые слова: комплекс, лецитин, физетин, ЯМР спектроскопия
Nasibullin R.S.1, Setchenkov M.S.2, Galeeva R.I.3, Haibullina I.R.4
1 Professor, 2 Associate professor, 3 Postgraduate student, 4 Postgraduate student,
Bashkir State Medical University
PHOSPHATIDYLCHOLINE COMPLEX WITH 7,3', 4'-TRYOXIFLAVONOL (FISETIN)
Abstract
By methods quantum chemistry and 13С NMR the formation mechanism complex lecithin-fisetin is investigated.
Keywords: complex, lecithin, fisetin, NMR spectroscopy
Растущий интерес исследователей к группе молекул растительного происхождения флавоноидам обусловлен разнообразными видами биологической активности, проявляемый этим классом соединений. В настоящее время выделено и проведена их идентификация свыше 6000 молекул, у которых установлено более 40 видов биоактивности [ 1, 2]
Флавоноиды проявляют противоаллергическую, противовирусную, противораковую и другие виды биологической активности. Хотя проблема активности флавоноидов и возможность их практического использования обусловили появление ряда работ, в литературе мало работ посвященных исследованию молекулярного механизма действия этой группы молекул на биологические функции биологических соединений. В настоящее сообщение проводятся результаты исследований механизма действия типичной молекулы из группы флавоноидов –физетина, предпринятых в рамках обширной программы установления связи структуры молекул с их биоактивностью [3,4]
Рис.1 - Структура физетина
В более ранних работах было показано, что некоторые молекулы из класса флавоноидов, имеющие сопряженные циклы, формируют комплексы с клеточными фосфолипидами посредством электронов π- системы. [5,6]. При таком механизме комплексообразования становится понятным сохранение биоактивности физетина при появлении у молекулы заместителей, создающих препятствия для сближения на расстояния, необходимые для возникновения химических актов.
Материалы и методы
Взаимодействие фосфатидилхолина и физетина исследовали методами квантовой химии и спектроскопии ЯМР 13С. Предварительно структура комплекса минимизировалась методом молекулярной механики в последствии результаты уточняли методом DFT и AM1.
В экспериментах использовались лецитин, выделенный из куриных яиц, методом, описанным в работе [6] и стандартные образцы физетина производства фирмы Oldrich. Растворителем являлся хлороформ. В очистке растворителя не было необходимости. Спектры регистрировались при концентрации лецитина 0,005 М. При повышении концентрации лецитина сокращается время накопления сигналов ЯМР, но формируются мицеллы, вызывающие уширение спектральных линий и уменьшение точности измерения химических сдвигов.
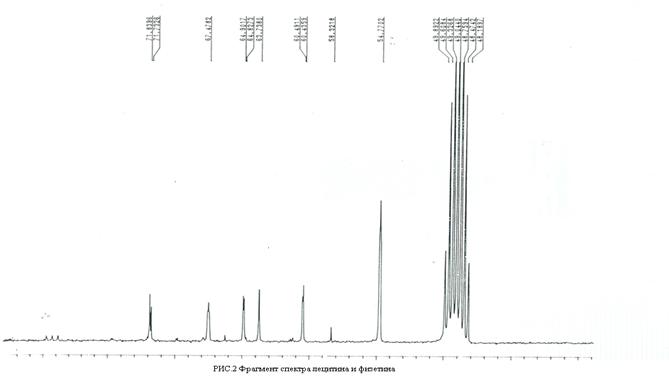
Рис. 2 - Фрагмент спектра лецитина и физетина
Одновременно при больших концентрациях уменьшаются число точек связывания лецитина с физетином, так как эти точки оказываются внутри мицелл. Концентрация физетина доводилась до 0,01 М. Спектры ЯМР 13С записаны на спектрометре АМ-300 («Вrucer» ФРГ) с рабочей частотой 75 мГц на ядрах 13С при температуре 30 0С, измерены относительно внутреннего стандарта – тетраметилсилана.
Использованы 450 импульсы, задержка между ними составляет 1,5 с. Число накоплений доходило до 20000 и при таком числе сканов соотношение сигнал/ шум был не меньше 50. Процесс накопления сигналов проводился на 64-128 К точек с шириной развертки 100-150 м.д. В этих условиях при ширине развертки 100 м.д. на 128 к точек и времени выборки 8,65 с достигается цифровое разрешение 0,06 Гц и точность определения значения ХС 0,001 м. д. Зарегистрированный спектр ЯМР 13С представлен на рис.2. Спектральная линия от чистого лецитина с ХС равным 53, 7180 при внесении в раствор физетина приобретает значение 54,7702. Такая величина изменения ХС от ядер углеродов метильных групп, связанных холиновой головкой фосфатидилхолина, является типичной, когда комплекс формируется с сопряженным циклом флавоноидов. Подобное изменение ХС хорошо согласуется результатами квантовохимических расчетов, проведенный методом DFT. Метод АМ1 использовался для контроля результатов полученных DFT и показал качественное согласие результатов [7]. Расчеты показали, что комплекс посредством π-системы электронов образуется всеми кольцами физетина. Наибольшее значение энергии комплексообразование наблюдается с циклом С равное 9,8 ккал, поэтому основное внимание в этой работе было уделено взаимодействию фосфатидилхолина с циклом С. Следует отметить, что энергия комплексобразования определяется как разность двух больших величин, следовательно имеет достаточно большую погрешность. Одновременно были получены изменения распределения электронной плотности ядер комплекса. Здесь приводим полученные значения только для углерода холиновой группы лецитина, участвующих в формировании комплекса и расположенного наиболее близко к кольцу физетина. Значения электронной плотности на ядре углерода изолированной молекулы -3,953, в комплексе- 3,940. Подобное изменение распределения плотности согласуется смещением ХС в слабое поле, наблюдающееся в эксперименте ЯМР(рис.2).
Литература
- Kohl R. Protective and adverse biological actions of phenolic antiocidants, London Acad. Press, 1991.
- Van Ackers S.A., Van Jen Berg D.I. Tromp M.N., Biol. Med, 1996,20,№3 p 331-342.
- Nasibullin R.S., Spirihin L.V., Ponomareva V.A. Biophisics, 1991,36,№4 P 594/
- Насибуллин Р.С., Кузнецова М.В., Фахретдинова Д.И., Химическая химия и мезоскопия 2013 Т 15,№4 c.627
- Насибуллин Р.С., Галеева Р.И., Юсупова З.Д. Бутлеровские сообщения, 2012, Т32 № 10,с.68
- Афанасьева, Ю.Г. Насибуллин Р.С. Вопросы биологической медицинской и фармацевтической химии.- 2010. - № 5. – С. 41-45.
- Nasibullin R.S, Fahretdinova E.R., Nusratullin V.M., Galeeva R.I. Biopolymers and Cell. 2010. Vol.26. N5.
References
- Kohl R. Protective and adverse biological actions of phenolic antiocidants, London Acad. Press, 1991.
- Van Ackers S.A., Van Jen Berg D.I. Tromp M.N., Biol. Med, 1996,20, №3 p 331-342
- Nasibullin R.S.,Spirihin L.V., Ponomareva V.A. Biophisics, 1991,36,№4 P 594/
- Nasibullin R.S., Kuznetcova M.V., Phahretdinova D.I Chemical chemistry and mesoscopy.2013. Т 15 . №4 S.627
- Nasibullin R.S., Galeeva R.I., Yusupova Z.D. Butlerov Communications. 2012. Vol.32.No.10. S.68.
- Afanaseva J.G., Nasibullin R.S. Questions of biological, medical and pharmaceutical chemistry. 2010. - № 5. – S. 41-45.
- Nasibullin R.S, Fahretdinova E.R., Nusratullin V.M., Galeeva R.I. Biopolymers and Cell. 2010. Vol.26. N5.