INFLUENCE OF PHENYLPYRIMIDINE ON THE KINETICS OF THE HYDROGEN RELEASE REACTION ON IRON IN ACIDIC CHLORIDE ENVIRONMENTS
Балыбин Д.В.1, Кудрявцева Н.М.2, Попова Е.Д.3, Шамсиева Е.А.4
1 Кандидат химических наук, старший преподаватель кафедры аналитической и неорганической химии,
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина,
2Аспирантка 1 года обучения, кафедра химии,
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина,
3Студентка 5 курса специальности «химия»,
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина,
4Студентка 3 курса специальности «химия»,
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина
ВЛИЯНИЕ ФЕНИЛБИГУАНИДИНА НА КИНЕТИКУ РЕАКЦИИ ВЫДЕЛЕНИЯ ВОДОРОДА НА ЖЕЛЕЗЕ В КИСЛЫХ ХЛОРИДНЫХ СРЕДАХ
Аннотация
В данной работе изучена кинетика реакции выделения водорода (РВВ) на железе и диффузия водорода через стальную мембрану из этиленгликоль – водных растворов НС1 с постоянной ионной силой, равной 1, содержащих фенилбигуанидин (ФБГ). Показано влияние ФБГ на природу лимитирующей стадии РВВ.
Ключевые слова: реакция выделения водорода, фенилбигуанидин, лимитирующая стадия, растворители.
Balybin D. V.1, Kudryavtseva N. M.2, Popova E. D.3, Shamsieva E.A.4
1Candidate of chemical sciences, assistant professor of analytical and inorganic chemistry department,
Tambov State University named after G.R. Derzhavin,
2Graduate 1st year,
Department of Chemistry, Tambov State University named after G.R. Derzhavin,
3Student of speciality «Chemistry»,
Tambov State University named after G.R. Derzhavin,
4Student of speciality «Chemistry»,
Tambov State University named after G.R. Derzhavin
INFLUENCE OF PHENYLPYRIMIDINE ON THE KINETICS OF THE HYDROGEN RELEASE REACTION ON IRON IN ACIDIC CHLORIDE ENVIRONMENTS
Abstract
In this work we study the kinetics of the reaction of hydrogen release on iron and hydrogen diffusion through the steel membrane from the ethylene glycol - water HC1 solutions of constant ionic strength of 1, containing phenylpyrimidine . It shows the influence of phenylpyrimidine on the nature of the limiting stage of the reaction of hydrogen releas.
Keywords: reaction of hydrogen release, phenylpyrimidine, limiting stage, solvents.
Введение
Исследование влияния природы индивидуального и состава смешанного растворителя на кинетику и механизм электродных реакций представляет собой глобальную научную задачу, к решению которой исследователи, по существу, только приступают. Дело в том, что роль растворителя как среды и как реагента не может быть однозначно без серьезных допущений выяснена без смены его природы в единых процессах. Это касается закономерностей химических и электрохимических процессов, как гомогенных, так и гетерогенных, протекающих в объеме не только жидкой фазы, но и на границе раздела фаз. Такой подход обусловлен невозможностью однозначной оценки влияния молекул сольвента на поведение системы в целом как с точки зрения состояния твердой фазы (электродов), границы раздела фаз, так и сольватационных эффектов объема раствора [1].
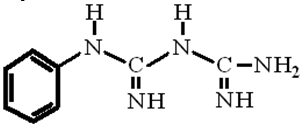
Целью данной работы являлось изучение кинетики реакции выделения водорода (РВВ) на железе и диффузию водорода через стальную мембрану из этиленгликоль – водных растворов НС1 с постоянной ионной силой, равной 1, содержащих фенилбигуанидин, молекулярная формула которого имеет вид:
Методика эксперимента
Исследования проведены в водных и водно – этиленгликолевых (с 50 масс.% воды) растворах с составом электролита х М НСl + (1 – х) М LiCl, полученных насыщением исходных растворителей сухим хлористым водородом с последующим разбавлением ими полученной системы до заданной кислотности и введением высушенного при 107 5°С хлорида лития. Кинетику РВВ исследовали при комнатной температуре на железе армко в условиях потенциодинамической поляризации (скорость развёртки 0,66 мВ/с, потенциостат Solartron 1255), водородная атмосфера, комнатная температура, потенциалы пересчитаны по стандартной водородной шкале. Электрохимические измерения проведены в двух экспериментальных сериях: в одной использован насыщенный водный хлоридсеребряный электрод сравнения, во второй – равновесный водородный электрод в том же рабочем растворе. Первый метод связан с возникновением потенциала жидкостной границы НО-С2Н4-ОН / Н2О, второй ведет к зависимости потенциала электрода сравнения от кислотности среды, но позволяет непосредственно оценивать величину перенапряжения водорода, определяющую скорость катодного процесса. Потенциалы приведены по стандартной водородной шкале. Рабочий электрод с видимой поверхностью 1 см2 армировали в оправу из эпоксидной смолы, отвержденной полиэтиленполиамином, зачищали наждачной бумагой разных номеров и обезжиривали ацетоном. Фенилбигуанидин был синтезирован непосредственно для рассматриваемых экспериментов.
Экспериментальные результаты
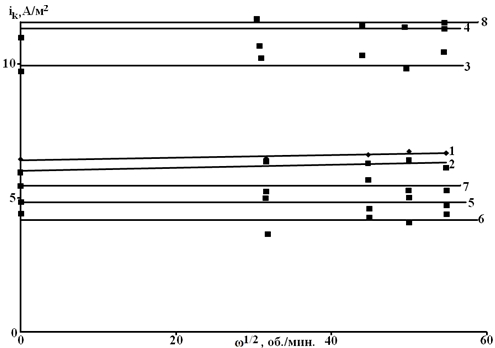
С целью идентификации характера контроля процесса рассматривали влияние скорости вращения дискового электрода на кинетику РВВ в присутствии ФБГ и в фоновых растворах. Соответствующие данные представлены на рисунке 1. Из них следует, что РВВ протекает в условиях исключительно кинетических ограничений.
Рис. 1 - Влияние частоты вращения дискового электрода Ст3 на катодный ток восстановления ионов водорода в водно – этиленгликолевых растворах: 1, 2 – 100 масс % Н2О; 3, 4 – содержащих 50 масс. % Н2О; 5, 6 – содержащих 10 масс. % Н2О; 7, 8 – условно безводный этиленгликоль. Состав электролита 0,1 М НС1 + 0,9 М LiC1. Состав раствора: 1, 3, 5, 7 – фоновые растворы; 2, 4, 6, 8 – фоновые растворы, содержащие 1 мМ ФБГ. ΔЕk = -50 мВ, τвыдержки = 300 сек
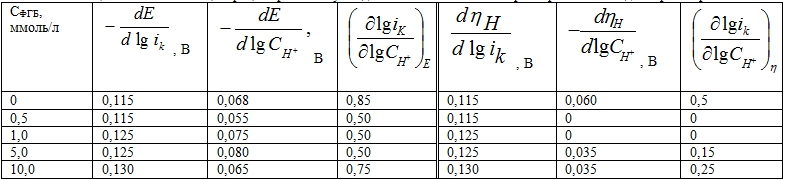
Таблица 1 - Влияние концентрации фенилбигуанидина на кинетические параметры РВВ в водных растворах НС1
В чисто водных фоновых растворах закономерности, характеризующие кинетику РВВ тождественны полученным ранее [2]. Как следует из полученных кинетических параметров (таблица 1), процесс протекает по механизму Фольмера (1) – Тафеля (2) с замедленной стадией разряда
Н3О+ + е → Надс + Н2О (1)
Надс + Надс → Н2 (2)
Однако, при введении 0,5 мМ фенилбигуанидина ситуация меняется кардинально. Наличие уже столь малой концентрации ФБГ приводит к лимитирующей стадии рекомбинации (2) (таблица 1). Рост его содержания в 20 раз, в первом приближении, не изменяет наблюдаемой картины (таблица 2). Порядки реакции по фенилбигуанидину при Е = -0,4 В и η = 0,2 В в растворах с х = 0,1 моль/л равны соответственно -0,30 и -0,29.
В целом, закономерности, наблюдаемые в присутствии фенилбигуанидина, существенно отличаются от таковых при введении гуанидина, наличие которого не сказывается на природе замедленной стадии (уравнение (1)) [3]. С учётом того, что величины дробных зарядов на атомах азота гуанидина и фенилбигуанидина достаточно близки, этот результат можно считать достаточно неожиданным, если принять, что за адсорбцию молекул указанных веществ на железе ответственно донорно – акцепторное взаимодействие азота с железом.
Рассмотрим картину, наблюдаемую в смешанном растворителе, содержащем 50 масс. % этиленгликоля. В фоновых растворах, не содержащих ФБГ картина, остаётся прежней (таблица 2). Изменяется лишь незначительно, величина тафелевских наклонов – dE/dlgik и dη/dlgi.
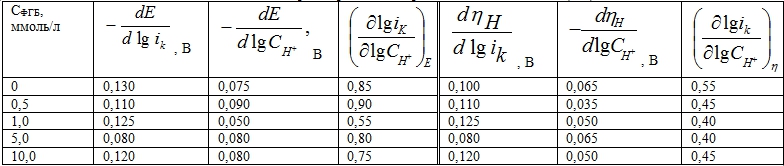
Таблица 2 - Влияние концентрации фенилбигуанидина на кинетические параметры РВВ в растворах НС1, в водно-этиленгликолевом растворителе, содержащем 50 масс. % С2Н4(ОН)2
Однако, несмотря на то, что природа разряжающихся доноров протонов и сольватирующих поверхность железа молекул (Н2О) остаётся прежней, влияние ФБГ принципиально изменяется. В средах со смешанным растворителем введение фенилбигуанидина и изменение его концентрации более, чем на порядок, не оказывает влияния на природу замедленной стадии (реакция (1)). В присутствии гуанидина контролирующей скорость РВВ в тех же средах на железе становилась стадия рекомбинации (2) [4]. Таким образом, вновь замена гуанидина на фенилбигуанидин кардинально меняет ситуацию.
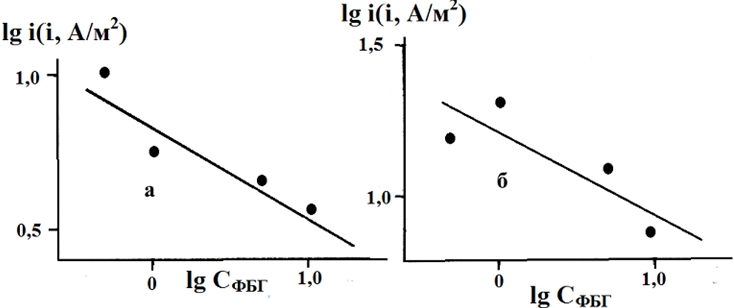
Рис. 2 - Влияние концентрации фенилбигуанидина на скорость реакции выделения водорода из водных растворов х М НСl + (1 – х) М LiCl с х = 0,1 моль/л при постоянном потенциале (а), равном 0,35 В и перенапряжении (б), равном 0,35 В.
Порядок реакции по фенилбигуанидину при Е = -0,35 В и η = 0,35 В в растворах с х = 0,1 моль/л равен -0,30 (рис. 2).
Таким образом, показано, что влияние ФБГ на кинетику РВВ существенно отличается от такового для гуанидина, в частности, наблюдается смена лимитирующей стадии процесса катодного выделения водорода при введении ФБГ уже в малых количествах, а также порядки реакции по ФБГ в указанных растворителях различной природы имеют близкие значения и характеризуют добавку как ингибитор, поскольку порядки имеют отрицательные значения. В общем же, катодный процесс имеет особую роль в электрохимической кинетике, так как на основе казалось бы простейшей электрохимической реакции строятся теоретические основы большей части всей электрохимии, поэтому углубление знаний в этом направлении будет несомненно способствовать развитию, как отдельных аспектов электрохимии, так и смежных с ней наук.
Выводы:
- Реакция выделения водорода в рассматриваемых средах протекает в условиях кинетического контроля процесса.
- При введении ФБГ в фоновые водные растворы происходит смена природы лимитирующей стадии РВВ с замедленного разряда на замедленную рекомбинацию, а затем на лимитирующую латеральную диффузию.
- Введение ФБГ в фоновые растворы со смешанным водно-этиленгликолевым растворителем (50 масс. % воды) во всём изученном концентрационном интервале не происходит смены природы лимитирующей стадии процесса выделения водорода, замедленной остаётся стадия разряда.
- В рассматриваемых растворителях порядки реакции по ФБГ имеют отрицательные значения, что характеризует эту добавку как ингибитор катодного действия.
Литература
- Вигдорович В.И., Цыганкова Л.Е., Дьячкова Т.П. Влияние анодной поляризации на диффузию водорода через стальную мембрану в этиленгликолевых растворах // Электрохимия. 2002. Т. 38. № 6. C. 719 – 724.
- Tsygankova L.E., Vigdorovich V.I., Zarapina I.V. Hydrogen diffusion through a Steel membrane in the Water-ethylene Glycol solution containing pyridine in conditions of the cathodic polarization // J. Electroanalyt. Chem. 2009, T. 636. №112. P 24 – 29.
- Vigdorovich V.I., Tsygankova L.E., Balybin D.V. Influence of guanidine on kinetics of hydrogen evolution on iron and its diffusion through steel membrane in acidic chloride media // J. Electroanalyt. Chem. 2011. T. 653. №1. P. 1 – 6.
- Вигдорович В.И., Цыганкова Л.Е., Балыбин Д.В., Крыльский Д.В., Яковлева В.А. Влияние гуанидина на выделение и диффузию водорода // Вестник Тамбовского государственного технического университета. 2010. Т. 16. №1. с. 94 – 107.
References
- Vigdorovich V.I., Cygankova L.E., D'jachkova T.P. Vlijanie anodnoj poljarizacii na diffuziju vodoroda cherez stal'nuju membranu v jetilenglikolevyh rastvorah // Jelektrohimija. 2002. T. 38. № 6. C. 719 – 724.
- Tsygankova L.E., Vigdorovich V.I., Zarapina I.V. Hydrogen diffusion through a Steel membrane in the Water-ethylene Glycol solution containing pyridine in conditions of the cathodic polarization // J. Electroanalyt. Chem. 2009, T. 636. №112. P 24 – 29.
- Vigdorovich V.I., Tsygankova L.E., Balybin D.V. Influence of guanidine on kinetics of hydrogen evolution on iron and its diffusion through steel membrane in acidic chloride media // J. Electroanalyt. Chem. 2011. T. 653. №1. P. 1 – 6.
- Vigdorovich V.I., Cygankova L.E., Balybin D.V., Kryl'skij D.V., Jakovleva V.A. Vlijanie guanidina na vydelenie i diffuziju vodoroda // Vestnik Tambovskogo gosudarstvennogo tehnicheskogo universiteta. 2010. T. 16. №1. s. 94 – 107.