THE MICROBIOCENOSIS OF THE ORAL CAVITY IN ORTHODONTIC PATIENTS
Жанабилов А.А. 1, Мухтарова К.С. 2, Тулеутаева С.Т. 3, Жармагамбетова А.Г. 4
1Студент 4-го курса,
2ассистент кафедры,
3кандидат медицинских наук, доцент,
4докторант 1-го года обучения,
Карагандинский Государственный Медицинский Университет
МИКРОБИОЦЕНОЗ ПОЛОСТИ РТА У ОРТОДОНТИЧЕСКИХ ПАЦИЕНТОВ
Аннотация
В статье рассмотрено – изменение микробиологического пейзажа у ортодонтических больных. Наличие в полости рта ортодонтического аппарата усложняет условия для ее самоочищения, в связи с чем, возрастает риск появления очагов деминерализации эмали вокруг брекетов. С целью уточнения причин развития деминерализация было обследовано 25 пациентов в возрасте от 12 до 17 лет, которым проводилось микробиологическое обследование полости рта на разных этапах лечения. Ключевые слова: ортодонтическое лечение, микробиоценоз, зубной налет, микроорганизмы.Zhanabilov A.A.1, Mukhtarov K.S.2, Teleutaia S.T.3, Zharmagambetova A.G.4
Student 4-year, assistant Department, candidate of medical Sciences, associate Professor, doctorant 1st year of study, Karaganda State Medical University
THE MICROBIOCENOSIS OF THE ORAL CAVITY IN ORTHODONTIC PATIENTS
Abstract
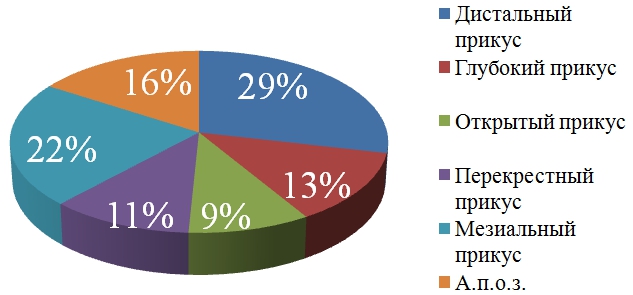
The article considers the changing microbiological landscape in orthodontic patients. The presence of oral orthodontic apparatus complicates the conditions for its self-purification, and therefore, increase the risk of foci of demineralization of the enamel around the brackets. To clarify the reasons for the development of demineralization were examined 25 patients aged 12 to 17 years who were microbiological examination of the oral cavity at different stages of treatment. Keywords: orthodontic treatment, moreover, plaque, microorganisms. Актуальность Зубочелюстные аномалии – это врожденные или приобретенные нарушения развития зубочелюстной системы: аномалии зубов, челюстных костей и аномалии соотношения зубных рядов. Применение несъемной ортодонтической техники значительно расширило возможности для лечения зубочелюстных аномалий. Стремление пациентов к красивой здоровой улыбке, высокая эффективность новых лечебных технологий привело в настоящее время к применению несъемной аппаратуры более чем в 84% случаев [1]. Вместе с тем, в период лечения пациентов с зубочелюстных аномалий при использовании несъемной ортодонтической техники, возрастает риск появления очагов деминерализации эмали вокруг брекетов [2]. Это связано с ухудшением процессов самоочищения и гигиены, снижением резистентности органов и тканей полости рта, интенсивным скоплением зубной бляшки вокруг брекетов, ограниченным доступом ротовой жидкости к вестибулярной поверхности зубов во время длительного ортодонтического лечения [3]. Фиксированные на длительный срок элементы несъемной аппаратуры, затрудняют гигиенический уход за полостью рта, делая эту процедуру даже для дисциплинированных пациентов трудной и утомительной [4]. По этой причине отмечается высокое микробное обсеменение поверхностей зубов и ортодонтических аппаратов с появлением обширного мягкого налета, что в свою очередь, усложняет процессы реминерализации эмали и ведет к нарушению ее целостности, приводит к развитию патологии твердых тканей зубов и пародонта. В результате брекеты, дуги, кольца, лигатуры аккумулируют зубной налет, содержащий большое количество микроорганизмов, продуцирующих органическую кислоту, что приводит к снижению рН и выходу кальция и фосфора из эмали зуба [5]. Именно в зубном налёте локализуется основная масса микроорганизмов полости рта, 70% объёма зубного налёта составляют микробы. В 1 мг его сухой массы содержится около 250 млн. микробов. В современной стоматологии очень важна профилактика кариеса зубов, которая направлена на снижение количества бактерий и повышение резистентности зуба к различным воздействиям, поскольку основным этиологическим фактором кариеса зубов является патогенная микрофлора полости рта и продукты ее метаболизма [6]. Результаты исследований доказывают, что во время ортодонтического лечения с помощью несъемной техники изменяется качественный и количественный состав микрофлоры полости рта: увеличивается количество и частота высеваемости отдельных видов, обнаруживаются нетипичные для полости рта штаммы микроорганизмов, симбиотическая микрофлора перестает выполнять роль барьера для нерезидентов, активно вегетируют патогенные стафилококки и дрожжеподобные грибы [7]. Несмотря на очевидную актуальность, проблема распространения условно-патогенных и патогенных микроорганизмов при лечении зубочелюстых аномалий на несъемной ортодонтической аппаратуре остается недостаточно изученной. Современные генетические исследования показали, что 95-99% нормальной микрофлоры пока неизвестны и не поддаются культивированию. Кроме бактерий в полости рта находятся археи, грибы, простейшие и различные вирусы [8]. Определение облигатной и факультативной микрофлоры полости рта в процессе ортодонтического лечения несъемной ортодонтической аппаратурой в различных его фазах остается актуальным с целью профилактики кариеса зубов и заболеваний пародонта. Целью исследования явилось изучение влияния ортодонтического лечения пациентов в возрасте от 12 до 17лет с зубочелюстными аномалиями на микробиоценоз полости рта. Для достижения поставленной цели были определены следующие задачи: - изучить состояние полости рта у ортодонтических больных, - изучить микробиоценоз полости рта на всех этапах ортодонтического лечения на основании микробиологических методов исследования. Материалы и методы исследования Стоматологическое обследование проводилось 63 пациентам с зубочелюстными аномалиями, возраст обследуемых варьировал от 12 до 17 лет. Стоматологическое обследование осуществлялось методом опроса и осмотра с использованием стандартного набора стоматологических инструментов при искусственном освещении. Стоматологическое обследование включало оценку состояния гигиены полости рта по индексу OHI-S (GreenJ.C., VermillionJ.R., 1964), для изучения степени тяжести гингивита использовали папиллярно-маргинально-альвеолярный (РМА) индекс в модификации Pаrmа, так же проводилась проба Шиллера-Писарева (Д. Сварков, Ю. Писарев, 1963). Микробиологическое исследование выполнено у 25 пациентов в следующей последовательности: бактериоскопия мазка из зубного налета, окрашенного по методу Грама и Бурри, при этом оценивали морфологические и тинкториальные свойства микроорганизмов. Для идентификации микроорганизмов использовали бактериологический метод исследования. Первичный посев проводился по методу Гоулди на мясо-пептонный агар, кровяной агар, Сабуро-агар, лактагар, Эндоагар. Идентификация выделенных микроорганизмов проводилась до рода. Статистическая обработка данных проводилась с использованием стандартных программы SPSS v17.0 for Windows. Описательная статистика, выполнялась для всех анализируемых показателей в зависимости от типа переменной. Качественные признаки представлялись в виде долей (%) и абсолютных чисел. Количественные признаки описывались в виде среднего значения и стандартного отклонения. Результаты исследования и их обсуждение В структуре зубочелюстных аномалий аномалии прикуса встречались у 84,1 % обследованных: дистальный прикус 28,6%, глубокий прикус 12,7%, открытый прикус 9,5%, перекрестный прикус 11,1%, мезиальный прикус 22,2% (рис.1).Рис. 1 - Частота встречаемости зубочелюстных аномалий
Распределение по полу показало, что зубочелюстные аномалий чаще встречаются у мальчиков (52,4%), чем у девочек (47,6%). В ходе стоматологических обследований 63 детей с зубочелюстными аномалиями до ортодонтического лечения было выявлено, что средний показатель гигиенического индекса OHI-S (Green J.C., Vermillion J.R., 1964) составил M = 1,4, SD = 0,2, который говорит об удовлетворительной гигиене полости рта. Так же была проведена проба Шиллера-Писарева, у 30% пациентов результат был положительным, у 70% пациентов отрицательным. Индекс РМА равен M=32,3%, SD=4,6, что свидетельствует о средней степени тяжести гингивита. После ортодонтического лечения у детей наблюдалась улучшение параметров (табл. 1).Таблица 1 - Показатели гигиены полости рта и тяжести гингивита
| Индексы | До лечения | После лечения |
| OHI-S | M=1,4, SD=0,2 | M=0,6, SD= 0,3 |
| РМА | M=32,3%, SD=4,6 | M=25%, SD= 3,2 |
Таблица 2 – Анализ результатов бактериоскопии мазка
| Микрофлора | До лечения | Во время лечения | После лечения | |||
| N | % | N | % | N | % | |
| Stаphylоcоcci | 25 | 100 | 25 | 100 | 25 | 100 |
| Mutаnsstrеptоcоcci (MS) | 25 | 100 | 25 | 100 | 25 | 100 |
| Cаndidа | 13 | 52 | 24 | 96 | 4 | 16 |
| Lаctоbаcill | 15 | 60 | 23 | 92 | 5 | 20 |
Таблица 3 – Соотношение Mutаns strеptоcоcci и Lаctоbаcillus
| Микрофлора | До лечения | Во время лечения | После лечения |
| КОЕ / мл | КОЕ / мл | КОЕ / мл | |
| Mutаnsstrеptоcоcci (MS) | M=105 SD=874 | M=107 SD=645 | M=104 SD=1274 |
| Lаctоbаcillus | M=105 SD=1265 | M=107 SD=265 | M=103 SD=2016 |
Литертура
- Каливраджиян Э.С. Влияние несъемного протезирования на микрофлору полости рта /Э.С.Каливраджиян, А.В.Подопригора //Материалы 16 Всероссийской науч.- практ. конф.: труды 11 съезда стоматолгической ассоциации России и 8 съезда стоматологов России.– М., 2006. –Т. 78.– С.274-277.
- Каливраджиян Э.С. Влияние несъемных протезов на слизистую оболочку полости рта /Э.С.Каливраджиян, А.В.Подопригора //Материалы 16 Всероссийской науч.- практ. конф.: труды 11 съезда стоматолгической ассоциации России и 8 съезда стоматологов России.– М., 2006. –Т. 78.– С.277-280.
- Каливраджиян Э.С. Сравнительная оценка состояния микрофлоры полости рта при различных видах несъемного протезирования /Э.С.Каливраджиян, А.В.Подопригора //Прикладные информационные аспекты медицины. Воронеж, 2006.– Т.96, №1.–С. 137-142.
- Filoche S., Anderson S., Sissons C. Biofilm growth of Lactobacillus sp. is
- promoted by Actinomyces sp. and Streptococcus mutans. Oral Microbiol Immunol 2004;19:5:322—326.
- Bauenneister C.-D. Микробиологическая диагностика заболеваний тканей пародонта. Новое в стоматологии 2003;7:115:27—30.
- Aas J.A., Paster В.J., Stokes L.N. et al. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol 2005;43:11:5721—5732
- Борисов Л.Б., Фрейдлин И.С. Микробиология и иммунология стоматологических заболеваний. Медицинская микробиология, вирусология, иммунология. М: МИА 2001;684—712.
References
- Kalivradzhiyan E.S. Vliyanie nesemnogo protezirovaniya na microfloru polosti rta / E.S. Kalivradzhiyan, A.V. Podoprigora// Materialy 16 Vserossiiskoi nauch.- prakt. konf.: trudy 11 sezda stomatologicheskoi associacii Rossii I 8 sezda stomatologov Rossii.- М., 2006. –Т. 78.– С.274-277.
- Kalivradzhiyan E.S. Vliyanie nesemnogo protezirovaniya na microfloru polosti rta / E.S. Kalivradzhiyan, A.V. Podoprigora// Materialy 16 Vserossiiskoi nauch.- prakt. konf.: trudy 11 sezda stomatologicheskoi associacii Rossii I 8 sezda stomatologov Rossii.- М., 2006. –Т. 78.– С. 277-280.
- Kalivradzhiyan E.S. Sravnitel’naya ocenka sostoyaniya microflory polosti rta pri razlichnyh vidah / E.S. Kalivradzhiyan, A.V. Podoprigora// Prikladnye informacionnye aspekty mediciny. Voronezh, 2006.– Т.96, №1.–С. 137-142.
- Kalivradzhiyan E.S. Sravnitel’naya ocenka sostoyaniya microflory polosti rta pri razlichnyh vidah / E.S. Kalivradzhiyan, A.V. Podoprigora// Prikladnye informacionnye aspekty mediciny. Voronezh, 2006.– Т.96, №1.–С. 137-142
- Filoche S., Anderson S., Sissons C. Biofilm growth of Lactobacillus sp. Is promoted by Actinomyces sp. and Streptococcus mutans. Oral Microbiol Immunol 2004;19:5:322—326.
- Bauenneister C.-D. Microboilogicheskaya diagnostic zabolevanii tkanei paradonta. Novoe v stomatologii 2003;7:115:27—30.
- Aas J.A., Paster В.J., Stokes L.N. et al. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol 2005;43:11:5721—5732
- Borisov L.B., Freidlin I.S. Microbiologia I immunologia stomatologicheskih zabolevanii. Medicinskaya microbiologia, virusologia, immunologia М: МIА 2001;684—712.