QUANTUM-MECHANICAL CALCULATION OF FRACTIONAL CHARGES ON THE ATOMS IN THE MOLECULES OF GUANIDINE AND ITS DERIVATIVES
Балыбин Д.В.1, Попова Е.Д.2, Калинушкина Е.Ю.3
1Кандидат химических наук, старший преподаватель кафедры аналитической и неорганической химии,
2Студентка ,
3Аспирантка ,
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина
КВАНТОВО-МЕХАНИЧЕСКИЙ РАСЧЁТ ДРОБНЫХ ЗАРЯДОВ НА АТОМАХ В МОЛЕКУЛАХ ГУАНИДИНА И ЕГО ПРОИЗВОДНЫХ
Аннотация
В данной работе произведен квантово-механический расчет дробных зарядов на атомах в молекулах и ионах гуанидина и его аналогов. Показано, что различные заместители не оказывают существенного влияния на распределение дробного заряда на атомах азота.
Ключевые слова: заряд, дробный заряд, квантово-механические расчеты.
Balybin D.V.1, Popova E.D.2, Kalinushkina E.Y. 3
1 Candidate of chemical sciences, assistant professor of analytical and inorganic chemistry department,
2Student,
3Graduate,
Tambov State University named after G.R. Derzavin.
QUANTUM-MECHANICAL CALCULATION OF FRACTIONAL CHARGES ON THE ATOMS IN THE MOLECULES OF GUANIDINE AND ITS DERIVATIVES
Abstract
In this work produced a quantum mechanical calculation of fractional charges on the atoms in the molecules and ions of the guanidine and its analogues. It is shown that various substituents do not have a significant effect on the distribution of fractional charge on the nitrogen atoms.
Keywords: charge, fractional charge, quantum-mechanical calculations.
Высокая основность азотсодержащих соединений обусловливает существенное повышение рН (водные растворы) или кислотности (неводные среды) систем, в которых протекают многочисленные химические или электрохимические процессы. Если константы кислотности или основности достаточно большого количества соединений (например, аминов [1]) в водных средах известны [2], то подобные величины для неводных растворов, как правило, не оценивались.
В ряде работ [3-6, 8] было проведено исследование органических однокислотных оснований различной силы на кинетику реакции выделения водорода на железе. В качестве рассматриваемых веществ были выбраны для расчёта молекулы следующих соединений:
где А – гуанидин, Б – фенилбигуанидин (ФБГ), В – орто-фторфенилбигуанидин (о-ФФБГ), Г – мета-нитрофенилбигуанидин (м-НФБГ), Д – пиридин.
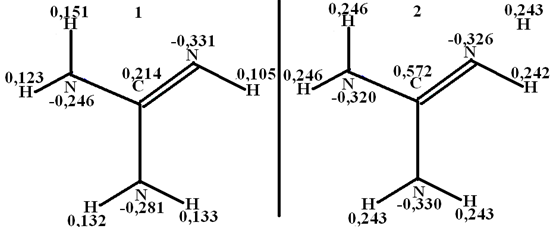
Электронную структуру молекулы гуанидина, ФБГ, о-ФФБГ, м-НФБГ и соответствующих катионов рассчитывали, используя полуэмпирические методы расчета. В них уравнение Шрёдингера решается для молекул с использованием определенных приближений и упрощений. На рис. 1 представлена диаграмма распределения зарядов в молекуле гуанидина и катионе гуанидиния.
Рис. 1 - Распределение электронной плотности в молекуле гуанидина (1) и катионе гуанидиния (2)
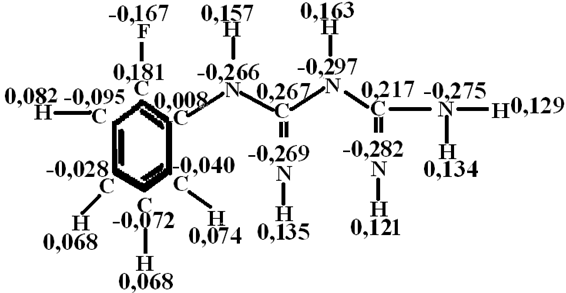
На рис. 2 представлен аналогичный расчёт молекулы орто-фторфенилбигуанидина.
Рис. 2 - Распределение электронной плотности в молекуле орто-фторфенилбигуанидина
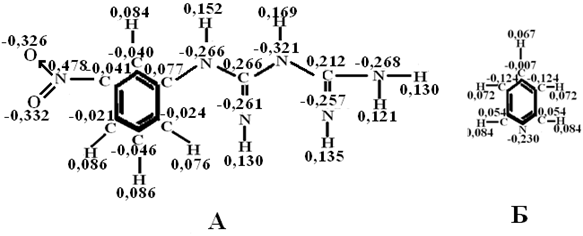
Для сравнительной оценки дробных электрических зарядов на атомах рассматриваемых структур был произведён квантово – механический расчёт значений соответствующих величин для молекулы пиридина (рис. 3 Б). Численные значения зарядов на атомах азота в ФБГ, о-ФФБГ и м-НФБГ практически не различаются [8], во всяком случае, различия эти не проявляются в кислотно-основных свойствах рассматриваемых производных гуанидина.
Рис. 3 - Распределение электронной плотности в молекулах мета-нитрофенилбигуанидина (А) и пиридина (Б)
Резюмируя результаты квантово – механического расчёта, можно сказать, что вопреки ожиданиям, заряды на атомах азота, орто-фторфенилбигуанидина (рис. 2) и мета-нитрофенилбигуанидина (рис. 3 А) несколько меньше, чем в молекуле гуанидина. Таким образом, имеет место предположение о том, что ФБГ, о-ФФБГ, м-НФБГ существенно не различаются по основности, которая несколько ниже, чем у гуанидина, но значительно выше, чем у пиридина [2] , то есть имеет место неравенство
рКаNH2(NH2)2+ > (рКаФБГH+ ≈ рКао-ФФБГH+ ≈ рКам-НФБГH+) > рКаС5Н5NH+
и (11,0 - 13,6) > рКа,i > 4,2 [2].
В силу этого предыдущее неравенство можно заменить следующим
рКаФБГH+≈ рКао-ФФБГH+≈ рКам-НФБГH+ ≈ 11…13,6,
то есть протонирование гуанидина, ФБГ, о-ФФБГ и м-НФБГ практически идентично.
Литература
- Измайлов Н.А.,1964. Электрохимия растворов. // М.: Химия. 488 с.
- Альберт А., Сержент А.Е.,1964. Константы ионизации кислот и оснований. // М.: Химия. 179 с.
- Цыганкова Л.Е., Протасов А.С., Балыбин Д.В., Макольская Н.А., 2009. Определение истинных констант реакции выделения водорода и его твердофазной диффузии в условиях адсорбции ингибитора.// Коррозия: материалы, защита. № 10. С. 34 – 38.
- Вигдорович В.И., Цыганкова Л.Е., Балыбин Д.В., 2011. Кинетика реакции выделения водорода на железе и его диффузия через мембрану из этиленгликолевых растворов. // Физикохимия поверхности и защита материалов. Т 47. № 5.С. 103 – 108.
- Vigdorovich V.I., Tsygankova L.E., Balybin D.V., 2011. Influence of guanidine on kinetics of hydrogen evolution reaction on iron and its diffusion through steel membrane in acidic chloride media // Journal of Electroanalytical Chemistry. V. 653. №1. P. 1 – 6.
- Вигдорович В.И., Агладзе Т.Р.,1975. Сольватационные эффекты в бинарных смесях органический растворитель – вода и кинетика электродных процессов // Электрохимия. Т. 11. № 1. С. 85 – 90.
- Дамаскин Б.Б., 1985. Электродные процессы в растворах органических соединений // М.: Изд-во МГУ.
- Балыбин Д.В.,2011. Влияние гуанидина и фенилбигуанидина на кинетику реакции выделения водорода на железе и его диффузию через стальную мембрану в этиленгликолевых растворах НСl // Дисс…канд. хим. наук. Тамбов. 197 с.