ON THE POSSIBILITY OF USING BASIDIOMYCETE INONOTUS OBLIQUUS FOR BIOTECHNOLOGICAL PRODUCTION OF BIOLOGICALLY ACTIVE SUBSTANCE HISPIDIN
ON THE POSSIBILITY OF USING BASIDIOMYCETE INONOTUS OBLIQUUS FOR BIOTECHNOLOGICAL PRODUCTION OF BIOLOGICALLY ACTIVE SUBSTANCE HISPIDIN
Abstract
The presence and dynamics of hispidin (HP) content in the nutrient medium during cultivation of the higher fungus Inonotus obliquus under submerged conditions were evaluated. The presence of HP in the nutrient medium samples was determined by an original method using an enzyme luminescent system from the luminescent mycelium of the basidiomycete Armillaria borealis. The HP content was calculated from the values of the maximum intensity of light emission recorded during the luminescence reaction with the medium samples. It was shown that under the used conditions of submerged cultivation (composition and volume of nutrient medium, volume of inoculum, constant radial mixing of the cultivated volume, temperature and time of cultivation) there was observed the growth of mycelium of I. obliquus in the form of spherical pellets with numerous surface growths – hyphae. It was established that in the process of growth, the basidiomycete produces and secretes HPs into the nutrient medium. The presence of HP in the nutrient medium is detected on the 7th day of cultivation, the content of HP in the nutrient medium increases and reaches maximum values on the 11th-13th day of cultivation and its concentration at this time can be 0.5-0.7 mg per 1 ml of medium. Transfer of grown mycelium pellets into a fresh volume of nutrient medium and continuation of cultivation is again accompanied by the accumulation of HP in the medium. The totality of the obtained data suggests the possibility of using basidiomycete I. obliquus for biotechnological production of HP, a valuable bioactive substance for biomedical applications. obliquus for biotechnological production of HP, a valuable bioactive substance for biomedical applications.
1. Введение
Базидиомицет Inonotus obliquus (трутовик скошенный, березовый гриб, медицинский гриб чага) содержит большой набор биоактивных веществ и со времен Авиценны используется в народной медицине . Данный гриб внесен в Государственную фармакопею РФ , официально разрешен к применению в медицинской практике и в настоящее время рассматривается в качестве неспецифического средства для лечения ряда заболеваний желудочно-кишечного тракта (в частности, гастритов, язвенной болезни желудка и двенадцатиперстной кишки, полипозов) и предраковой терапии .
Известно, что I. obliquus продуцирует ряд биологически активных полифенольных пигментов класса стирилпиронов, в том числе гиспидин (ГП), являющийся ценным соединением для биомедицинского применения , . В работах многих авторов сообщается, что синтезируемый высшими грибами поликетид ГП обладает положительными фармакологическими эффектами (в частности, антиоксидантным, противовоспалительным и противоопухолевым) , , , . Исходя из этого, базидиомицет I. obliquus можно рассматривать в качестве перспективного источника для получения ГП.
Однако выделение ГП из природной биомассы гриба I. obliquus (бесплодная часть грибницы – склероций) сопряжено с рядом объективных недостатков и трудностей. Известно, что рост гриба в природных условиях и накопление в его биомассе целевых продуктов происходит очень медленно и может составлять до 10-ти и более лет , . В свою очередь, это сопряжено с проблемой воспроизводимости природного сырья. Содержание целевого продукта (продуктов) в биомассе гриба, выросшего в неконтролируемых природных условиях, может существенно различаться. Наблюдающаяся в последние годы крупномасштабная заготовка чаги и ее экспорт в зарубежные страны (прежде всего, в Китай, Корею и Японию) может значительно снизить (или полностью уничтожить) популяцию этого ценного гриба в России.
Для устранения изложенных выше проблем рациональным решением является переход на биотехнологию искусственного культивирования базидиомицета I. obliquus. К наиболее важным преимуществам такого подхода относятся: выращивание биомассы грибного мицелия в контролируемых условиях, возможность их оптимизации для увеличения выхода биомассы и содержания в ней целевого продукта (продуктов), снижение временных затрат на получение биомассы, решение проблемы воспроизводимости исходного сырья. При этом, в отличие от выделения целевых продуктов из природной биомассы I. obliquus, при работе с культурой гриба появляется возможность упрощения процедуры их извлечения из биомассы и питательной среды. Поскольку известно, что ГП является вторичным метаболитом высших грибов и растений , при культивировании базидиомицета I. obliquus в погруженных условиях он может секретироваться в питательную среду. Целью представленной работы являлась экспериментальная оценка наличия и динамики содержания ГП в питательной среде при культивировании базидиомицета I. obliquus в погруженных условиях.
2. Материалы и методы исследований
В исследованиях использовали мицелий базидиомицета I. obliquus (штамм IBSO 2430) из Коллекции микроорганизмов CCIBSO 836 Института биофизики ФИЦ КНЦ СО РАН (Красноярск). Образцы мицелия получали при культивировании гриба в погруженных условиях. Выращивание биомассы проводили в конических колбах объемом 300 мл, содержащих 100 мл жидкой PDB среды (картофельный экстракт – 4 г/л, глюкоза – 20 г/л) (HiMedia Laboratory, Индия). Выбор питательной среды определялся тем, что по нашим предварительным данным в ней наблюдался достаточно быстрый рост биомассы мицелия. Инокулятом являлся мицелий I. obliquus, предварительно выращенный на агаризованной PDB среде в чашках Петри (TTP, Швейцария) при температуре 24°С (термостат ТСО 1/80 СПУ, Россия). Пленочный мицелий в стерильных условиях (ламинар Labconco, США) срезали с поверхности твердой питательной среды, протирали через металлическое сито (размер пор 1/1 мм). Измельченную биомассу вносили в жидкую PDB среду, объем инокулята составлял 2-5% от объема среды. Культивирование проводили при температуре 25°С и постоянном перемешивании со скоростью 140-170 об/мин (шейкер-инкубатор ES-20, BIOSAN, Латвия).
В процессе культивирования через определенные промежутки времени в стерильных условиях (ламинар Labconco) отбирали пробы питательной среды по 500 мкл. Пробы центрифугировали при 16000g (Centrifuge 5415R, Eppendorf, Германия) в течение 5 мин при 4°С для удаления мелких фрагментов мицелия. Супернатанты отбирали и определяли в них наличие ГП с помощью ферментной люминесцентной системы, выделенной из светящегося мицелия базидиомицета Armillaria borealis . В настоящее время считается доказанным, что ГП является прекурсором люциферина светящихся высших грибов и при функционировании грибной люминесцентной системы сначала преобразуется НАДФН-зависимой гидроксилазой в люциферин (3-гидроксигиспидин), который затем окисляется люциферазой с излучением кванта видимого света . Люминесцентный метод тестирования ГП является высокочувствительным и позволяет быстро (в течение нескольких минут) выявлять ГП в биологических пробах с пределом обнаружения 5,4⋅10–5 мкМ (1,3⋅10–11 г) . При этом для сравнения следует сказать, что наиболее часто применяемый в лабораторных условиях метод тестирования ГП в грибных экстрактах основан на регистрации времени его удерживания на колонках при проведении ВЭЖХ – достаточно сложной и многостадийной процедуры, требующей специализированного хроматографического оборудования и значительных затрат времени . Люминесцентным методом наличие ГП определяли также в биомассе грибного мицелия. Для этого выросшие пеллеты мицелия извлекали из питательной среды, промывали деионизированной (ДИ) водой (Milli-Q system, Millipore, США) для удаления остатков среды и метаболитов и измельчали протиранием через сито (см. выше). К измельченной биомассе добавляли ДИ воду в соотношении 1:2 (вода:биомасса, объем/объем), образец помещали в микроволновую печь MW 712BR (Samsung, Малайзия) и нагревали при 800 Вт до закипания. После этого образец охлаждали на льду и центрифугировали при 16000g (Centrifuge 5415R) в течение 10 мин при 4°С. Супернатант отбирали и использовали для люминесцентного определения ГП. Тестирование проводили следующим образом. Прозрачные пластиковые пробирки (Eppendorf, Германия), содержащие 50 мкл препарата ферментной люминесцентной системы, помещали в люменометр (Glomax® 20/20, Promega BioSystems Sunnyvale, Inc., США) и регистрировали исходный уровень свечения. Затем к препарату добавляли 5 мкл раствора 10 мМ НАДФН (Serva, Германия), приготовленного in situ в ДИ воде, и регистрировали развитие люминесцентного сигнала. Наличие светового сигнала после добавки НАДФН свидетельствует о наличии в препаратах люминесцентной системы A. borealis эндогенного ГП, который утилизируется в реакции излучения, и является показателем функциональной активности ферментов системы . После снижения интенсивности светового сигнала до стационарного уровня к системе добавляли 5 мкл образца питательной среды (или экстракта из мицелия) и вновь регистрировали развитие светового сигнала, отражающего наличие ГП в тестируемом образце. Интенсивность свечения регистрировали в режиме 1 измерение в 1 сек и выражали в относительных единицах. Концентрацию ГП в тестируемых образцах определяли по уровню максимальной интенсивности световой эмиссии, используя калибровочный график, полученный ранее с использованием растворов с известной концентрацией ГП высокой степени чистоты (Sigma-Aldrich, США) .
3. Результаты и их обсуждение
Как показали исследования, при использованных условиях глубинного культивирования базидиомицета I. obliquus в жидкой питательной PDB среде наблюдается рост грибного мицелия в виде шарообразных пеллет с большим количеством поверхностных выростов – гиф (рис. 1).

Рисунок 1 - Внешний вид пеллет мицелия I. obliquus на 15-е сутки культивирования гриба в погруженных условиях
Примечание: регистрация изображения с помощью фотокамеры PowerShot S50 (Canon, Япония); масштабная линейка – 5 мм
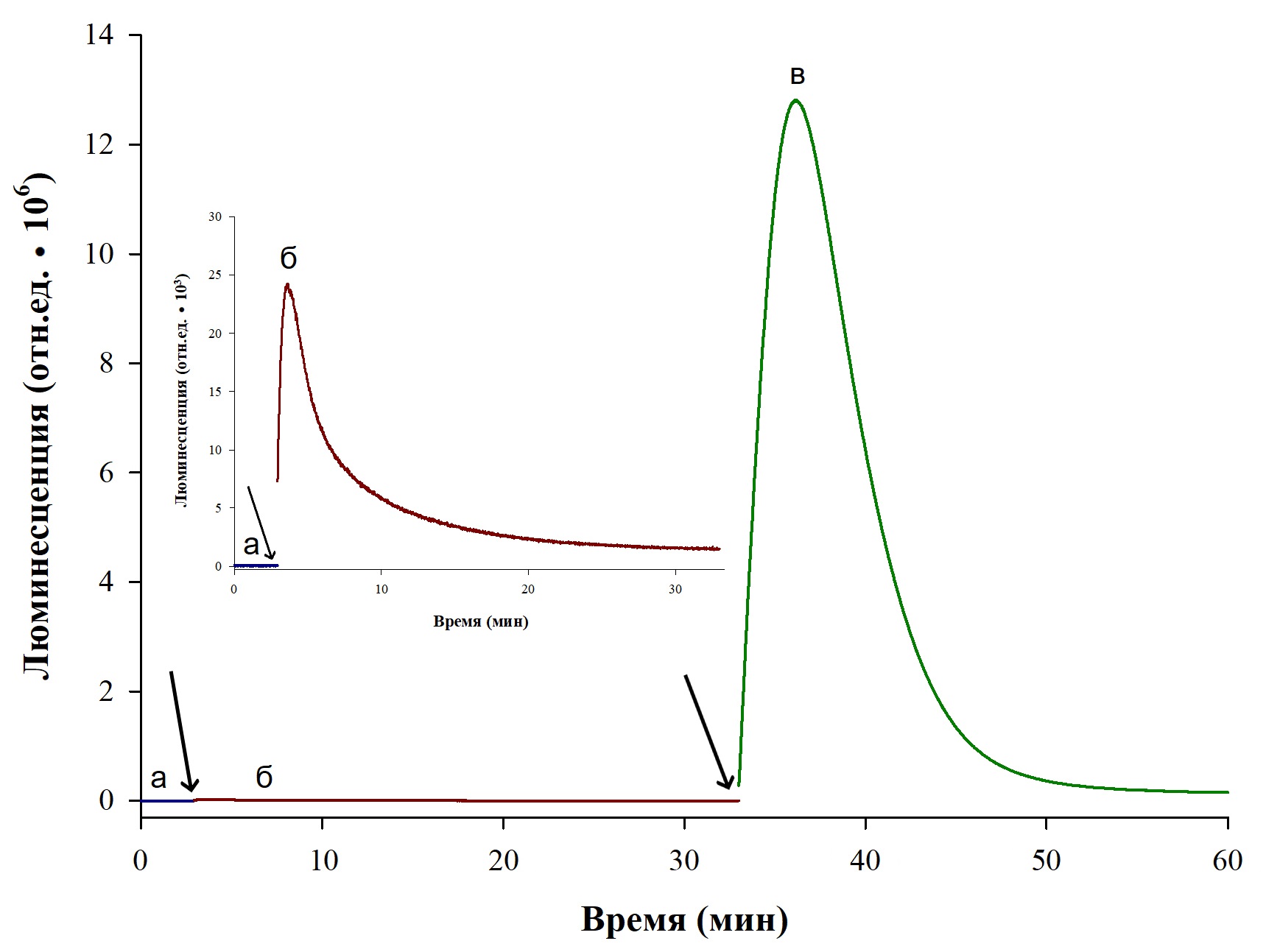
Рисунок 2 - Стимуляции свечения люминесцентной системы A. borealis добавками НАДФН и питательной среды при глубинном культивировании гриба I. obliquus
Примечание: а – исходный уровень свечения, б – уровень свечения после добавки 5 мкл раствора 10 мМ НАДФН, в – интенсивность и динамика светового сигнала после добавления 5 мкл образца питательной среды. Стрелками показаны моменты внесения ингредиентов. На вставке приведены увеличенные фрагменты а и б

Рисунок 3 - Уровень люминесценции, отражающий наличие и динамику накопления ГП в питательной среде при глубинном культивировании мицелия I. obliquus
Примечание: данные нормированы на максимальную интенсивность световой эмиссии в ряду измерений. На вставке увеличенный фрагмент уровней люминесценции образцов питательной среды на 7-9-е сутки культивирования гриба

Рисунок 4 - Внешний вид питательной PDB среды и пеллет мицелия I. obliquus на 15 сутки культивирования гриба в погруженных условиях
Примечание: регистрация изображения с помощью фотокамеры PowerShot S50 (Canon, Япония)
4. Заключение
Таким образом, совокупность полученных в работе данных позволяет высказать несколько общих выводов. Экспериментально показано, что культивирование высшего гриба I. obliquus в погруженных условиях сопровождается ростом шарообразных пеллет мицелия, которые продуцируют и секретируют в питательную среду ГП. При тестировании люминесцентным методом установлено, что максимальный уровень целевого продукта в среде наблюдается через две недели выращивания гриба и его концентрация в среде в это время может составлять 0,5-0,7 мг в 1 мл. Установлено, что при переносе выросших пеллет мицелия в свежий объем питательной среды и продолжении культивирования в ней вновь регистрируется накопление ГП. Высказано предположение, что выявляемое при люминесцентном тестировании снижение уровня ГП в питательной среде на длительных (более 2-х недель) сроках культивирования не связано с нарушениями продукции ГП в грибе и его секреции в среду. В целом, результаты проведенных исследований свидетельствуют в пользу применимости базидиомицета I. obliquus в биотехнологическом получении биоактивного вещества ГП для биомедицинских приложений.
