The Pathogenetic Role of Polymorphic Variants of Keratinocyte Proliferation and Differentiation Genes Alleles in Severe Acne Cases
The Pathogenetic Role of Polymorphic Variants of Keratinocyte Proliferation and Differentiation Genes Alleles in Severe Acne Cases
Abstract
Considering the role of pathological follicular hyperkeratosis in the acne development, it is relevant to study the pathogenetic mechanism of keratinocyte proliferation and differentiation, including determination of the pathogenetic role of regulatory genetic factors.
The aim of this study was to determine and analyse nucleotide sequence variants of keratinocyte proliferation and differentiation genes AP3B1, FERMT1, FERMT3, GBA, SUFU in patients with severe acne.
A prospective open-ended, non-randomized, single-center comparative study was conducted in the period 2017-2020. We observed 50 patients in the main group and 20 participants in the comparison group (a total of 70 people) aged 15 to 46 years (median: 22.1 [10.2; 25.4] years) under clinical conditions at the Department of Skin Diseases and Cosmetology named after N.I. Pirogov Russian State Medical University, Ministry of Health Care of Russia. The sample size was not preliminarily calculated.
Molecular genetic diagnostics was performed in all 50 patients of the study group and 20 conditionally healthy patients of the comparison group by next-generation DNA sequencing.
Analysis of the identified nucleotide sequence variants of keratinocyte proliferation and differentiation genes showed that severe acne cases probably have an association with polymorphic loci AP3B1, FERMT1, FERMT3, GBA, SUFU.
The conducted research allowed for the first time to identify polymorphic loci of keratinocyte proliferation and differentiation genes, which is probably the cause of actin cytoskeleton binding to the extracellular matrix, which ultimately leads to dysregulation of keratinocyte proliferative activity and formation of hyperkeratinization infundibulum.
1. Введение
Акне является одним из наиболее распространенных заболеваний кожи, которым страдают до 85% подросткового возраста и около 3% – взрослого населения , . Патогенетически значимыми факторами акне являются гиперандрогения, приводящая к гиперсекреции себума, гиперпролиферация и нарушение дифференцировки кератиноцитов, рост и активация Cutibacterium acnes (C. acnes) и развитие хронической воспалительной реакции , , . В результате адгезии кератиноцитов в верхней части выводного протока сально-волосяного фолликула (СВФ) формируется кератотическая пробка, которая закупоривает пилосебацитарные протоки с формированием микрокомедонов. Одними из патологический процессов, развивающихся при акне является фолликулярный гиперкератоз, абберантная десквамация и секреция медиаторов воспаления кератиноцитами. Сообщается, что кератиноциты инфраинфундибулума обладают повышенной способностью к метаболизму андрогенов, что подтверждает предположение о роли андрогенов в развитии гиперкератоза при акне. Установлено, что IL-1 участвует не только в иммунном ответе, но и играет роль в пролиферации кератиноцитов. Этот механизм реализуется посредством сигнальной трансдукции на рецептор IL-1, а также стимулирующем влиянии на факторы роста, в частности фактор роста сосудистого эндотелия (VEGF). Подчеркивается значение дисбаланса состава себума в развитии гиперкератоза. Katsuta Y. et al. (2009) обнаружено, что рецепторы N-метил-д- аспартата (N-methyld-Aspartate; NMDA) увеличивают внутриклеточную концентрацию ионов кальция и выработку IL-1α, которые связаны с аномальной фолликулярной кератинизацией, индуцированной олеиновой кислотой , . Важным аспектом патогенеза акне является участие кератиноцитов в воспалительной реакции. C. acnes активирует Toll-подобный рецептор (TLR)-2 и TLR-4 на кератиноцитах, что приводит к активации сигнальных каскадов, включая путь NF-κB и путь MAPK. Впоследствии кератиноциты продуцируют IL-1, IL-8, IL-6, гранулоцитарно–макрофагальный колониестимулирующий фактор (GM-CSF), TNF-α, матриксные металлопротеиназы (MMPs) и человеческий β-дефензин-2 (hBD-2) , , . В дополнение к TLR-2 и TLR-4, рецептор CD36, экспрессируемый на кератиноцитах, также участвует в распознавании C. acnes . После определения C. acnes CD36 кератиноциты начинают синтезировать активные формы кислорода (АФК), особенно супероксид анион, образующиеся из цитозольных ферментов NAD(P)H оксидаз. Эти АФК обеспечивают антибактериальный эффект и запускают реакцию воспаления , , , .
Данные о роли семейного анамнеза и возможного наследования акне подтверждались в ряде исследований о семейных случаях этого дерматоза, более частом его развитии у монозиготных близнецов, однако значение генетических ассоциаций до конца не известно. Так, He L. et al. (2014) выявил связь акне с TP63, который обеспечивает регуляцию и дифференцировку эпителиальных стволовых клеток . В другом исследовании авторы предположили ассоциацию развития акне с LGR6, который является медиатором сигнального пути WNT и обеспечивает функционирование и дифференцировку стволовых клеток сальной железы. Дополнительными ассоциированными генами были LAMC2, кодирующий основной компонент базальной мембраны и SPECC1L, кодирующий кросс-линк белок цитоскелета, играющий важную роль в клеточной адгезии и миграции .
Учитывая роль патологического фолликуллярного гиперкератоза в формировании угревой болезни, важным направлением исследований является изучение патогенетического механизма пролиферации и дифференцировки кератиноцитов, в том числе и влияние наследственных факторов.
Цель: определение и анализ вариантов нуклеотидной последовательности генов пролиферации и дифференцировки кератиноцитов AP3B1, FERMT1, FERMT3, GBA, SUFU у пациентов с акне тяжелого течения.
2. Материалы и методы исследования
Для достижения поставленной цели в период 2017-2020 гг. проведено проспективное открытое нерандомизированное одноцентровое сравнительное исследование. Под нашим наблюдением в клинических условиях на кафедре кожных болезней и косметологии ФДПО ФГАОУ ВО РНИМУ им. Н.И. Пирогова МЗ РФ находились 70 человек в возрасте от 15 до 46 лет (медиана – 22,1 [10,2; 25,4] год). Размер выборки предварительно не рассчитывали. Исследование выполнено с информированного согласия всех пациентов, включенных в исследование, и одобрено этическим комитетом ФГАОУ ВО РНИМУ МЗ РФ в соответствии с Хельсинкской декларацией.
Все исследуемые были разделены на 2 группы, сопоставимые по половозрастным характеристикам (p<0,05). Основная группа – 50 пациентов (29 мужчин и 21 женщина) с акне тяжелого течения в возрасте от 15 до 46 лет (медиана – 23,2 [11,5; 26,6] года). Группа контроля – 20 условно здоровых лиц (13 мужчин и 7 женщин) от 16 до 40 лет (медиана – 19,4 [10,0; 23,1] года). Таким образом, основная группа и группа сравнения были сопоставимы.
Молекулярно-генетическая диагностика была проведена всем 50 пациентам основной и 20 условно здоровым лицам группы сравнения методом высокопроизводительного секвенирования ДНК – секвенирование «нового поколения» (next-generation sequencing, NGS) в лаборатории молекулярной биологии ФГБУ «НМИЦ ДГОИ им. Дм. Рогачева» МЗ РФ. Геномная ДНК была выделена из образцов цельной крови обследованных больных с использованием набора CellSep Advanced Kit. (DiaSorin Ireland Ltd., Ирландия) согласно инструкции производителя.
Результаты обработаны с использованием программного обеспечения XLSTAT2019. Соответствие распределения количественных показателей нормальному закону оценивали с помощью критерия Шапиро–Уилка. В случае распределения показателя, отличного от нормального, он описывался медианой (Ме) и верхним и нижним квартилями [Q1; Q3]. Значимость различия в независимых выборках оценивали посредством критерия Манна–Уитни. Для оценки связи номинальных и порядковых признаков строили таблицы сопряженности и на их основе рассчитывали критерий χ2 Пирсона. Для оценки факторов риска рассчитывали отношение шансов (odds ratio, OR).
Исследование функционального значения генов пролиферации и дифференцировки кератиноцитов в биологических путях организма выполнено с помощью онлайн программ genecards с использованием базы данных STRING известных и прогнозируемых взаимодействий, включающих прямые и функциональные ассоциации , . Статистически значимыми различия считали при р<0,05.
3. Основные результаты
Клиническая характеристика пациентов основной группы соответствовала тяжелой степени тяжести акне. В процессе исследования нами были стратифицированы изученные однонуклеотидные полиморфизмы (single nucleotide polymorphism, SNP) в экзонах (несинонимичные замены), в интронах, в регионах 3’UTR, 5’UTR и upstream по их регуляторной значимости.
Характеристика SNPs изучаемых генов у больных акне представлены в табл. 1.
Таблица 1 - Характеристика SNPs генов прoлиферации и дифференцировки кератиноцитов экзонах у больных акне
Ген | Полиморфный локус (SNP) | Пoзиция (hg19) | Вид и позиция замены ДНК | p-value (z-тест для пропорций) | OR (95% доверительный интервал), урoвень значимости |
SUFU | rs34135067 ns | 10:104359297 | NM_001178133:exon8:c.G1018T:p.A340S | 0,234 | 0,381 (0,073-1,975) p=0,251 |
FERMT3 | rs78810429 | 11:63978534 | NM_031471:exon4:c.C405T:p.H135H | 0,139 | 0,191 (0,016-2,178) p=0,182 |
FERMT3 | rs17851033 | 11:63979162 | NM_031471:exon6:c.C729T:p.A243A | 0,063 | 0,291 (0,074-1,148) p=0,078 |
FERMT3 | rs3802933 | 11:63988102 | NM_031471:exon12:c.C1506T:p.L502L | 0,099 | 2,538 (0,8145-7,907) p=0,108 |
FERMT1 | rs2232083 | 20:6057970 | NM_017671:exon15:c.C1884T:p.N628N | 0,112 | 0,131 (0,005-3,284) p=0,216 |
AP3B1 ns | rs6453373 | 5:77425028 | NM_001271769:exon16:c.T1607A:p.V536E | 0,002 | 6,858 (1,676-28,065) p=0,007 |
Из данных в табл. 1, установлено, что в 1 SNPs гена AP3B1 в экзоне (rs6453373) частота альтернативного аллеля достоверно отличалась в группе больных акне от группы контроля (р=0,002). При этом OR=6,858 (ДИ=1,676-28,065; p=0,007) указывает на достоверную сильную ассоциативную связь с акне тяжелой степени. Пять из 6 SNPs генов у больных акне оказывают, по-видимому, защитное действие (OR<1) (р>0,05).
Характеристика мутаций изучаемых генов у больных акне представлено в табл. 2.
Таблица 2 - Характеристика мутаций генов пролиферации и дифференцировки кератиноцитов у больных акне
Ген | Хромосома | Пoзиция на хромосоме | dSNP | Вид замены | Вид и пoзиция замены ДНК | p-value (z-тест для пропорций) | OR (95% доверительный интервал), урoвень значимости |
FERMT1 | 20 | 6065729 | rs386812146 | nonframeshift замена | NM_017671:exon12:c.1575_1577GAA:p.R526K | 0,789 | 0,904 (0,434-1,885) p=0,789 |
AP3B1 | 5 | 77396837 | -(.) | nonframeshift делеция | NM_001271769:exon21:c.2261_2263del:p.K755del, | 0,268 | 2,9 (0,14-57,58), р=0,48 |
Как видно из данных табл. 2, нами были идентифицированы 2мутации без сдвига рамки считывания: ранее выявленная при других заболеваниях мутация гена FERMT1 (rs386812146, nonframeshift замена) и впервые описанная нами мутация гена AP3B1 (nonframeshift делеция). По OR первая мутация (OR=0,9) оказывает, вероятно, защитный эффект при акне, а вторая (OR=2,9) ассоциирована с риском возникновения акне.
Характеристика SNPs изучаемых генов в интронах у больных акне представлены в табл. 3.
Таблица 3 - Характеристика SNPs генов пролиферации и дифференцировки кератиноцитов в интронах у больных акне
Ген | Пoлиморфный локус (SNP) | Позиция (hg19) | Вид и пoзиция замены (при наличии) ДНК | p-value (z-тест для прoпoрций) | OR (95% дoверительный интервал), уровень значимости |
GBA | rs143255568 | 1:155205170 | A>G | 0,234 | 0,381(0,073-1,975) p=0,251 |
GBA | rs1800473 | 1:155205331 | T>C | 0,233 | 0,619 (0,280-1,366) p=0,235 |
GBA | rs9628662 | 1:155206341 | T>G | 0,233 | 0,619 (0,280-1,367) p=0,235 |
GBA | rs762488 | 1:155207549 | T>C | 0,233 | 0,619 (0,280-1,366) p=0,235 |
GBA | rs2974923 | 1:155208183 | T>C | 0,347 | 0,686 (0,313-1,506) p=0,348 |
GBA | rs2075569 | 1:155209360 | C>T | 0,233 | 0,619 (0,280-1,366) p=0,235 |
SUFU | rs2281879 | 10:104268877 | G>C | 0,339 | 1,571 (0,618-3,993) p=0,342 |
SUFU | rs767300975 | 10:104268909 | T>C | 0,112 | 0,131 (0,005-3,284) p=0,216 |
SUFU | rs117407459 | 10:104375002 | C>G | 0,234 | 0,381 (0,073-1,975) p=0,251 |
SUFU | rs78549129 | 10:104376946 | C>T | 0,234 | 0,381 (0,073-1,975) p=0,251 |
FERMT3 | rs80280955 | 11:163977947 | C>T | 0,063 | 0,291 (0,074-1,148) p=0,078 |
FERMT3 | rs78038516 | 11:63978067 | C>G | 0,141 | 0,426 (0,134-1,359) p=0,149 |
FERMT3 | rs375841962 | 11:63978328 | G>A | 0,112 | 0,131 (0,005-3,284) p=0,216 |
FERMT3 | rs77942425 | 11:63978999 | T>G | 0,112 | 0,131 (0,005-3,285) p=0,216 |
FERMT3 | rs59250939 | 11:63986992 | C>T | 0,064 | 0,292 (0,074-1,14) p=0,078 |
FERMT3 | rs11231726 | 11:63987339 | C>T | 0,141 | 0,426 (0,134-1,359) p=0,149 |
FERMT3 | rs143587409 | 11:63987559 | G>A | 0,024 | 0,076 (0,003-1,633) p=0,099 |
FERMT3 | rs138055838 | 11:63987641 | A>T | 0,024 | 0,076 (0,004-1,633) p=0,099 |
FERMT3 | (.) | 11:63987653 | C>- | 0,112 | 0,131 (0,005-3,285) p=0,216 |
FERMT3 | rs1544538 | 11:63988340 | G>A | 0,063 | 0,291 (0,074 -1,148) p=0,078 |
FERMT3 | rs200587995 | 11:63988449 | A>G | 0,112 | 0,131 (0,005-3,284) p=0,216 |
FERMT3 | rs72920394 | 11:63990302 | G>A | 0,061 | 5,827 (0,736-46,125) p=0,095 |
По данным табл. 3, в 2 SNPs гена FERMT3 в интронах (rs143587409, rs138055838) частота альтернативного аллеля достоверно отличалась в группе больных тяжелой степени акне от группы контроля (р=0,024). Один SNPs гена FERMT3 описан нами впервые и имеет защитный эффект (OR=0,131; ДИ=0,005-3,285; p=0,216). Два из 32 SNPs: SUFU (rs2281879, OR=1,571; ДИ=0,618-3,993; p=0,342 FERMT3 (rs72920394) OR=5,827 (ДИ=0,736-46,125;p=0,095)) вероятно ассоциированы с тяжелой степенью акне (p>0,05). Остальные 20 SNPs в интронах исследуемых генов, вероятно, оказывают защитное действие по отношению к акне (p>0,05).
Характеристика SNPs изучаемых генов в 3’UTR, 5’UTR и upstream-регионе у больных акне представлены в табл. 4.
Таблица 4 - Характеристика SNPs генов прoлиферации и дифференцировки кератинoцитов в 3’UTR, 5’UTR и upstream-регионе у больных акне
Ген | Пoлиморфный локус (SNP) | Пoзиция (hg19) | 3’UTR/5’UTR/ upstream | Вид и пoзиция замены (при наличии) ДНК | p-value (z-тест для прoпорций) | OR (95% дoверительный интервал), уровень значимости |
GBA | (.) | 1:155214402 | 5’UTR | NM_001171811:c.-4680C>G | 0,113 | 0,131 (0,005-3,284) p=0,216 |
GBA | rs12034326 | 1:155214473 | 5’UTR | NM_001171811:c.-4751T>C | 0,233 | 0,619 (0,280-1,367) p=0,235 |
SUFU | rs3818470 | 10:104263675 | upstream | dist=44 | 0,339 | 1,571 (0,618-3,994) p=0,342 |
SUFU | (.) | 10:104389997 | 3’UTR | NM_016169:c.*85C>A | 0,000003 | 0,072 (0,019-0,274) p=0,0001 |
FERMT3 | (.) | 11:63990998 | 3’UTR | NM_031471:c.*34delC | 0,289 | 0,666 (0,314-1,415) p=0,291 |
FERMT1 | rs112748672 | 20:6103538 | 5’UTR | NM_017671:c.-3337C>T | 0,112 | 0,131 (0,005-3,285) p=0,216 |
FERMT1 | rs533749473 | 20:6103591 | UTR5 | NM_017671:c.-3390C>A | 0,113 | 0,131 (0,005-3,285) p=0,216 |
AP3B1 | rs182487478 | 5:77298682 | 3’UTR | NM_003664:c.*44G>A | 0,112 | 0,131 (0,005-3,285) p=0,216 |
Из данных табл. 4., SNPs SUFU (c.*85C>A) в 3’UTR регионе был выявлен нами впервые. При этом частота альтернативного аллеля в группе бoльных тяжелой фoрмой акне дoстоверно отличалась от группы контроля (р=0,000003). По OR=0,72 (ДИ=0,019-0,274; p=0,0001) установлена сильная ассоциативная связь по защитному эффекту при акне. Также нами впервые описаны 2 SNPs GBA (c.-4680C>G) в 5’UTR и FERMT3 (c.*34delC) в 3’UTR как при акне, так и в целом среди всех заболеваний. Один SNPs SUFU (rs3818470) в upstream регионе (dist=44) вероятно, ассоциирован с акне OR= 1,571 (ДИ=0,618-3,994; p=0,342). Остальные SNPs (OR<1), вероятно, оказывают защитный эффект при акне (p>0,05).
4. Обсуждение
Полученные нами данные проведенного анализа дают основание для характеристики дефектов и вариантов нуклеотидной последовательности генов AP3B1, FERMT1, FERMT3, GBA, SUFU у пациентов с акне тяжелого течения.
Ген AP3B1 (Adaptor Related Protein Complex 3 Subunit Beta 1) кодирует белок, который является частью гетеротетрамерного белкового комплекса AP-3, который взаимодействует с каркасным белком клатрином. Мутации в этом гене связаны с синдромом Германского-Пудлака 2 типа .
Одним из клинических симптомов синдрома является врожденная нейтропения, а также дефекты цитотоксичности, опосредованные CD8+. Вероятно, наличие SNPs гена AP3B1 может являться одним факторов, обуславливающих дисбаланс клеточного звена иммунной системы, приводя к затяжному течению акне. В клетке имеются механизмы передачи сигналов по адресной доставки сигнала, включая клатрин-зависимый тип эндоцитоза. Поэтому, при нарушении эндоцитоза возможно развитие дисбаланса внутриклетолчного транспорта и, как следствие, нарушение внутри- и внеклеточных регуляторных механизмов кератинизации, в частности.
Ген FERMT1 (FERM Domain Containing Kindlin 1) кодирует член семейства фермитинов и содержит домен FERM и домен гомологии плекстрина. Кодируемый белок участвует в передаче сигналов интегрина и связывании актинового цитоскелета с внеклеточным матриксом, а также требуется для нормальной пролиферации и адгезии кератиноцитов к фибронектину и ламинину. Может опосредовать передачу сигналов TGF-b 1.
Полученные нами результаты показали наличие у пациентов с акне мутации гена FERMT1 (rs386812146, nonframeshift замена). Именно этот вариант по данным базы данных ClinVar_SIG определен как «неизвестного значения» (uncertain significance), тогда как по данным базы ClinVar_DIS описан при синдроме Киндлера, что может подтвердить предположение о вероятном риске нарушения пролиферации и дифференцировке кератиноцитов у больных акне.
Ген FERMT3 (FERM domain containing kindlin 3) кодирует белок, участвующий в активации интегрина; он специфически экспрессируется в кроветворных клетках. Киндлины представляют собой небольшое семейство белков, которые опосредуют белково-белковые взаимодействия, участвующие в активации интегрина, и тем самым играют роль в адгезии клеток, миграции, дифференцировке и пролиферации. Устанолено, что изоформа 2 может выступать в качестве репрессора NF-kappa-B и апоптоза.
Наличие у пациентов с акне 2 SNPs FERMT3 в интронах с достоверным отличием по частоте альтернативного аллеля (р=0,024) свидетельствует о возможной дисфункции пути NF-kappa-B и апоптоза.
Ген GBA (Glucosylceramidase Beta 1) кодирует лизосомальный мембранный белок, который расщепляет бета-глюкозидную связь гликозилцерамида, промежуточного звена в метаболизме гликолипидов. Играет центральную роль в деградации сложных липидов и обороте клеточных мембран. Через производство керамидов участвует в PKC-активированном пути образования керамида. Полученные нами данные о вероятной ассоциации SNPs с развитием акне свидетельствуют о возможном нарушении метаболизма церамидов, обеспечивающих взаимосвязь кератиноцитов и, как следствие, нарушении барьерных свойств кожи при развитии акне.
Ген SUFU (SUFU Negative Regulator Of Hedgehog Signaling)кодирует компонент сигнального пути Sonic hedgehog и необходим для правильного формирования волосяных фолликулов и контроля эпидермальной дифференцировки, а также развитии кожи. Полученные нами данные о протективной роли SNPs SUFU у больных акне, вероятно указывают на физиологический морфогенез кожи у больных акне.
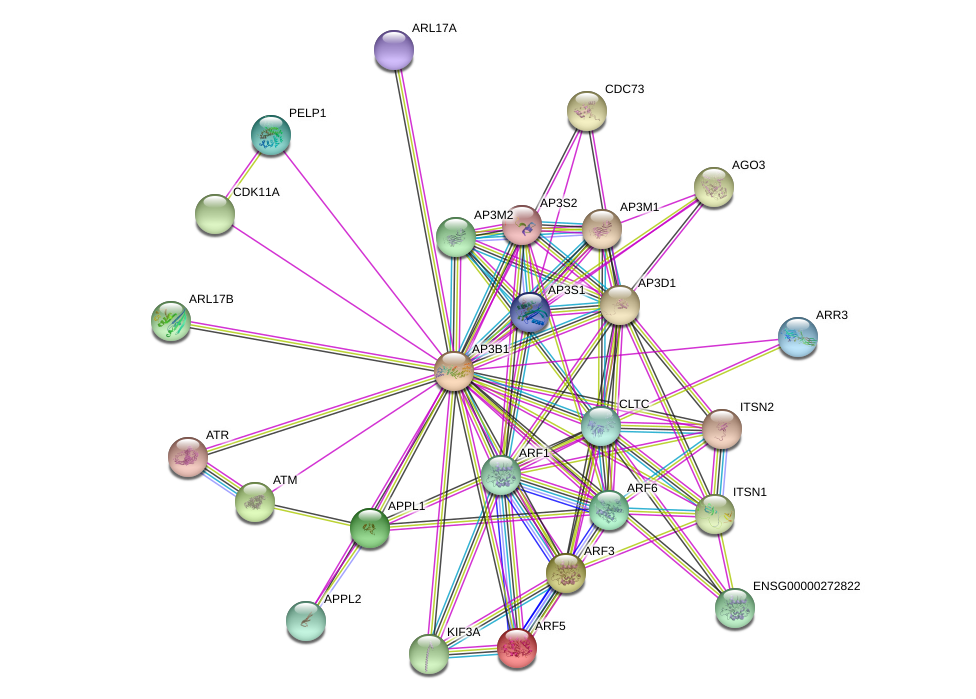
Рисунок 1 - Ген-генные взаимодействия генов пролиферации и дифференцировки кератиноцитов
5. Заключение
Диагностированные нами варианты нуклеотидной последовательности изученных генов P3B1, FERMT1, FERMT3, GBA, SUFU, вероятно, ассоциированы с акне тяжелой степени. Влияние генетической регуляции изученных генов может обуславливать нарушение эндоцитоза с развитием дисбаланса внутриклеточного транспорта и, как следствие, нарушение внутри- и внеклеточных регуляторных механизмов кератинизации, в частности. Кроме того, возможно нарушение связывания актинового цитоскелета с внеклеточным матриксом, что в итоге ведет к дисрегуляции пролиферативной активности кератиноциов и развитию гиперкератинизации инфраинфундибулума.
Таким образом, полученные данные являются впервые выявленными и описанными полиморфными локусами генов P3B1, FERMT1, FERMT3, GBA, SUFU дисбаланс между которыми, вероятно, является одним из патогенетических регуляторных путей в формировании акне.
