ВЛИЯНИЕ О-ФТОРФЕНИЛБИГУАНИДИНА (О-ФФБГ) НА КИНЕТИКУ КАТОДНОГО ВЫДЕЛЕНИЯ ВОДОРОДА НА ЖЕЛЕЗЕ И ЕГО ТВЕРДОФАЗНУЮ ДИФФУЗИЮ ЧЕРЕЗ СТАЛЬНУЮ МЕМБРАНУ В КИСЛЫХ ХЛОРИДНЫХ СРЕДАХ
Балыбин Д.В.1, Попова Е.Д.2
1 Кандидат химических наук, старший преподаватель кафедры аналитической и неорганической химии, ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина.
2 Студентка 4 курса специальности «химия», ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина.
ВЛИЯНИЕ о-ФТОРФЕНИЛБИГУАНИДИНА (о-ФФБГ) НА КИНЕТИКУ КАТОДНОГО ВЫДЕЛЕНИЯ ВОДОРОДА НА ЖЕЛЕЗЕ И ЕГО ТВЕРДОФАЗНУЮ ДИФФУЗИЮ ЧЕРЕЗ СТАЛЬНУЮ МЕМБРАНУ В КИСЛЫХ ХЛОРИДНЫХ СРЕДАХ
Аннотация
Показано, что в присутствии и возрастании концентрации о-фторфенилбигуанидина (0,5 – 40 мМ) в солянокислых водных средах наблюдается изменение природы замедленной стадии реакции выделения водорода на железе согласно ряду: замедленный разряд → лимитирующая химическая рекомбинация → замедленная латеральная диффузия → лимитирующий разряд.
Ключевые слова: железо, ионы водорода, разряд, о-фторфенилбигуанидин, замедленная стадия.
Balybin D. V.1, Popova E. D.2
1 Candidate of chemical sciences, assistant professor of analytical and inorganic chemistry department, Tambov State University named after G.R. Derzhavin
2 Student of speciality «Chemistry» in Tambov State University named after G.R. Derzhavin
INFLUENCE OF O-FLUOROPHENYLBIGUANIDINE ON HYDROGEN EVOLUTION REACTION KINETICS ON IRON IN ACIDIC CHLORIDE MEDIA
Abstract
It is shown that in the presence of increcesing o-fluorophenylbiguanidine concentrations (0,5 – 40 mM) in the hydrogen chloride aqueous media, change of nature of the slow stage of hydrogen release reaction on iron is observed according to the row: slow discharge – limiting chemical recombination – slow lateral diffusion – limiting discharge.
Keywords: iron, hydrogen ions, discharge, o-fluorophenylbiguanidine, slow stage.
Реакция катодного выделения водорода (РВВ) – одна из наиболее изученных, обобщённых и вместе с тем изучаемых в настоящее время, так как она во многом является определяющей для интерпретации закономерностей электрохимической кинетики. Одновременно трудно переоценить ее роль и при решении прикладных вопросов, в частности, защиты металлов от коррозии и проблем водородной энергетики, связанных с получением электролитического водорода и его аккумулированием. Таким образом, в прикладном плане в одних условиях РВВ целесообразно стимулировать, в других – подавлять. Существуют работы, посвященные РВВ в различных условиях на различных материалах, но, зачастую, мнения авторов о лимитирующей стадии РВВ, выявив которую возможно будет управлять этим процессом, расходятся.
Целью настоящей работы явилось изучение связи кинетики реакции выделения водорода на железе при различной кислотности и концентрации
о-фторфенилбигуанидина (о-ФФБГ) в водных и водно-органических кислых хлоридных средах с процессом твердофазной диффузии водорода через стальную (Ст3) мембрану.
Методика эксперимента
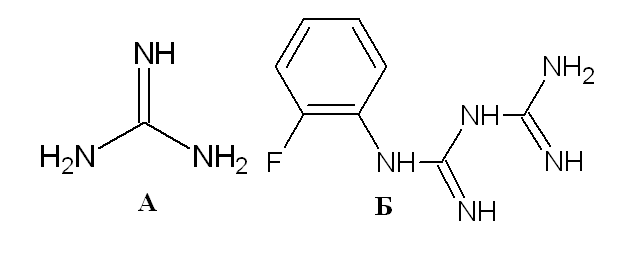
Изучена добавка о-фторфенилбигуанидина (Б), который является аналогом гуанидина (А) сильного однокислотного бескислородного органического основания с рКа протонированной формы, иона гуанидиния, по одним данным равным в воде 13,6 [1]; по другим -11 [1].
Исследования проведены в водных и водно-органических (10 масс. % воды в этиленгликоле) растворах с составом электролита
х М НСl+ (1 – х) М LiCl, полученных насыщением исходных растворителей сухим хлористым водородом с последующим разбавлением ими полученной системы до заданной кислотности и введением высушенного при 107°С хлорида лития. Кинетику РВВ исследовали на Ст3 в условиях потенциодинамической поляризации (потенциостат - Solartron 1285, скорость развертки 0,66 мВ/с), водородная атмосфера, комнатная температура, потенциалы пересчитаны по стандартной водородной шкале. Электрохимические измерения проведены в двух экспериментальных сериях: в одной использован насыщенный водный хлоридсеребряный электрод сравнения, во второй – равновесный водородный электрод в том же рабочем растворе. Рабочий электрод с видимой поверхностью 0,5 см2 армировали в оправу из эпоксидной смолы, отвержденной полиэтиленполиамином, перед экспериментом шлифовали и полировали, затем обезжиривали ацетоном. Использована трехэлектродная электрохимическая ячейка с разделенным шлифом анодным и катодным пространствами, вспомогательный электрод - гладкая платина.
Экспериментальные результаты и их обсуждения

Рис. 1. Зависимость катодного тока от скорости вращения стального электрода в условиях катодной поляризации ΔЕК = -50 мВ, τвыдержки = 300 сек. 1 – 0,1 М НСl + 0,9 М LiCl – фон; 2 – фон +1 мМ о-ФФБГ.
Из рисунка 1 видно, что катодный ток не является функцией скорости вращения дискового электрода, из этого следует, что при поляризации на величину -50 мВ наблюдается кинетический контроль скорости катодной реакции. При введении минимального количества добавки о-ФФБГ в водный растворитель лимитирующей стадией является замедленный разряд, как и в фоновых растворах (таблица 1). Увеличение концентрации о-ФФБГ до 1 ммоль/л приводит к смене лимитирующей стадии с замедленного разряда на замедленную рекомбинацию (таблица 1).
Таблица 1. Кинетические параметры РВВ на железе в присутствии о-ФФБГ в водных кислых хлоридных растворах с составом электролита х М НC1 + (1 - x) M LiC1 (водородная атмосфера, комнатная температура).
|
Со-ФФБГ, ммоль/л |
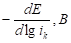 |
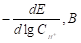 |
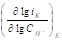 |
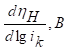 |
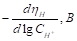 |
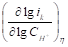 |
|
|
0 |
0,115 |
0,065 |
0,90 |
0,115 |
0,060 |
0,50 |
|
|
0,5 |
0,110 |
0,060 |
0,80 |
0,110 |
0,060 |
0,50 |
|
|
1,0 |
0,110 |
0,065 |
0,50 |
0,110 |
0 |
0 |
|
|
5,0 |
0,115 |
0,075 |
0,75 |
0,115 |
0,035 |
0,25 |
|
|
10,0 |
0,120 |
0,060 |
0,75 |
0,120 |
0,025 |
0,25 |
|
|
20,0 |
0,120 |
0,065 |
0,60 |
0,120 |
0,030 |
0,20 |
|
|
30,0 |
0,120 |
0,080 |
1,0 |
0,120 |
0,045 |
0,50 |
|
|
40,0 |
0,120 |
0,125 |
1,10 |
0,120 |
0,060 |
0,55 |
При 5, 10 (таблица 1) и 20 ммоль/л о-ФФБГ реализуется замедленная латеральная диффузия, а при 30 и 40 ммоль/л о-ФФБГ вновь лимитирует реакция разряда (таблица 1). Во всем концентрационном интервале о-ФФБГ наблюдается следующая смена природы лимитирующей стадии: разряд → рекомбинация → поверхностная диффузия → разряд [2].
Таблица 2 . Кинетические параметры РВВ на железе в присутствии о-ФФБГ в водно-этиленгликолевых растворах, содержащих 10 масс % воды.
|
Со-ФФБГ, ммоль/л |
|
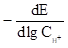 |
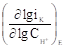 |
|
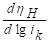 |
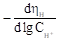 |
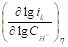 |
|
0 |
0,125 |
0,090 |
0,45 |
|
0,125 |
0 |
0 |
|
0,5 |
0,125 |
0,060 |
0,70 |
|
0,125 |
0,050 |
0,30 |
|
1,0 |
0,120 |
0,100 |
0,90 |
|
0,120 |
0,040 |
0,45 |
|
5,0 |
0,120 |
0,120 |
0,90 |
|
0,120 |
0,075 |
0,45 |
|
10,0 |
0,125 |
0,100 |
0,75 |
|
0,125 |
0,065 |
0,40 |
|
20,0 |
0,130 |
0,110 |
1,10 |
|
0,130 |
0,100 |
0,60 |
|
30,0 |
0,110 |
0,100 |
1,20 |
|
0,110 |
0,090 |
0,50 |
|
40,0 |
0,120 |
0,120 |
1,30 |
|
0,100 |
0,100 |
0,65 |
Интересным для изучения является связь кинетики РВВ на железе с его твердофазной диффузией через стальную мембрану в тех же системах. Исследования проведены по общепринятой методике [3].
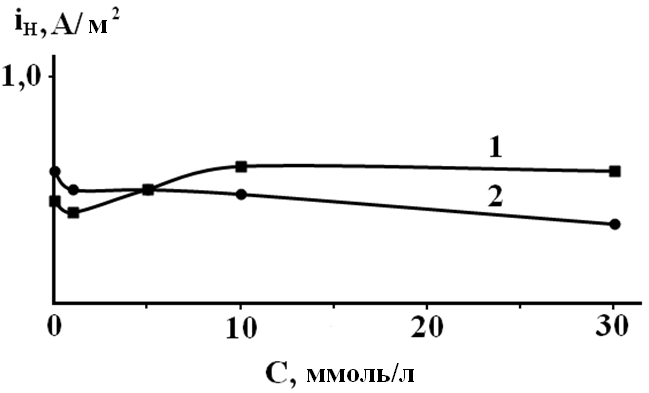
Рис. 2. Закономерности твердофазной диффузии водорода через стальную мембрану из растворов системы Н2О – HCl от концентрации о-ФФБГ (1-0,99М НС1; 2-0,05М НС1).
Можно было ожидать принципиальных изменений кинетических закономерностей в условиях различной природы замедленной стадии, наличие изломов или перегибов на соответствующих кривых в координатах iH, СОФГ. Однако оказалось, что скорость диффузии водорода через мембрану iH практически не зависит от этого фактора (рис. 2).
Список литературы
Альберт А., Сержент А.Е.. Константы ионизации кислот и оснований. // М.: Химия. 1964. С. 179.
Фрумкин А.Н. Перенапряжение водорода. М.: Наука. 1988. 240 с.
Кардаш Н.В., Батраков В.В. Влияние состава раствора на диффузию водорода через металлическую мембрану. // Защита металлов. 1995. Т. 31. № 4. С. 441 - 444.

