Эффективность комбинированного подхода в исходе хирургического лечения при синдроме диабетической стопы
Эффективность комбинированного подхода в исходе хирургического лечения при синдроме диабетической стопы
Аннотация
Актуальность. Проблема регенерации тканей при синдроме диабетической стопы приобрела в настоящее время особую актуальность в связи с многополярностью механизмов возникновения трофических расстройств, их склонностью к рецидивам, расширению зон поражения при применении традиционных методов лечения, устойчивости к медикаментозным методам лечения, ухудшению уровня жизни пациентов, а также из-за значительной затраты времени и усилий, необходимого для лечения. Все эти факторы приводят к значительным экономическим расходам в курации пациентов данной когорты.
Цель исследования. Разработки новых комбинированных методов хирургического лечения дефектов тканей при синдроме диабетической стопы.
Материалы и методы. В статье представлен оригинальный подход к решению одной из актуальных проблем современной хирургии осложнений сахарного диабета, к лечению патологических процессов мягких тканей.
Выводы. На этапах всего периода исследования наблюдалось быстрое заживление ран, независимо от исходных клинических данных и анамнеза болезни пациентов. Также наблюдалось уменьшение воспалительной реакции и активное восстановление повреждённых тканей.
1. Введение
Актуальность. Одной из основных причин утраты трудоспособности, а зачастую и смертности среди пациентов с сахарным диабетом являются поздние осложнения этого заболевания . Одним из наиболее сложных с позиции курации и купирование клинических проявлений поздних проявлений СД, особенно СД 2, является синдром диабетической стопы с развитием язвенных дефектов , , .
Язвенные процессы на нижних конечностях , возникают примерно у четверти пациентов с синдромом диабетической стопы (СДС). Более чем в 80% проявлений язвенный дефект стоп при СДС приводит к ампутации. При этом состояние пациентов после метатарзальной ампутации стопы (при условии активизации пациента и использовании специальной обуви) оценивается выше, чем у пациентов с открытыми раневыми и/или язвенными дефектами.
Раневой процесс при сахарном диабете отличается хроническим течением, трудностью верификации стадий, полиморфизмом дефектов, и как следствие, высокой стоимостью лечения , .
Цель исследования. Фактор, который является ключевым и определяющим в исходе лечения от появления язвы до её адекватного закрытия – это время. Чем меньше времени затрачено на купирование воспалительных процессов и регенеративно-пролиферативные процессы с исходом в заживление дефекта, тем меньшей опасности мы подвергаем жизнь пациента.
Как известно, стандартные методы лечения СДС зачастую не всегда позволяют добиться желаемого результата и предотвратить ампутацию. Поэтому продолжается поиск «новых» подходов к лечению, в том числе и с использованием современных биопластических материалов / биоинженерных конструкций в составе комбинированного хирургического лечения на фоне медикаментозной поддержки.
Материалы и методы. Характеристики биопластических конструкций, которые используются в клинической практике, влияющие на их выбор должны соответствовать следующим требованиям:
1. Иметь макромолекулярную структуру с заданным периодом биодеградации, осуществляемый естественными метаболическими путями, без возникновения иммуновоспалительных процессов.
2. Включать конечные и промежуточно-этапные элементы деструкции в естественные циклы биохимических обменных процессов.
3. Соответствовать по временной составляющей определенному периоду биодеградации материала и длительности собственно репаративного процесса.
На основе сочетания определенных морфологических, функциональных и технологических признаков все биопластические материалы разделяются на две группы: матрично-пластические и матрично-целлюлярные . Представляющие первую группу материалы наиболее распространены при применении в практической хирургии. Они обладают свойствами «биодеградируемых раневых покрытий с функциональными свойствами» .
Используемый нами биопластический материал представляет собой полимер, состоящий на 90% из гиалуроновой кислоты и на 10% – из коллагена, имеет форму пластины с перфорационными отверстиями, нанесенными при его производстве. Форма пластины овальная. Легко моделируется по форме раневого дефекта и имеет высокую степень адгезии , . Гиалуроновая кислота способствует восстановлению клеточных слоёв дефект тканей и придает материалу оптимальные гидрофильные свойства.
Составляющая структура материала обеспечивает его поэтапный управляемый лизис тканевыми биологическими катализаторами. Это позволяет биоматериалу управляемо-длительно находиться на поверхности дефекта, создавая оптимальную внеклеточную микросреду для целенаправленной миграции клеток (фибробластов) и пролиферации покровных тканей. Под покровом биопластического материала происходит формирование регенерата и эпителизация раны.
Пациентам проводилось идентичное общее консервативное лечение , , которое включало: ангиопротекторы; антиоксиданты, препараты производные янтарной кислоты; НПВС при болевом синдроме в сочетании с миорелаксантами центрального действия и/или габапентинами при судорожном синдроме; витамины группы В; дезагреганты; антикоагулянты; антибактериальная терапия назначалась с учётом бактериологической оценки дефектов, с первоначальными ультракороткими ударными курсами.
Интраоперационно производился дебридмент раневого дефекта путем ультразвуковой гидрохирургической обработки до состояния «кровяной росы» дна и стенок раневого дефекта. После этого производилась аппликация описанного выше биоматериала на раневую поверхность по существующей методике с учетом плотного прилегания к элементам дефекта тканей. Введение аутологичных факторов роста по разработанной нами оригинальной методике производилась трансбиоматериально точечно в так называемом шахматном порядке. При введении обязательно избегали вспучивания биоматериала. Материал с заданным периодом биодеградации остаётся на ране до полной биодеструкции на фоне применения интерактивных повязок.
Одним из основных, как было указано, свойств данного биоматериала является его управляемая биологическая деструкция. Надо отметить, что она напрямую коррелирует с условиями кровообращения и иннервации тканей, при наличии условий "moist wound healing" (заживления раны во влажной среде/влажного заживления ран).
2. Основные результаты
При оценке изменений объёма/площади дефектов при визитах контроля наблюдения (0, 7, 14, 28 и 40 сутки) было отмечено статистически значимое снижение показателя на каждом этапе (p < 0,001). Во время 2 и 3-го визитов после наложения биоматериала и введения АФР (аутологические факторы роста) объём раны визуально сократился у всех пациентов.
Во время 4-го визита уменьшение показателя отмечалось у 24 человек (92,3%). В одном случае динамика отсутствовала в связи с регенерацией ран ещё на 14-й день наблюдения. У одного пациента объём раны увеличился с 1,4 см³ до 1,41 см³ (на 3,8 %).
Результаты анализа относительной скорости заживления раны (RSH), определяемой по формуле: RSH = (1 – S1 / S0) * 100%, где S1 – площадь язвы на день контроля (визита) после имплантации биоматериала, S0 – первоначальная площадь дефекта, определённой для каждого этапа наблюдения: наименьшее значение медианы RSH отмечалось в первую неделю (24,13%). Наибольшее ее значение определено на этапе 4-го визита (28,32%).
За весь период наблюдения (40 дней) была установлена медиана показателя RSH, равная 63,03%.
Кроме оценки скорости заживления раны нами было проведено изучение выраженности болевого синдрома в области стоп при каждом визите наблюдения согласно визуальной аналоговой шкале боли (ВАШ). Отмечено следующее изменение показателей:
1) «0-1 балл» на начало исследования – 19,2%, к 28 дню наблюдения – 84,6%;
2) «2-3 балла» на начало исследования – 46,2%, к 28 дню наблюдения – 15,4%;
3) «4-5 балла» на начало исследования – 34,6%, к 28 дню наблюдения – 0%.
Для детализации состояния тканей дефектов и верификации клеточных структур нами был применен метод цитогистологического и иммуногистохимического исследования , с использованием набора моноклональных антител – МКАТ - (табл. 1).
Таблица 1 - Характеристика используемых МКАТ
Антиген | Клон | Специфичность | Рабочее разведение | Фирма-производитель |
Миело- пероксидаза | Поликло- нальные, код RB-373-A | Нейтрофильные лейкоциты | 1:800 | Dako |
Виментин | V9 | Фибробласты | 1:300 | Lab Vision |
Пан-цитокератины | AE1/AE3 | Эпителий | 1:300 | Lab Vision |
CD 31
| 9611
| Эндотелий сосудов | 1:20 | BioGenex |
Связывание МКАТ с клеточными элементами определяли при помощи стандартного биотин-стрептавидин-пероксидазного метода (DAKO: LSAB® + System-HRP, код K0690) с диаминобензидином в качестве хромогена. Препараты дополнительно окрашивали гаматоксилином Майера и заключали в канадский бальзам или в специальные среды фирмы DAKO (Ultramount, Faramount, код S302580-2).
Первоначально (0 день) данные методы показали, что биоматериал был интактен во время аппликации и представлял собой аморфный ячеистый эозинофильный матрикс без посторонних включений. В подлежащих тканях наблюдалась очаговая или диффузная воспалительная клеточная инфильтрация, обусловленная операционной травмой, а также единичные очаги кровоизлияний.
Второй визит наблюдения (7 сутки). Определялась выраженная клеточная инфильтрация биоматериала в виде нейтрофилов, лимфоцитов, макрофагов и фибробластов. Коллагенсодержащий материал плотно прилегал к дну и стенкам язвенного дефекта. Данные получены с использованием антител к виментину. Тест на пан-цитокератины дал отрицательный результат. Но, в отличие от предыдущего наблюдения, определено скопление мезенхимальных клеток на границе тканей и с биоматериалом.
Третий визит наблюдения
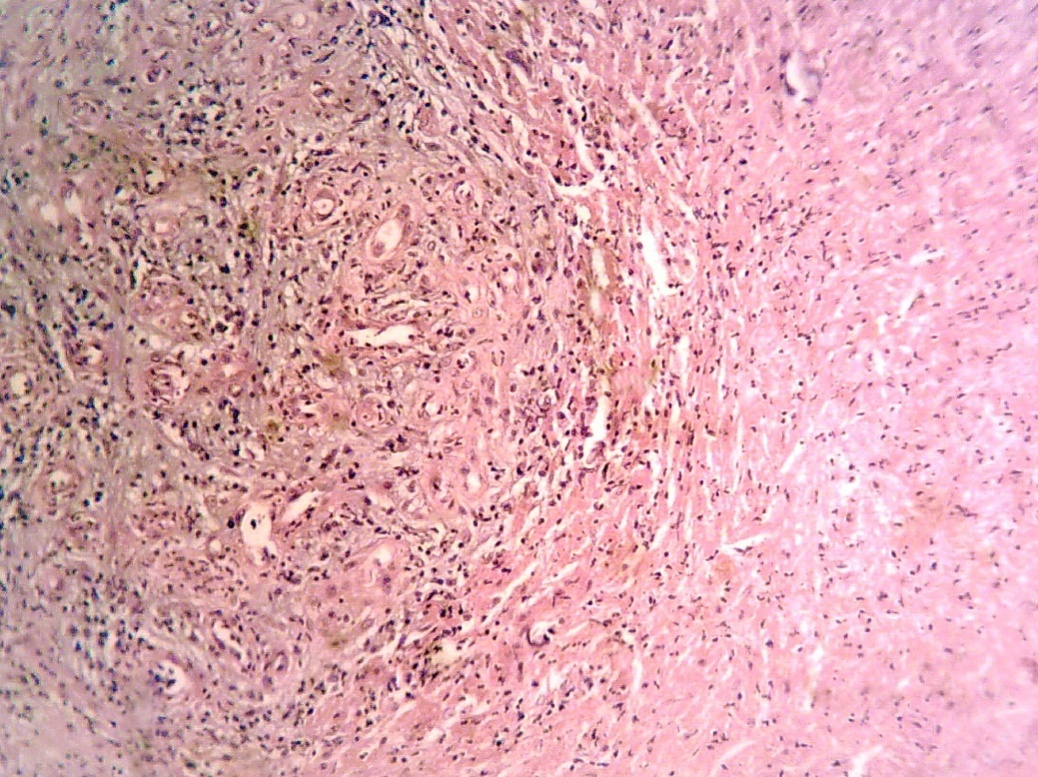
Рисунок 1 - Пролиферация фибробластов и разрастание коллагеновых волокон на границе (1) биоматериала (2) с подлежащими тканями (3)
Примечание: 14 сутки наблюдения. Окраска гематоксилином и эозином.х 200.
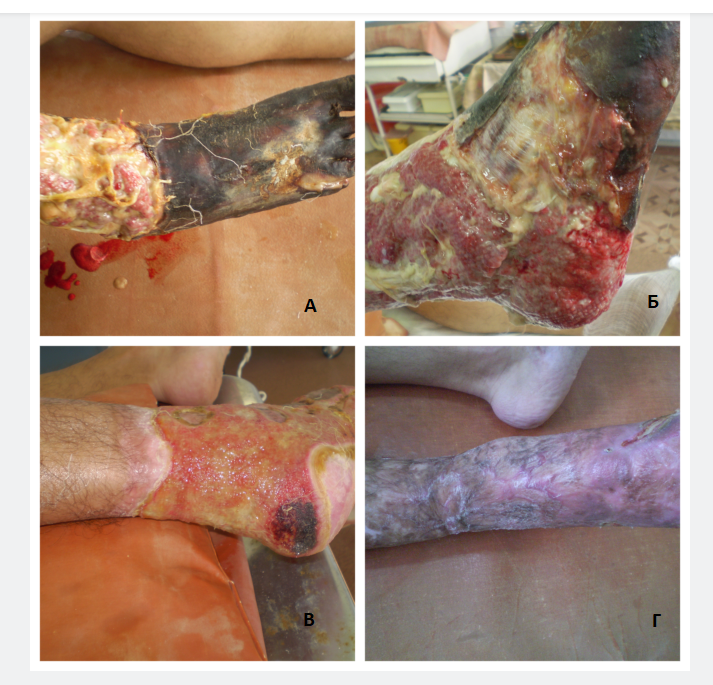
Рисунок 2 - Пациент С, 65 лет. Диагноз: СДС (W5) справа, нейроишемическая форма. Глубокая инфицированная язва с вовлечением костной ткани. ДПН, сенсомоторная и вегетативная форма, выраженная. Диабетическая ангиопатия. ХАН 2Б. ДНОАП, неактивная стадия, фаза 1. Склероз Менкеберга. ПТФБ. ХВН 2 (С4). Диабетическая ретинопатия. Сахарный диабет 2 типа, инсулинпотребный, субкомпенсированный, средней тяжести. HbA1c <8,0%. ИБС. Стенокардия напряжения. ФК 2. ГБ 3 ст. Риск 4. ХСН 1. ФК 2
Примечание: А) Состояние при поступлении – мумификация пальцев стопы, некроз кожных покровов и мягких тканей стопы;
Б) 3-сутки, состояние после метатарзальной ампутации стопы, этапных некрэктомий;
В) 15 сутки, вид стопы после этапных аппаратных ультразвуковых гидрохирургических обработок, имплантацией АФР и наложения биопластического материала;
Г) 40 сутки, заживление и эпителизация раны
3. Заключение
1. Применение данной технологии позволило получить положительный результат у пациентов с дефектами кожи и мягких тканей при СДС. Что определялось относительной скоростью заживления и снижению интенсивности боли.
2. Согласно данным цитологического и иммуногистохимического исследования, отмечено уменьшение воспалительной реакции и восстановление поврежденных тканей.
3. Наибольшее значение относительной скорости заживления при данной методике определено с 14 по 28 день наблюдения. С установленной медианой данного показателя в 63,03% за весь период наблюдения (40 дней).
4. Таким образом, использование биоматериалов и аутологических факторов роста у пациентов с трофическими дефектами мягких тканей при синдроме диабетической стопы приводит к оптимизации течения репаративно-пролиферативных процессов и заметному снижению воспалительной реакции в пораженных тканях.
