СИНТЕЗ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ПРИ СОЧЕТАНИИ ЭТИЛОВОГО ЭФИРА 3-(4-МЕТИЛФЕНИЛГИДРАЗОНО)-2,4-ДИОКСОПЕНТАНОВОЙ КИСЛОТЫ С NH-МОНОНУКЛЕОФИЛАМИ
СИНТЕЗ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ПРИ СОЧЕТАНИИ ЭТИЛОВОГО ЭФИРА 3-(4-МЕТИЛФЕНИЛГИДРАЗОНО)-2,4-ДИОКСОПЕНТАНОВОЙ КИСЛОТЫ С NH-МОНОНУКЛЕОФИЛАМИ
Научная статья
Гайнулин Ф.Ф1*, Левенец Т.В.2
2 ORCID: 0000-0002-8257-8126,
1, 2 Оренбургский государственный университет, Оренбург, Россия
* Корреспондирующий автор (vogel.gg [at]yandex.ru)
АннотацияПри ацилировании по Клайзену ацетона с диэтилоксалатом в присутствии металлического натрия в среде толуола с дальнейшим взаимодействием с хлоридами арилдиазония, взятых в эквимолярных соотношениях, в нейтральной среде приводит к образованию этиловых эфиров 3-арилгидразоно-2,4-диоксопентановых кислот.
При взаимодействии этилового эфира 3-арилгидразоно-2,4-диоксопентановой кислоты с NH-мононуклеофилами получены новые 1-арил-5-гидрокси-4-[(4-метилфенил)гидразоно]-5-метилпирролидин-2,3,4-трионы, определены их физико-химические характеристики. Синтезированные соединения – высокоплавкие вещества, растворимые в обычных органических растворителях, нерастворимые в воде.
Особенности строения полученных соединений установлены на основании данных масс-спектрометрии, ИК и ЯМР 1H спектроскопии. В масс-спектрах выделенных соединений, записанных в режиме электрораспыления наблюдаются сигналы протонированных и катионированных молекул. В ЯМР 1H спектрах обнаружены сигналы всех протоносодержащих групп, показано образование внутримолекулярной водородной связи с атомом кислорода ОН группы или атомом кислорода в положении 3 пирролидинового кольца
Ключевые слова: этиловые эфиры 3-(4-метилфенилгидразоно)-2,4-диоксопентановой кислоты, п-толуидин, п-нитроанилин, анилин, 1-арил-5-гидрокси-4-[(4-метилфенил)гидразоно]-5-метилпирролидин-2,3,4-трион.
SYNTHESIS OF HETEROCYCLIC COMPOUNDS IN COMBINATION OF 3- (4-METHYLPHENYLHYDRAZONO) -2,4-DIOXOPENTANE ACID WITH NH-MONONUCLEOPHILES
Research article
Gainulin F.F .1,*, Levenets T.V.2
2 ORCID: 0000-0002-8257-8126,
1, 2 Orenburg State University, Orenburg, Russia
* Corresponding author (vogel.gg[at]yandex.ru)
AbstractClaisen acylation of acetone with diethyl oxalate in the presence of sodium metal in toluene with further interaction with aryldiazonium chlorides taken in equimolar ratios in a neutral medium leads to the formation of ethyl esters of 3-arylhydrazono-2,4-dioxopentanoic acids.
Interaction of 3-arylhydrazono-2,4-dioxopentanoic acid ethyl ester with NH-mononucleophiles yielded new 1-aryl-5-hydroxy-4 - [(4-methylphenyl) hydrazono] -5-methylpyrrolidin-2,3,4-trions, their physicochemical characteristics are determined. The synthesized compounds are highly melting substances soluble in ordinary organic solvents, insoluble in water.
Structural features of the obtained compounds were established on the basis of mass spectrometry, IR, and NMR 1H spectroscopy. In the mass spectra of the isolated compounds recorded in the electrospray mode, signals of protonated and cationized molecules are observed. Signals of all proton-containing groups were detected in NMR 1H spectra, the formation of an intramolecular hydrogen bond with an oxygen atom of the OH group, or an oxygen atom in position 3 of the pyrrolidine ring is shown.
Keywords: 3- (4-methylphenylhydrazono) -2,4-dioxopentanoic acid ethyl esters, п -toluidine, п -nitroaniline, aniline, 1-aryl-5-hydroxy-4 - [(4-methylphenyl) hydrazono] -5-methylpyrrolidin- 2,3,4-trion.
ВведениеОдним из важнейших направлений тонкого синтеза органических соединений является изучение химических свойств гидразонов, а именно 3-арилгидразоно-2,4-диоксоалканоатов, которые, в свою очередь, являются практически ценными объектами в синтезе разнообразных веществ [1], [3], [4]. Известно, что 4-арил-3-фенилгидразоно-2,4-диоксоалкановые кислоты и их производные обладают противомикробной активностью по отношению грамположительным и грамотрицательным микроорганизмам [5], [6], [7]. В связи с этим научный и практический интерес представляет выделение новых соединений на основе 1,2,4-трикарбонильных соединений функционализированных гидразоннным фрагментом и изучение их химических свойств, а также биологической активности.
Методы исследования
Строение синтезированных 1-арил-5-гидрокси-4-[(4-метилфенил)гидразоно]-5-метилпирролидин-2,3,4-трионов подтверждалось методами ИК и ЯМР 1Н спектроскопии, а также масс-спектрометрии высокого разрешения. ИК спектры соединений записаны на ИК-Фурье спектрометре Vertex 70 (Bruker, Германия); приставка НПВО, алмазный кристалл. Спектры ЯМР 1H металлокомплексов в CDCl3 получены на ЯМР Фурье-спектрометре Bruker AVANCE II (400 МГц), внутренний стандарт – ТМС. Масс-спектры соединений записаны на квадрупольно-времяпролётном масс-спектрометре сверхвысокого разрешения Orbitrap Elite, MicroTof Bruker Daltonics. Зарегистрированы положительные ионы в режиме электрораспылительной ионизации (ESI).
Методика синтеза этилового эфира 3-арилгидразоно-2,4-диоксопентановой кислоты 1 [8]. К смеси 3,7 мл (50 ммоль) ацетона, 6,7 мл (50 ммоль) диэтилоксалата, добавляют при перемешивании мелкоизмельченный металлический натрий 1,15 г (50 ммоль) и 90 мл толуола, полученную смесь оставляют до полного растворения натрия. К образующейся суспензии добавляют охлажденный до 0-5 °С хлорид 4-метилфенилдиазония, полученный из 5,35 г (50 ммоль) п-толуидина, соляной кислоты в соотношении 1:3 и 3,45 г (50 ммоль) нитрита натрия. Через 30-60 минут интенсивного перемешивания отделяют органический слой и испаряют растворитель, остаток перекристаллизовывают из этанола. Синтезированные соединения представляют собой, желтые игольчатые кристаллы, растворимые в хлороформе, диметилсульфоксиде при комнатной температуре, а при нагревании в этилацетате, метаноле, этаноле, нерастворимые в воде.
Методика синтеза 1-арил-5-гидрокси-4-[(4-метилфенил)гидразоно]-5-метилпирролидин-2,3,4-трионов 2а, 2б. К 0.3 г (1 ммоль) гидразоноэфиру 1, растворенному в 30 мл метанола, добавляют 1 ммоль ароматического амина, подкисляют 3 каплями ледяной уксусной кислоты и кипятят 30 минут при постоянном перемешивании до изменения окраски раствора. Протекание реакции контролируют с помощью тонкослойной хроматографии с использованием пластинок Silufol UV-254 в системе бензол – диэтиловый эфир – гексан в соотношении 1:2:3. Раствор оставляют при комнатной температуре до выпадения осадка. Осадок отфильтровывают и перекристаллизовывают из метанола.
5-Гидрокси-4-[(4-метилфенил)гидразоно]-5-метил-1-фенил-пирролидин-2,3,4-трион 2а. Выход: 43,3%, т. пл. 162-164 °C. Спектр ЯМР 1H, d, м.д. (J, Гц), (CDCl3): 1,76 с (3Н, СН3), 2,38 с (3Н, СН3 в 4-СН3С6Н4), 3,28 с (1Н, ОН), 7,20-7,31 м (5Н, С6Н5), 7,32 д (2H, в 4-СН3С6Н4, J 8,27), 7,36 д (2H, в 4-СН3С6Н4, J 8,27), 15,05 уш.с. (1Н, NH). Масс-спектр: m/z 324.3596 [M+H]+ (вычислено для С18H18N3O3: 324.3593), m/z 360.3415 [M+Na]+ 346.3418 (вычислено для С18H17N3O3Na: 346.3411)
5-Гидрокси-4-[(4-метилфенил)гидразоно]-1-(4-метилфенил)-5-метилпирролидин-2,3,4-трион 2б. Выход: 47,8%, т. пл. 175-177 °C. ИК спектр, ν, см-1 (ваз. масло): 3600 νNН, 2999, 2921 νOH, 1737 νC=O, 1668 νC=O, 1606, 1588, 1515 νCH, 1362 δAr-N, 1232, 1200, 1110 δпл.СН, 952, 848. Спектр ЯМР 1H, d, м.д. (J, Гц), (CDCl3): 1,66 с (3Н, СН3), 2,36 с (3Н, СН3 в 4-СН3С6Н4), 2,40 с (3Н, СН3 в 4-СН3С6Н4), 3,92 с (1Н, ОН), 7,19-7,40 м (8Н, 2С6Н4), 13,53 уш.с. (1Н, NH). Масс-спектр: m/z 338.3864 [M+H]+ (вычислено для С19H20N3O3: 338.3862), m/z 360.3683 [M+Na]+ 360.3685 (вычислено для С19H19N3O3Na: 360.3680)
Обсуждение результатов
При взаимодействии этилового эфира 3-арилгидразоно-2,4-диоксопентановой кислоты 1 с NH-мононуклеофилами получены 1-арил-5-гидрокси-4-[(4-метилфенил)гидразоно]-5-метилпирролидин-2,3,4-трионы 2а, 2б (Рис. 1), представляющие собой кристаллические вещества красного цвета, растворимые в хлороформе, ацетоне, диметилсульфоксиде, при нагревании в метаноле и этаноле, нерастворимые в воде. Выходы и температуры плавления приведены в таблице 1.
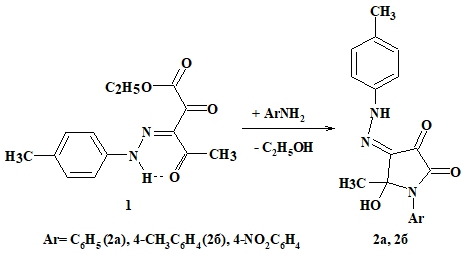
Рис. 1 – Схема синтеза 1-арил-5-гидрокси-4-[(4-метилфенил)гидразоно]-5-метилпирролидин-2,3,4-трионов 2а, 2б
Таблица 1 – Физико-химические свойства полученных соединений 2а, 2б
| Соединение | Брутто-формула (Мол. масса) | Тпл, °С | Выход, % |
 |
|||
| 2а | С18H17N3O3 (323) | 162-164 | 43,3 |
| 2б | С19H19N3O3 (337) | 175-177 | 47,8 |
Особенности структуры синтезированных соединений установлены на основании данных спектральных методов анализа (ИК, ЯМР 1H спектроскопии и масс-спектрометрии) [9], [10].
В спектрах ЯМР 1H соединений 2а и 2б, записанных в растворе дейтерохлороформа, синглетные сигналы протонов ацетильной группы находятся при 1,76 м.д. и 1,66 м.д., имеются синглетные сигналы при 2,36 м.д. и 2,38 м.д., протонов CH3 группы арилгидразонного фрагмента, соответственно. Сигналы протонов группы ОН обнаруживаются при 3,28 м.д. (2а) и 3,92 (2б). Сигналы протонов ароматических колец находятся в ожидаемой области. В слабом поле 15,05 м.д. (2а) и 13,53 м.д. (2б) имеются уширенные сигналы протона NH группы, смещение которых в слабопольную область свидетельствует об образовании внутримолекулярной водородной связи (ВВС) с атомом кислорода ОН группы или атомом кислорода в положении 3 пирролидинового кольца (Рис. 2).
В ИК спектре соединения 2б в твердом состоянии наблюдаются уширенная полоса поглощения NH группы при 3600 см-1, слабые широкие полосы поглощения ОН группы в области 2999 – 2921 см-1 смещаются в более низкочастотную область, что свидетельствует об образовании ВВС. Поглощения кетонных С=О групп обнаруживаются при 1737 см-1 и 1668 см-1.
В масс-спектрах соединений 2а, 2б, записанных для раствора в метаноле в режиме электрораспыления наблюдаются сигналы протонированных [M+H]+ и катионированных молекул [M+Na]+.
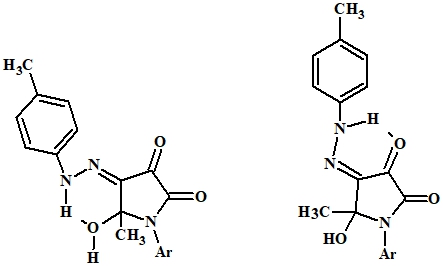
Рис. 2 – Схема образования внутримолекулярной водородной связи в соединениях 2а, 2б
При кипячении гидразоноэфира 1 с п-нитроанилином в среде метанола не удалось выделить ожидаемый продукт, что, вероятно, может быть связано с электроноакцепторным влиянием группы NO2.
Заключение
Таким образом, в результате работы получены новые 1-арил-5-гидрокси-4-[(4-метилфенил)гидразоно]-5-метилпирролидин-2,3,4-трионы 2а, 2б, определены их физико-химические характеристики, спектральными методами анализа доказано строение. Перспективность дальнейших исследований связана с изучением биологической активности полученных соединений.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Майорова О.А. Изучение стереохимии 3-(аригидразоно)фуран-2(3Н)-онов, синтез 4-(арилгидразоно)пиридазин-3(1Н)-онов / О.А. Майорова, Н.В. Бабкина, А.Ю. Егорова // Химия гетероциклических соединений. – 2015. – № 51(6). – С. 514-517.
- Левенец Т.В. Щелочной гидролиз 3-(2-арилгидразинилиден)-2,4-диоксоалканоатов / Т.В. Левенец , В.О. Козьминых, А.Н. Сизенцов // Журнал общей химии, 2019. - Т. 89, № 9. - С. 1315-1320.
- Левенец Т.В. Взаимодействие 3-арилгидразоно-2,4-диоксобутаноатов с гидразингидратом / Т.В. Левенец, В.О. Козьминых // Журнал общей химии, 2018. - Т. 88, № 6. - С. 909-913.
- Левенец Т.В. Внутримолекулярная гетероциклизация эфиров 3-арилгидразоно-2,4-диоксопентановых кислот / Т.В. Левенец, В.О. Козьминых // Башкирский химический журнал, 2018. - Т. 25, № 1. - С. 48-50.
- Быков Р.А. Синтез и биологическая активность амидов 4-арил-2-[(2-оксо-1,2-дифенилэтилиден)гидразинил]-4-оксобут-2-еновых кислот / Р.А. Быков, Н.Н. Трапезникова, С.Ю. Баландина и другие // Химико-фармацевтический журнал. – 2018. – № 5. – С. 33-36.
- Пулина Н.А. Синтез и биологическая активность замещенных 4-арил-2-метиленгидразино-4-оксобут-2-еновых кислот и их производных / Н.А. Пулина, В.В. Залесов, О.А. Быстрицкая и другие // Химико-фармацевтический журнал. – 2009. – № 8. – С. 17-20.
- Нуркенов О.А. Синтез и биологическая активность гидразонов o- и n-гидроксибензойных кислот. Пространственное строение 5-бром-2-гидроксибензилиден-4-гидроксибензогидразида / О.А. Нуркенов, Ж.Б. Сатпаева, И. А. Щепеткин и другие // Журнал общей химии. – – Т: 87(149), № 10. – С. 1639 – 1646.
- Левенец Т.В., Синтез и структура 3-арилгидразоно-2,4-диоксоалканоатов / Т.В. Левенец, В.О. Козьминых, Е.Н. Козьминых // Изв. вузов. Химия и хим. технология. – 2013. – Т. 56. – Вып. 2. – С. 22-25.
- Преч Э. Определение строения органических соединений. Таблицы спектральных данных / Э. Преч, Ф. Бюльманн, К. Аффольтер. – М.: Мир; БИНОМ. Лаборатория знаний, 2006. – 438 с.
- Сильверстейн Р. Спектрометрическая идентификация органических соединений / Р. Сильверстейн, Ф. Вебстер, Д. Кимл. – М.: БИНОМ. Лаборатория знаний, 2012. – 557 с.
Список литературы на английском языке / References in English
- Mayorova O.A. Izucheniye stereokhimii 3-(arigidrazono)furan-2(3Н)-onov, sintez 4-(arilgidrazono)piridazin-3(1Н)-onov [Study of the stereochemistry of 3-(aryhydrazono)furan-2-(3H)-ones, synthesis of 4-(arylhydrazono)pyridazin-3(1H)-ones] / O.A. Mayorova, N.V. Babkina, A.Yu. Egorova // Khimiya geterotsiklicheskikh soyedineniy [Chemistry of heterocyclic compounds]. - 2015. - No. 51 (6). - P. 514-517. [in Russian]
- Levenets T.V. Shchelochnoy gidroliz 3-(2-arilgidraziniliden)-2,4-dioksialkanoatov [Alkaline hydrolysis of 3-(2-arylhydrazinilidene) - 2,4-dioxoalkanoates] / T.V. Levenets, V.O. Kozminykh, A.N. Sizentsov // Zhurnal obshchey khimii [Journal of General chemistry], 2019. - Vol. 89, No. 9. - Pp. 1315-1320. [in Russian]
- Levenets T.V. Vzaimodeystvie 3-arilgidrazono-2,4-dioksobutanoatov s gidrazingidratom [Interaction of 3-arylhydrazono-2,4-dioxobutanoates with hydrazine hydrate] / T.V. Levenets, V.O. Kozminykh // Zhurnal obshchey khimii [Journal of General chemistry 2018. - Vol. 88, № 6. - P. 909-913. [in Russian]
- Levenets T.V. Vnutrimolekulyarnaya geterotsiklizatsiya efirov 3-arilgidrazono-2,4-dioksopentanovykh kislot / T.V. Levenets, V.O. Koz'minykh // Bashkirskiy khimicheskiy zhurnal [Bashkir chemical journal], 2018. - Vol. 25, № 1. - P. 48-50. [in Russian]
- Bykov R.A. Sintez i biologicheskaya aktivnost' amidov 4-aril-2-[(2-okso-1,2-difeniletiliden)gidrazinil]-4-oksobut-2-enovykh kislot [Synthesis and biological activity of amides of 4-aryl-2 - [(2-oxo-1,2-diphenylethylidene) hydrazinyl] - 4-oxobut-2-eno acids] / R.A. Bykov, N.N. Trapeznikova, S.Yu. Balandina i drugie // Khimiko-farmatsevticheskiy zhurnal [Chemical and pharmaceutical journal]. – 2018. – № 5. – P. 33-36. [in Russian]
- Pulina N.A. Sintez i biologicheskaya aktivnost' zameshchennykh 4-aril-2-metilengidrazino-4-oksobut-2-enovykh kislot i ikh proizvodnykh [Synthesis and biological activity of substituted 4-aryl-2-methylene-hydrazino-4-oxobut-2-eno acids and their derivatives] / N.A. Pulina, V.V. Zalesov, O.A. Bystritskaya i drugie // Khimiko-farmatsevticheskiy zhurnal [Chemical and pharmaceutical journal]. – 2009. – № 8. – P. 17-20. – S. 33-36. [in Russian]
- Nurkenov O.A. Sintez i biologicheskaya aktivnost' gidrazonov o- i n-gidroksibenzoynykh kislot. Prostranstvennoe stroenie 5-brom-2-gidroksibenziliden-4-gidroksibenzogidrazida [Synthesis and biological activity of o - and n-hydroxybenzoic acid hydrazones. Spatial structure of 5-bromo-2-hydroxybenzylidene-4-hydroxybenzohydrazide] / O.A. Nurkenov, Zh.B. Satpaeva, I. A. Shchepetkin i drugie // Zhurnal obshchey khimii [Journal of General chemistry]. – 2017. – Vol. 87(149), № 10. – P. 1639 – 1646.
- Levenets T.V., Sintez i struktura 3-arilgidrazono-2,4-dioksoalkanoatov [Synthesis and structure of 3-arylhydrazono-2,4-dioxoalkanoates] / T.V. Levenets, V.O. Koz'minykh, E.N. Koz'minykh // Izv. vuzov. Khimiya i khim. Tekhnologiya [Chemistry and chemical technology]. – 2013. – Vol. 56. – №. 2. – P. 22-25.
- Prech Je. Opredelenie stroenija organicheskih soedinenij. Tablicy spektral'nyh dannyh [Determination of the structure of organic compounds. Tables of spectral data] / Je. Prech, F. Bjul'mann, K. Affol'ter. – M.: Mir; BINOM. Laboratorija znanij, 2006. – 438 p. [in Russian]
- Sil'verstejn R. Spektrometricheskaja identifikacija organicheskih soedinenij [Spectrometric identification of organic compounds] / R. Sil'verstejn, F. Vebster, D. Kiml. – M.: BINOM. Laboratorija znanij, 2012. – 557 p. [in Russian]
