АППРОКСИМАЦИЯ НЕКОТОРЫХ КРИВЫХ РАВНОВЕСИЯ БИНАРНЫХ СИСТЕМ АНАЛИТИЧЕСКОЙ ЗАВИСИМОСТЬЮ
АППРОКСИМАЦИЯ НЕКОТОРЫХ КРИВЫХ РАВНОВЕСИЯ БИНАРНЫХ СИСТЕМ АНАЛИТИЧЕСКОЙ ЗАВИСИМОСТЬЮ
Аннотация
В статье рассматриваются равновесные кривые пар-жидкость для ряда физико-химических систем. Бинарные системы играют важную роль в физико-химических процессах, таких как абсорбция, ректификация, перегонка и другие. Целью работы является выбор формулы, которая является аппроксимирующей экспериментальные данные для большого набора физико-химических систем пар-жидкость, и позволяет описать кривые равновесия для отмеченных процессов в бинарных системах. Предложенная формула представляет собой математическую модель, которая косвенным образом учитывает влияние физико-химических свойств компонентов, температуры и давления на равновесное распределение компонентов в процессе. Задачей исследования являлся также подбор коэффициентов в формуле для некоторых систем и оценка погрешности соответствия экспериментальных и теоретических данных.
Использование данной аппроксимирующей формулы позволяет исследователям и инженерам более точно прогнозировать и оптимизировать процессы в бинарных системах. Так, для процессов дистилляции, при оптимизации таких параметров как давление и температура, можно изменять равновесные концентрации компонентов, что увеличивает выход целевого продукта.
Получены данные об аппроксимации некоторых бинарных систем при равновесии, которые представлены в таблице, что является научной новизной работы, приведена оценка погрешности данной формулы, подтвердившее хорошую точность. Найдена оригинальная функция простого вида для описания процесса простой перегонки. Это имеет практическое значение для разработки эффективных методов разделения смесей и повышения энергоэффективности производственных процессов.
1. Введение
Кривые равновесия бинарных систем пар-жидкость представляют собой важный элемент в области физической химии и химической технологии, поскольку они иллюстрируют взаимосвязь между составом паровой и жидкой фазами при достижении термодинамического равновесия. Данные кривые позволяют исследовать и углубленно анализировать поведение различных смесей, что имеет широкое применение при анализе физико-химических процессов. Определение кривых равновесия может осуществляться экспериментально, путем измерения состава паровой и жидкой фаз при заданных термодинамических условиях. В типичной ситуации для оценки термодинамических свойств и поведения бинарных систем пар-жидкость, приходится использовать табличные данные, полученные эксперементальным путём
. Эти данные обычно включают в себя информацию о температуре, давлении, составах и парциальных давлениях компонентов в различных условиях. В некоторых случаях для целей аппроксимации равновесных зависимостей удается применять формулы закона Рауля и на определенном интервале закон Генри , .Среди равновесных кривых многие из них имеют похожую геометрическую структуру. Это позволяет предложить формулу, аппроксимирующую экспериментальные данные, зависящую от определенного числа параметров, подбором которых можно добиться высокой точности аппроксимации.
2. Основные результаты
В данной работе используется двухпараметрическая формула:
В этом случае х — это мольная доля низкокипящего компонента (НК) в жидкой фазе, у*(х) — равновесная концентрация НК между паром и жидкостью, α и β — параметры, выбор которых позволяет аппроксимировать реальные системы. Соотношение (1) дает возможность аналитически находить определенные интегралы типа числа единиц переноса, встречающиеся при описании процессов перегонки, ректификации и возможно некоторых других. Данное соотношение было предложено и использовано для описания отмеченных процессов в насадочных колоннах в работах
, Отметим также, что выражение (1) применено в работах , для описания ректификации в тарельчатой системе для одной конкретной системы.Зависимость (1) удовлетворяет необходимым для равновесной функции требованиям: у*(0)=0, у*(1)=1. Отметим, что соотношение (1) не может аппроксимировать системы, имеющие азеотропную точку. Такая аппроксимация нецелесообразна, когда азеотропная точка имеет важное значение для описания конкретного процесса. В этом случае формулу (1) можно использовать в интервале от x = 0 до координаты азеотропной точки.
Заметим, что в частном случае α+β=1 формула (1) сводится к известной зависимости Рауля
, . На рис. 1 продемонстрированы отдельные кривые, описываемые уравнением (1). Видим, что некоторые приведенные графики функций (1) содержат кривые формы, часто встречающейся на практике.Отметим также, что аппроксимационное соотношение (1) можно использовать и при расчете процессов (например абсорбции) когда кривая равновесия расположена ниже диагонали y = x (например кривая 3 рис. 1).
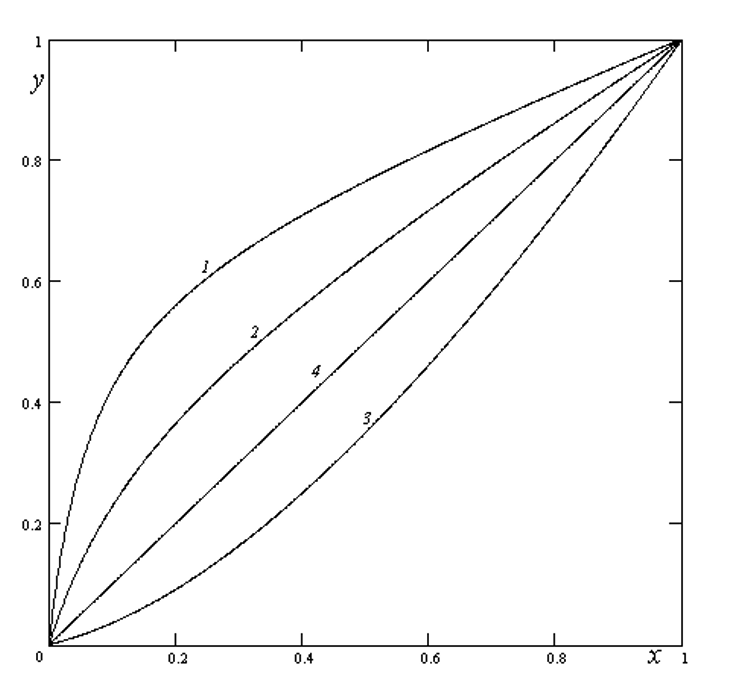
Рисунок 1 - Равновесные кривые y*(x) определяемые формулой (2)
Примечание: 1 – α = 1,5, β = 0,1; 2 – α = 1,9, β = 0,3; 3 – α = 2, β = 4; 4 – диагональ y = x (β = 1)
В таблице представлены результаты, полученные путём обработки данных по равновесной кривой методом наименьших квадратов для ряда систем.
Таблица 1 - Значения параметров α и β для некоторых систем
Система | α | β | δ |
Ацетон-бензол | 1,586 | 0,281 | 8,177*10-3 |
Ацетон-вода | 1,303 | 0,017 | 0,027 |
Ацетон-этиловый спирт | 1,653 | 0,245 | 7,646*10-3 |
Бензол-толуол | 0,568 | 0,411 | 1,351*10-3 |
Вода-уксусная кислота | 0,697 | 0,547 | 2,73*10-3 |
Метиловый спирт-вода | 1,323 | 0,118 | 5,863*10-3 |
Метиловый спирт-этиловый спирт | 0,041 | 0,672 | 5,903*10-3 |
Муравьиная кислота-уксусная кислота | 1,35 | 0,62 | 4,117*10-3 |
Сероуглерод-четырёххлористый углерод | 0,859 | 0,326 | 4,456*10-3 |
Хлороформ-бензол | -0,26 | 0,679 | 9,004*10-3 |
Этилацетат-уксусная кислота | 0,374 | 0,301 | 4,134*0-3 |
Бромистый этил-этиловый спирт | 1,201 | 0,019 | 0,022 |
Бромистый этил-бензол | 0,565 | 0,296 | 5,506*10-3 |
Бромистый этил-гептан | 0,97 | 0,08 | 4,54*10-3 |
Акролеин-метилэтилкетон | 0,283 | 0,543 | 0,017 |
Аммиак-вода | 0,816 | 0,057 | 0,012 |
Там же приведены соответствующие данные об среднеквадратичном отклонении экспериментальных данных от рассматриваемой зависимости (1). Эта величина определяется так:
где N — это число экспериментальных точек, y*(xj) – значение экспериментальной равновесной функции в точке xj. Поиск оптимальных значений параметров α и β проводится с помощью стандартной программы системы MathCad. При этом задавалось начальные приближенные значения этих параметров. В качестве наглядной иллюстрации точности апроксимации формулой (1) на рис. 2 представлена конкретная система.
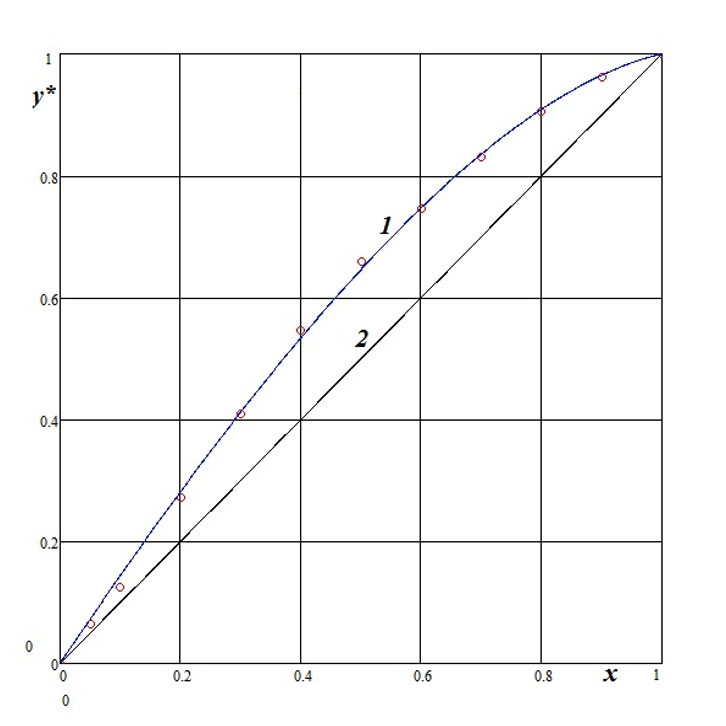
Рисунок 2 - Равновесная кривая y*(x) бинарной системы хлороформ-бензол
Примечание: 1 – равновесная кривая; 2 – диагональ
При описании некоторых процессов требуется знать равновесную кривую в меньшем интервале независимой переменной, чем рассматриваемом здесь х ∈ (0 , 1). В таком случае можно добиться меньшей погрешности, определяемой формулой (2). То есть формула (1) становится более надежной, чем при параметрах, представленных в таблице.
В качестве примера использования формулы (1) приведем расчетную зависимость для известного
, уравнения простой перегонки:где G — количество жидкости в кубе испарителе, GF — начальное количество перегоняемой смеси, x — состав НК в жидкости, xf — содержание НК в начальной смеси, y* — равновесная концентрация НК в паре. Для уравнения (3) после подстановки в него соотношения (1) и выполнения интегрирования, получаем выражение
Например, для системы бензол-толуол, взяв соответствующие значения параметров α = 0,568 и β = 0411 из таблицы, из формулы (4) следует выражение
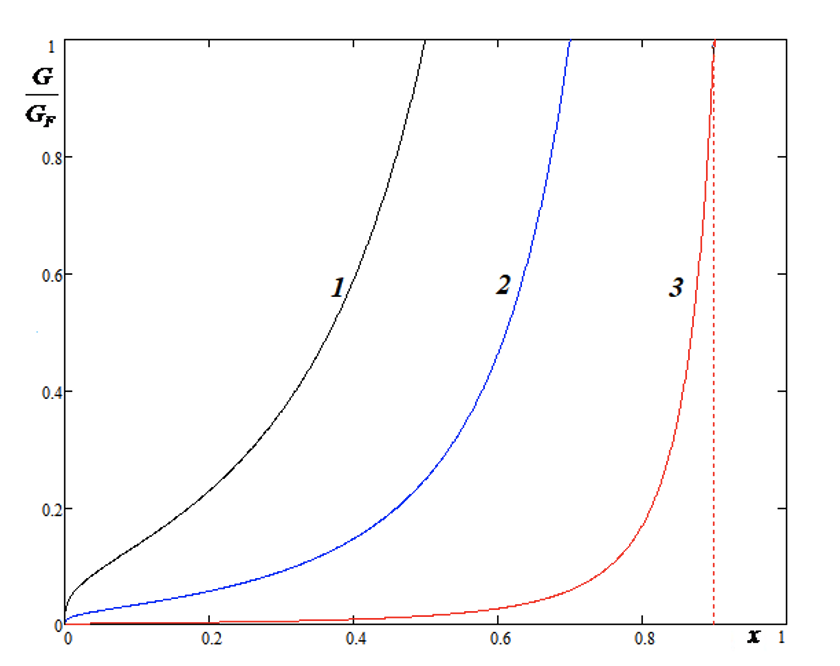
Рисунок 3 - Графики функции G/GF, определенные зависимостью (5)
Примечание: 1 – xf = 0,5; 2 – xf = 0,7; 3 – xf = 0,9
3. Заключение
В соответствии с целью работы, получены данные об аппроксимации некоторых бинарных систем при равновесии, которые представлены в таблице 1, что представляет новизну этой работы. Естественно, что формулу (1) можно использовать и для ряда других, не рассмотренных здесь систем.
Далее, найдена оригинальная (новая) функция простого вида (4) для описания процесса простой перегонки.
Таким образом, статья представляет интерес для исследования процессов ректификации, перегонки бинарных систем и ряда других процессов, кривые равновесия для которых хорошо описываются зависимостью (1), предлагая аппроксимирующую формулу, которая может быть использована для более точного моделирования и оптимизации процессов разделения в различных промышленных и научных приложениях.
