ВЛИЯНИЕ ФТОРИД-ИОНОВ НА ЭЛЕКТРОХИМИЧЕСКОЕ ПОВЕДЕНИЕ ЦИРКОНИЯ В ХЛОРИДНЫХ РАСПЛАВАХ
ВЛИЯНИЕ ФТОРИД-ИОНОВ НА ЭЛЕКТРОХИМИЧЕСКОЕ ПОВЕДЕНИЕ ЦИРКОНИЯ В ХЛОРИДНЫХ РАСПЛАВАХ
Аннотация
В данной работе посредством методов циклической, квадратно-волновой и дифференциально-импульсной вольтамперометрии было исследовано электрохимическое поведение циркония в расплавах на основе эвтектических смесей хлоридов щелочных металлов NaCl–2CsCl, LiCl–KCl и эквимольной смеси NaCl–KCl, в частности, влияние на него добавки фторид-ионов, температуры, концентрации циркония, а также влияние среднего радиуса катиона соли-растворителя. Цирконий в расплав вводился в виде K2ZrF6 (от 1 до 3 масс. %). Температурный диапазон составлял от 550 до 750°C. Все эксперименты проводились в атмосфере высокочистого аргона (99.998% Ar). Показано, что потенциалы восстановления циркония смещаются в область положительных значений с ростом температуры, а также уменьшением концентрации и среднего радиуса катиона соли-растворителя.
1. Введение
Проблема переработки отработавшего ядерного топлива (ОЯТ) является одной из главных в дальнейшем развитии атомной энергетики. Цирконий является одним из основных конструкционных материалов ядерных реакторов типа РБМК. Циркониевые сплавы, легированные ниобием, используются при изготовлении топливных каналов и каналов системы управления защиты энергоблоков РБМК. При захоронении данных материалов около 99% от общей активности определяется активностью долгоживущего изотопа ниобия 94Nb, но при этом его объемная доля составляет лишь 2%.
Одним из вариантов переработки ОЯТ является пирохимический метод, подразумевающий использование в качестве рабочей среды расплавленной соли. Предпочтение, в основном, отдаётся смесям хлоридов щелочных металлов.
Электрохимическое поведение циркония в галогенидных расплавах исследовано достаточно широко , , , , и , , , , , но механизмы процессов восстановления ионов циркония, предлагаемые разными авторами, значительно отличаются.
Так, авторы утверждают, что в системе LiCl–KCl–ZrCl4 (1 мас. % ZrCl4) при 550 °C ионы Zr(IV) восстанавливаются до Zr(II). Затем эти две формы могут восстанавливаться до нерастворимого монохлорида циркония ZrCl, который в, свою очередь, восстанавливается до металлического циркония.
Полякова и Чен считают, что катодное восстановление Zr(IV) в хлоридных расплавах происходит по механзиму Zr4+ → Zr2+ → Zr с образованием растворимого дихлорида циркония.
Однако Базилье и соавторы предположили, что катодное восстановление циркония в хлоридных расплавах включает две реакции восстановления Zr4+ → Zr2+ → Zr с образованием нерастворимых дихлоридов циркония, а его диспропорция дает порошок металлического циркония и вновь образует комплекс М2ZrCl6.
Полякова и соавторы обнаружили, что в расплаве NaCl–KCl–ZrCl4 с добавлением фторида натрия, а также в NaCl–KCl–K2ZrF6, КСl–К2ZrF6 и KCl–KF–K2ZrF6, электрохимическое восстановление циркония происходит обратимо в одну стадию по четырехэлектронной реакции: Zr4++ 4е → Zr.
Чен с соавторами предположили, что электрохимическая реакция восстановления ионов циркония в хлоридно-фторидных расплавах с низким содержанием фторида представляет собой процесс двухстадийного двухэлектронного восстановления, но при более высокой концентрации фторида основные комплексные ионы циркония(IV) восстанавливаются в одну стадию до металлического циркония.
Таким образом, анализ литературы показывает, что единого мнения касательно процессов электрохимического восстановления ионов циркония нет. Целью данной работы являлось исследование влияния добавки фторид-ионов на процессы восстановления ионов циркония в хлоридных расплавах, а также изучение влияния температуры, концентрации циркония и среднего радиуса катиона соли-растворителя.
2. Методы и принципы исследования
Рабочие смеси хлоридов щелочных металлов необходимого состава готовили сплавлением соответствующих индивидуальных солей, которые предварительно сушили при вакуумировании в течение 1,5-2 часов. После получения эвтектических смесей в расплавленном виде через них барботировали хлороводород в течение 3 часов для удаления остаточной влаги и окисд-ионов.
Цирконий в рабочий электролит вводили непосредственно перед каждым экспериментом в виде гексафтороцирконата калия, K2ZrF6.
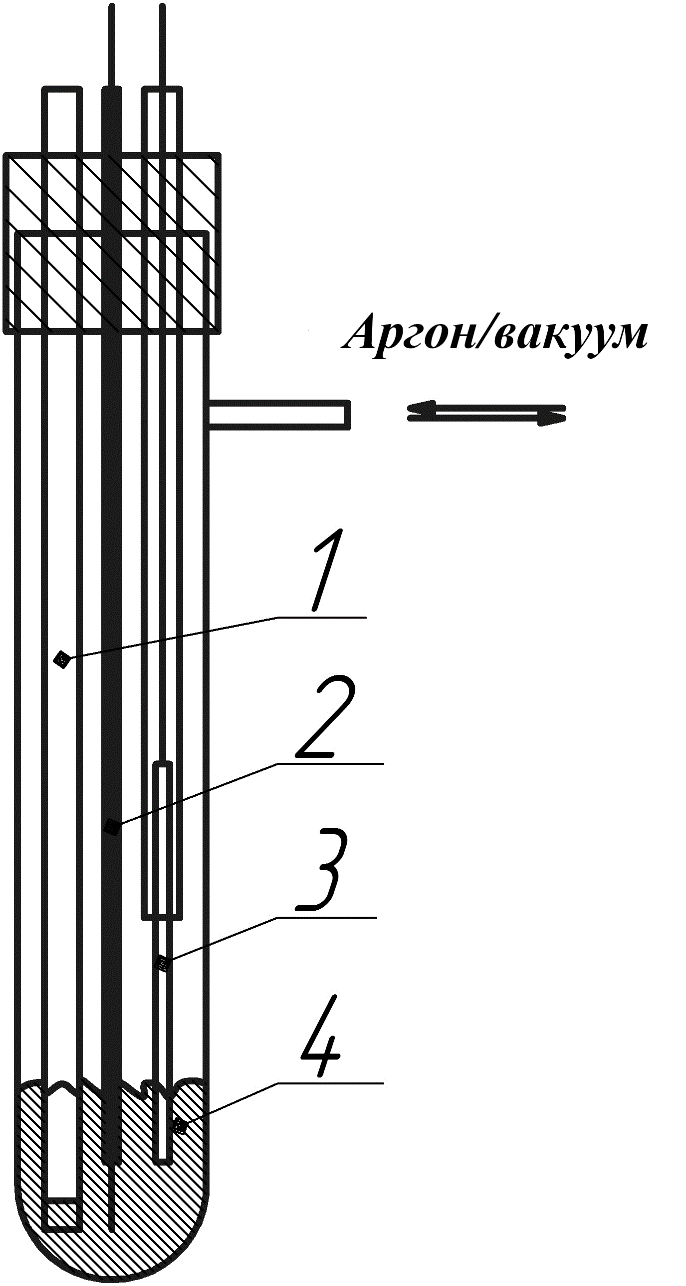
Рисунок 1 - Принципиальная схема электрохимической ячейки
Примечание: 1 – хлоридсеребряный электрод сравнения; 2 – вольфрамовый рабочий электрод; 3 – стеклоуглеродный противоэлектрод; 4 – рабочий расплав
3. Результаты и обсуждение
Чтобы оценить влияние фторид-ионов на электрохимическое поведение циркония в хлоридных расплавах, была проведена серия экспериментов, включавшая в себя опыты по исследованию систем на основе эвтектической смеси NaCl–2CsCl как с фторид-ионами, так и без них. Циклические вольтамперограммы, полученные в ходе данных экспериментов, приведены на рисунке 2.
На вольтамперограмме, зарегистрированной в расплаве чистой соли-растворителя NaCl–2CsCl при 550 ℃, наблюдается только одна пара пиков. Эти пики связаны с катодным восстановлением (нижний пик) и анодным окисением (верхний пик) щелочного металла. При введении в расплав циркония в виде тетрахлорида ZrCl4 на вольтамперограмме появляется катодный пик в области –1,3 В, который можно связать с процессом восстановления Zr(IV)/Zr(0). В случае, если в расплав цирконий вводили в виде гексафтороцирконата калия K2ZrF6, катодный пик, соответствующий восстановлению Zr(IV)/Zr(0) значительно смещался в область отрицательных значений.
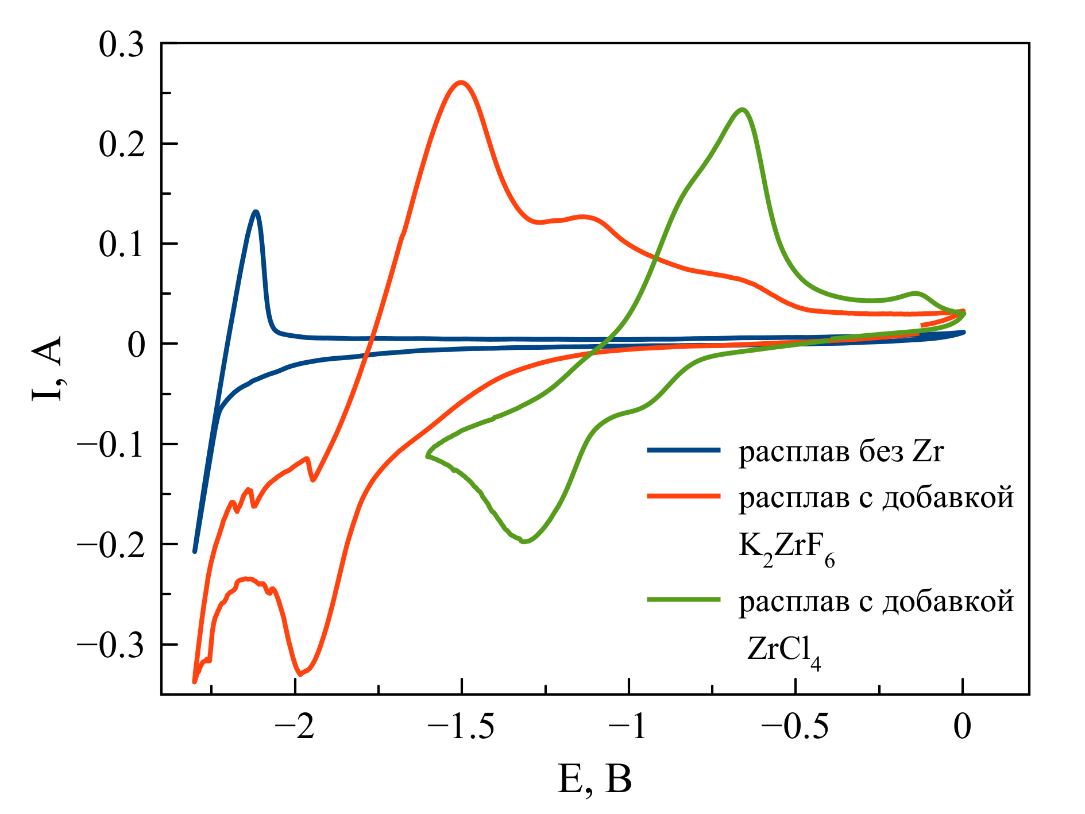
Рисунок 2 - Циклические вольтамперограммы, зарегистрированные в расплавах на основе эвтектической смеси NaCl–2CsCl, при 550 ℃
Циклические, дифференциально-импульсные и квадратно-волновые вольтамперограммы (ЦВА, ДИВА и КВВА), зарегистрированные в данной серии опытов приведены на рисунках 3-5, соответственно. Анализ вольтамперограмм, полученных разными методами, позволяет отметить, что повышение температуры приводит к смещению потенциала процесса катодного восстановления Zr(IV)/Zr(0) в область положительных значений. Следует отметить, что при 550 ℃ на циклических вольтамперограммах наблюдается два анодных пика, однако при 650 и 750 ℃ эти пики, вероятно, перекрываются и на экспериментальных кривых присутствует один широкий пик, являющийся суперпозицией двух близкорасположенных анодных волн.
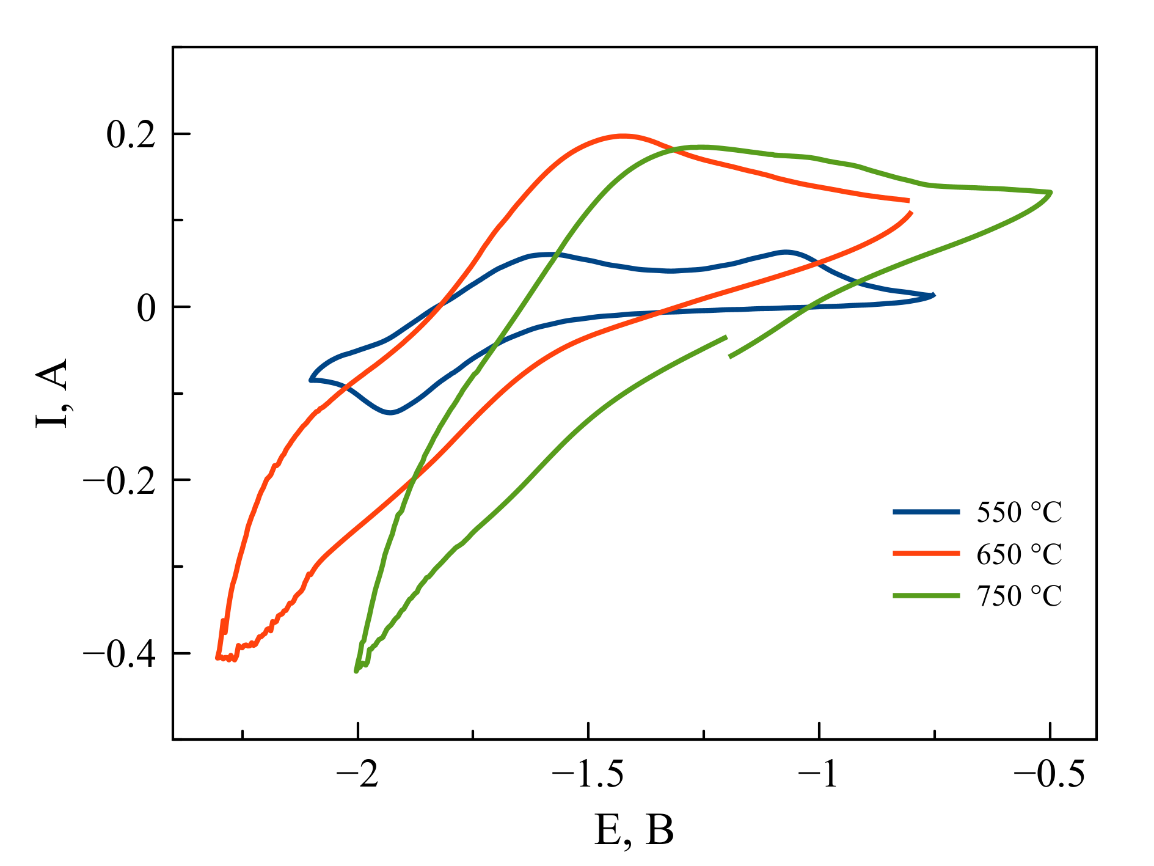
Рисунок 3 - Циклические вольтамперограммы, зарегистрированные в расплаве на основе NaCl–2CsCl с концентрацией K2ZrF6 2 масс. %. T = 550, 650, 750 ℃
Примечание: скорость развёртки потенциала 100 мВ/сек
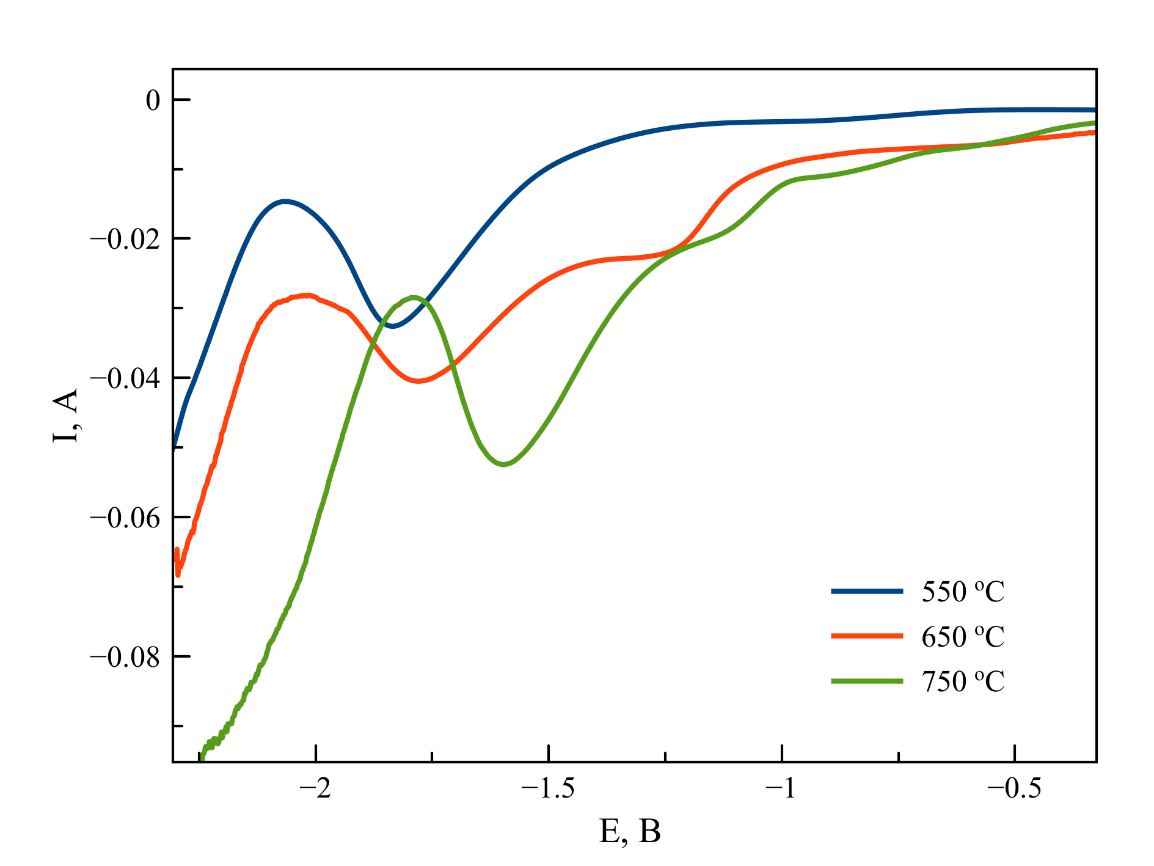
Рисунок 4 - Дифференциально-импульсные вольтамперограммы, зарегистрированные в расплаве на основе NaCl–2CsCl с концентрацией K2ZrF6 2 масс. %. T = 550, 650, 750 ℃
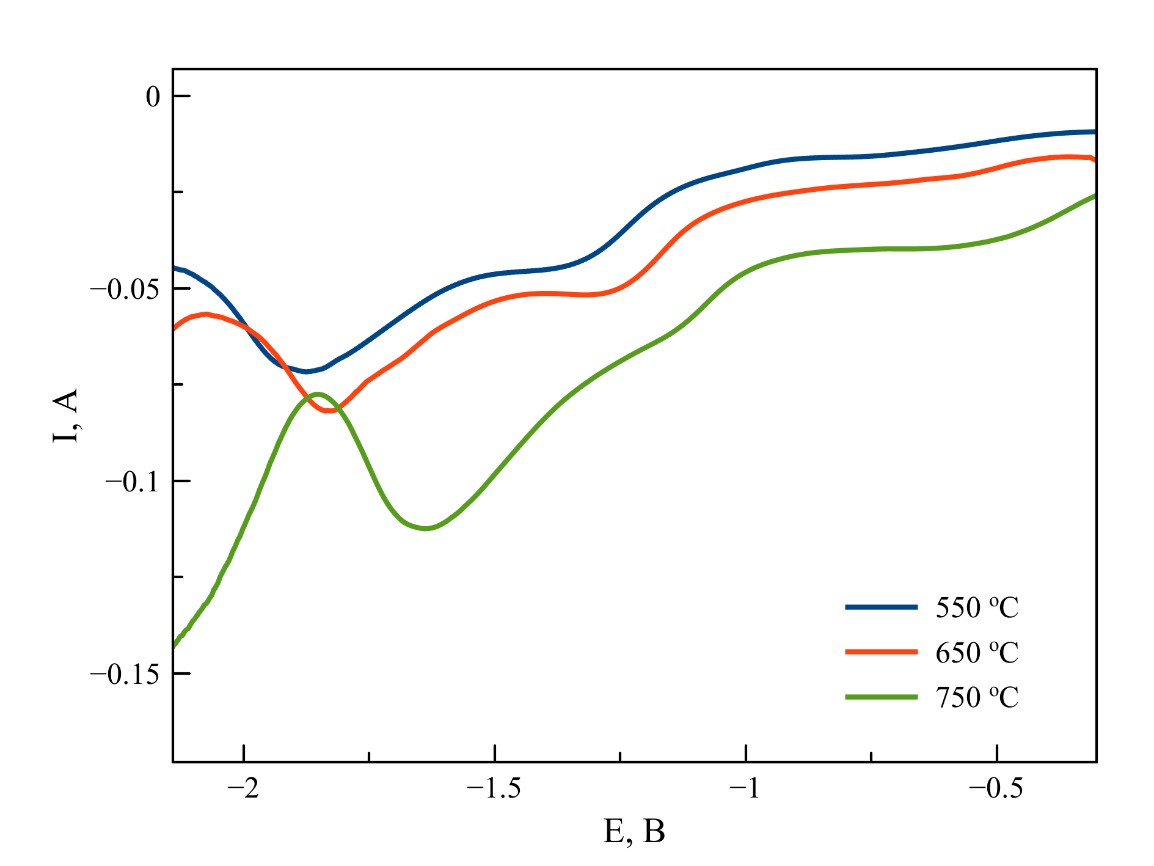
Рисунок 5 - Квадратно-волновые вольтамперограммы, зарегистрированные в расплаве на основе NaCl–2CsCl с концентрацией K2ZrF6 2 масс. %. T = 550, 650, 750 ℃
Примечание: частота импульсов при поляризации рабочего электрода 60 Гц
Таблица 1 - Влияние температуры на потенциал катодного пика восстановления ионов циркония в расплавах на основе эвтектической смеси NaCl–2CsCl
T, ℃ | Ep по ЦВА, В | Ep по ДИВА, В | Ep по КВВА, В |
550 | –1,92 | –1,83 | –1,87 |
650 | –1,69 | –1,78 | –1,83 |
750 | –1,54 | –1,59 | –1,64 |
После оценки влияния температуры было исследовано влияние концентрации гексафтороцирконата калия на электрохимическое поведение циркония в расплаве NaCl–2CsCl. Были зарегистрированы вольтамперограммы в расплавах на основе эвтектической смеси NaCl–2CsCl с концентрацией гексафтороцирконата калия равной 1, 2 и 3 масс. % при 550 ℃ (см. рис. 6, рис. 7, рис. 8).
По полученным циклическим вольтамперограммам (рисунок 6) можно сделать вывод, что повышение концентрации ионов циркония приводит к закономерному увеличению пикового значения силы тока процессов восстановления и окисления, что согласуется с уравнением Рэндлса-Шевчика:
где n – число электронов, F – постоянная Фарадея, C0 – концентрация электроактивной формы, S – площадь поверхности рабочего электрода, D – коэффициент диффузии электроактивной формы, v – скорость поляризации рабочего электрода, R – универсальная газовая постоянная, T – абсолютная температура.
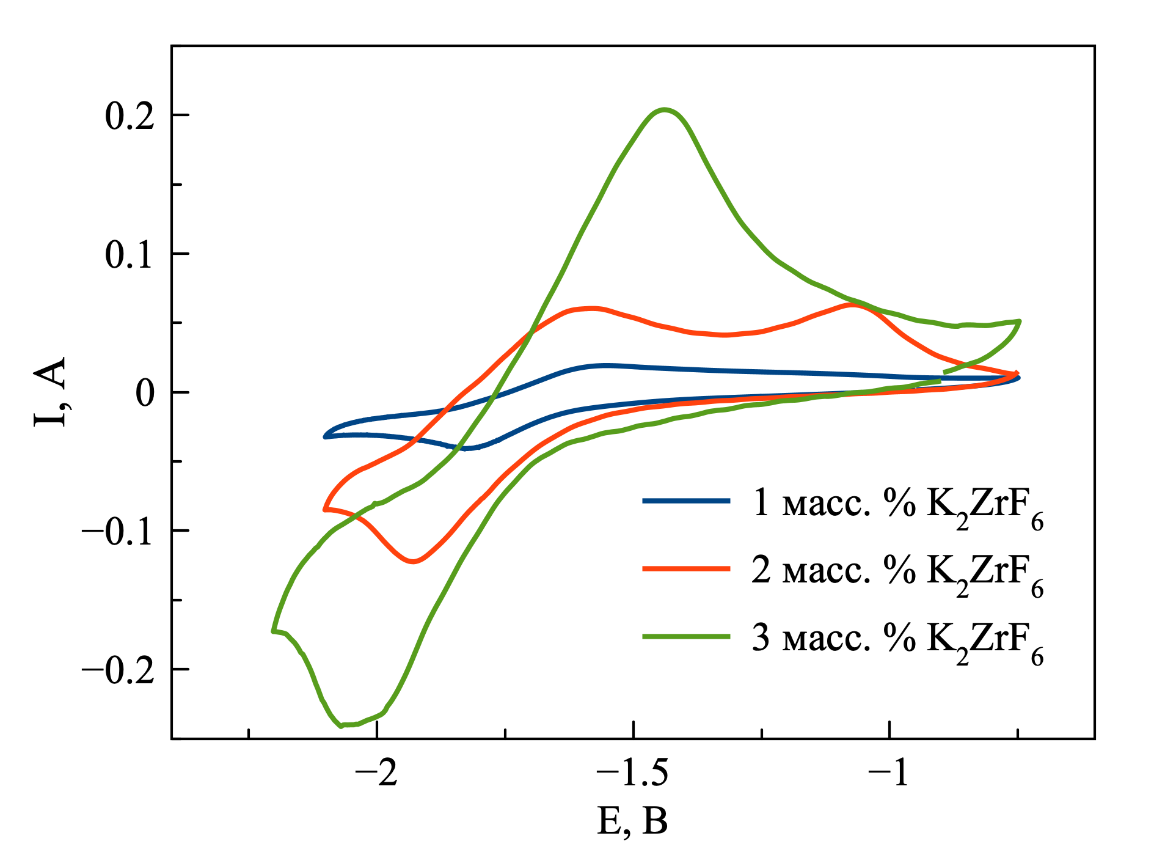
Рисунок 6 - ЦВА, зарегистрированные в расплаве на основе NaCl–2CsCl с различной концентрацией K2ZrF6, T = 550 ℃
Примечание: скорость развёртки потенциала100 мВ/сек
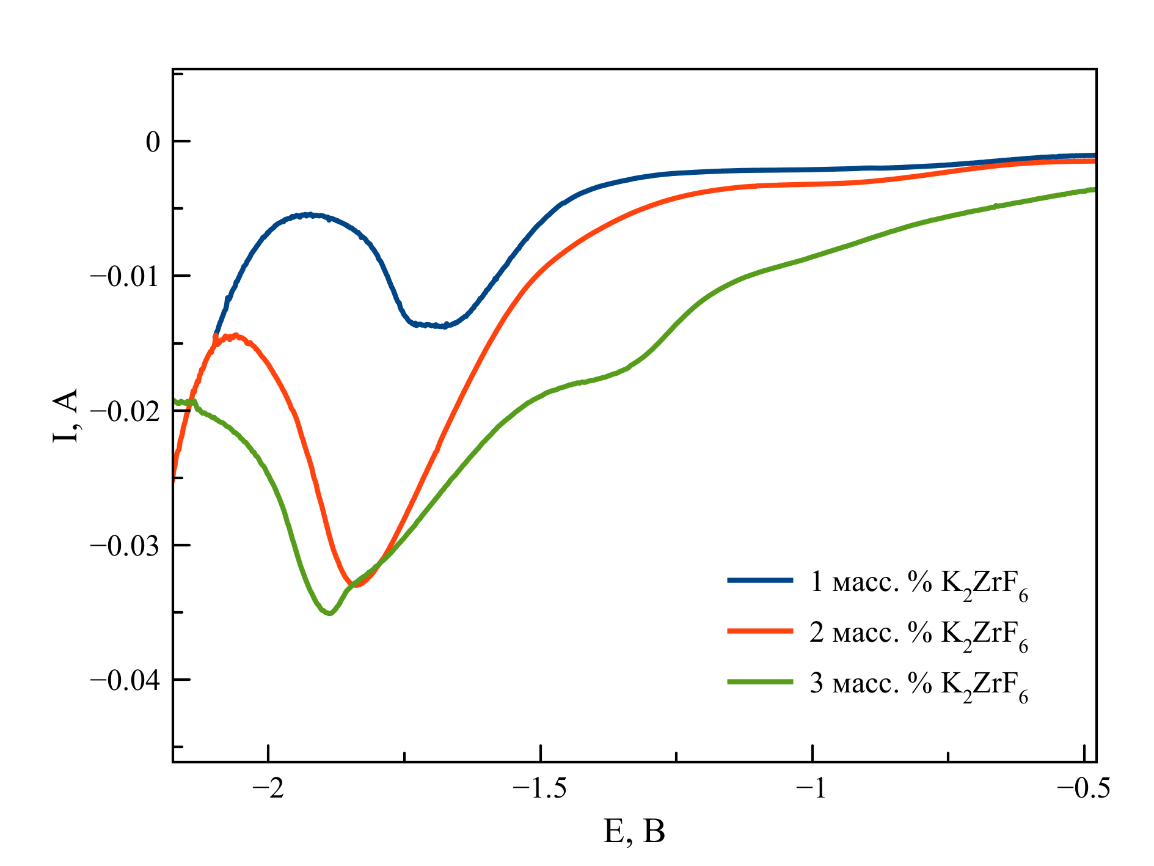
Рисунок 7 - ДИВА, зарегистрированные в расплаве на основе NaCl–2CsCl с различной концентрацией K2ZrF6
Примечание: T = 550 ℃
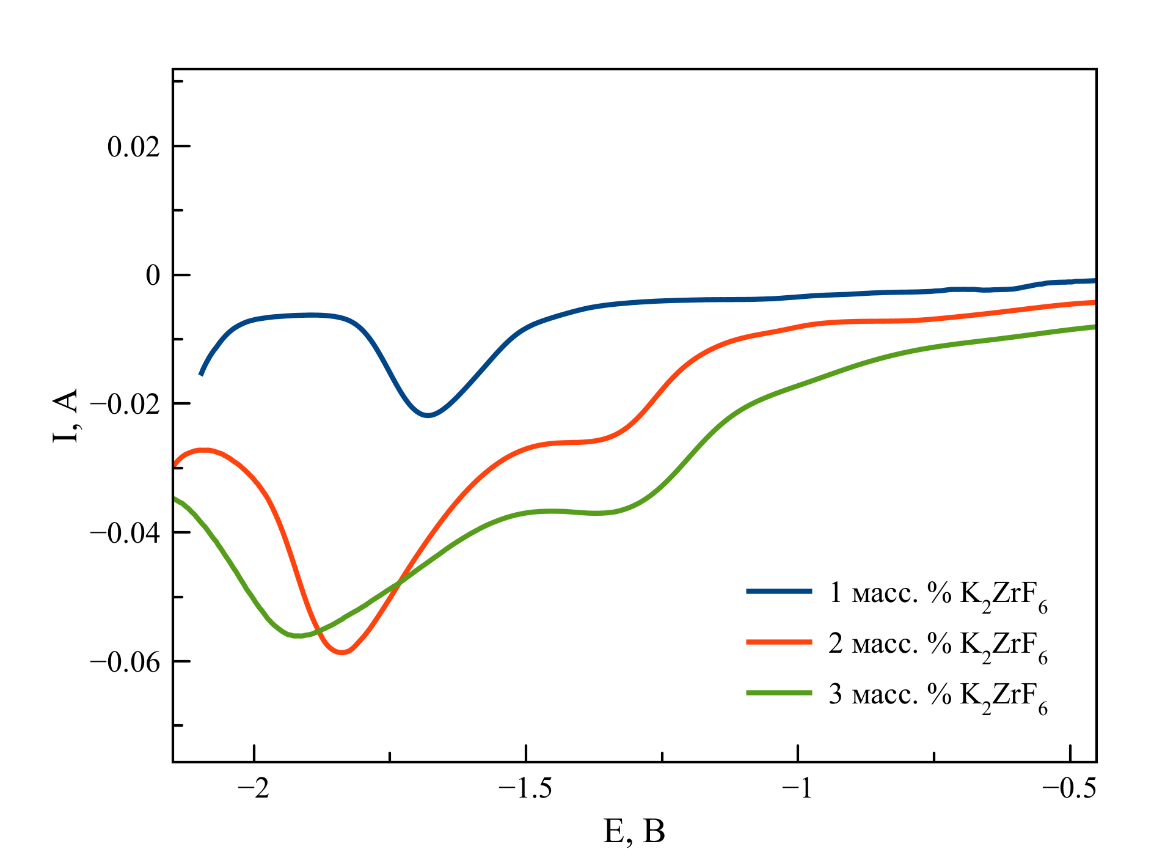
Рисунок 8 - КВВА, зарегистрированные в расплаве на основе NaCl–2CsCl с различной концентрацией K2ZrF6
Примечание: T = 550 ℃
Таблица 2 - Влияние концентрации фтороцирконата калия на Значения потенциала процессов восстановления в расплавах на основе эвтектической смеси NaCl–2CsCl
С (K2ZrF6), масс. % | Ep по ЦВА, В | Ep по ДИВА, В | Ep по КВВА, В |
1 | –1,82 | –1,69 | –1,68 |
2 | –1,92 | –1,83 | –1,84 |
3 | –1,99 | –1,89 | –1,92 |
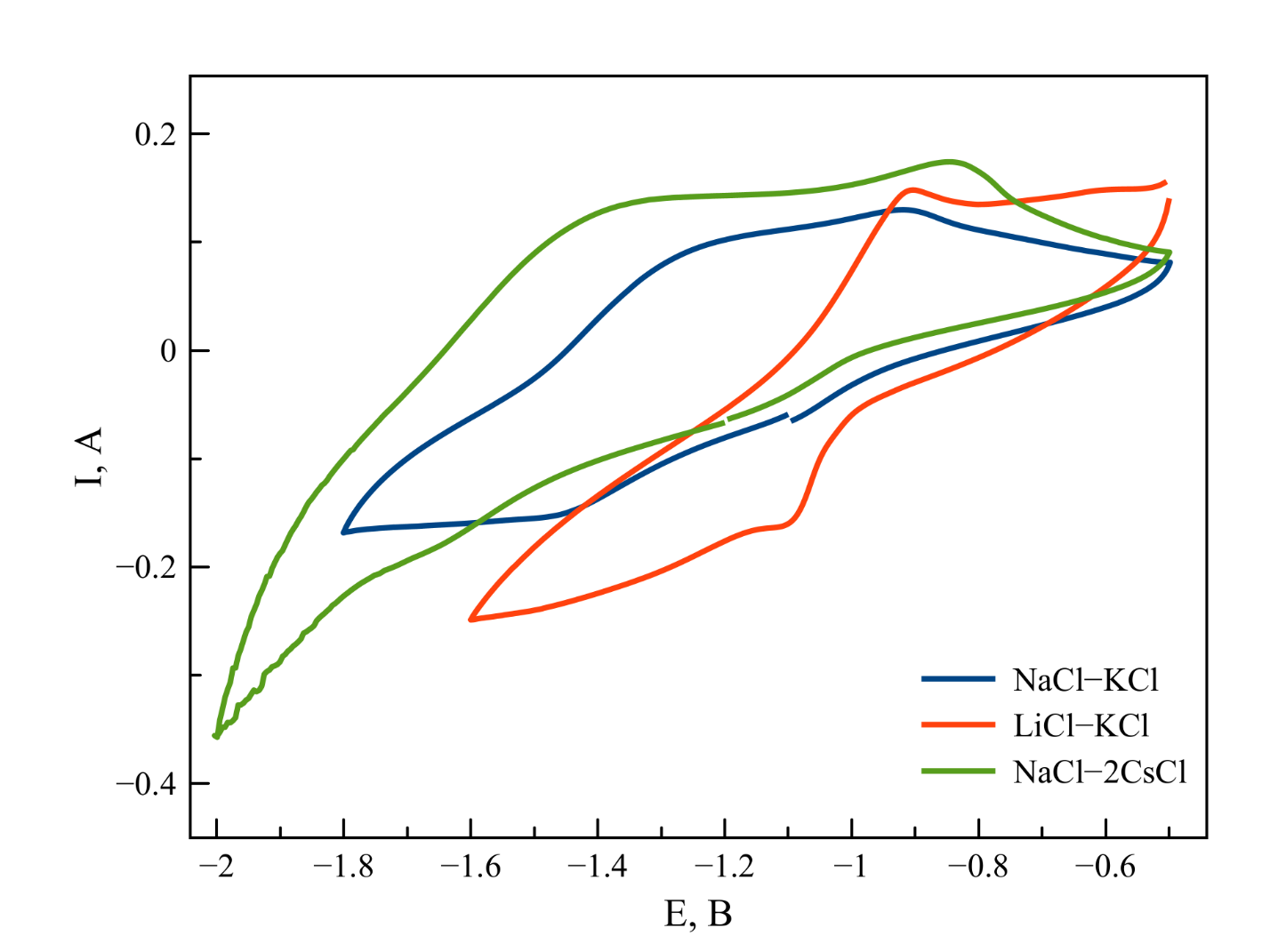
Рисунок 9 - ЦВА, зарегистрированные в хлоридных расплавах, содержащих фтороцирконат калия при 750 ℃
Примечание: скорость развертки потенциала 60 мВ/с
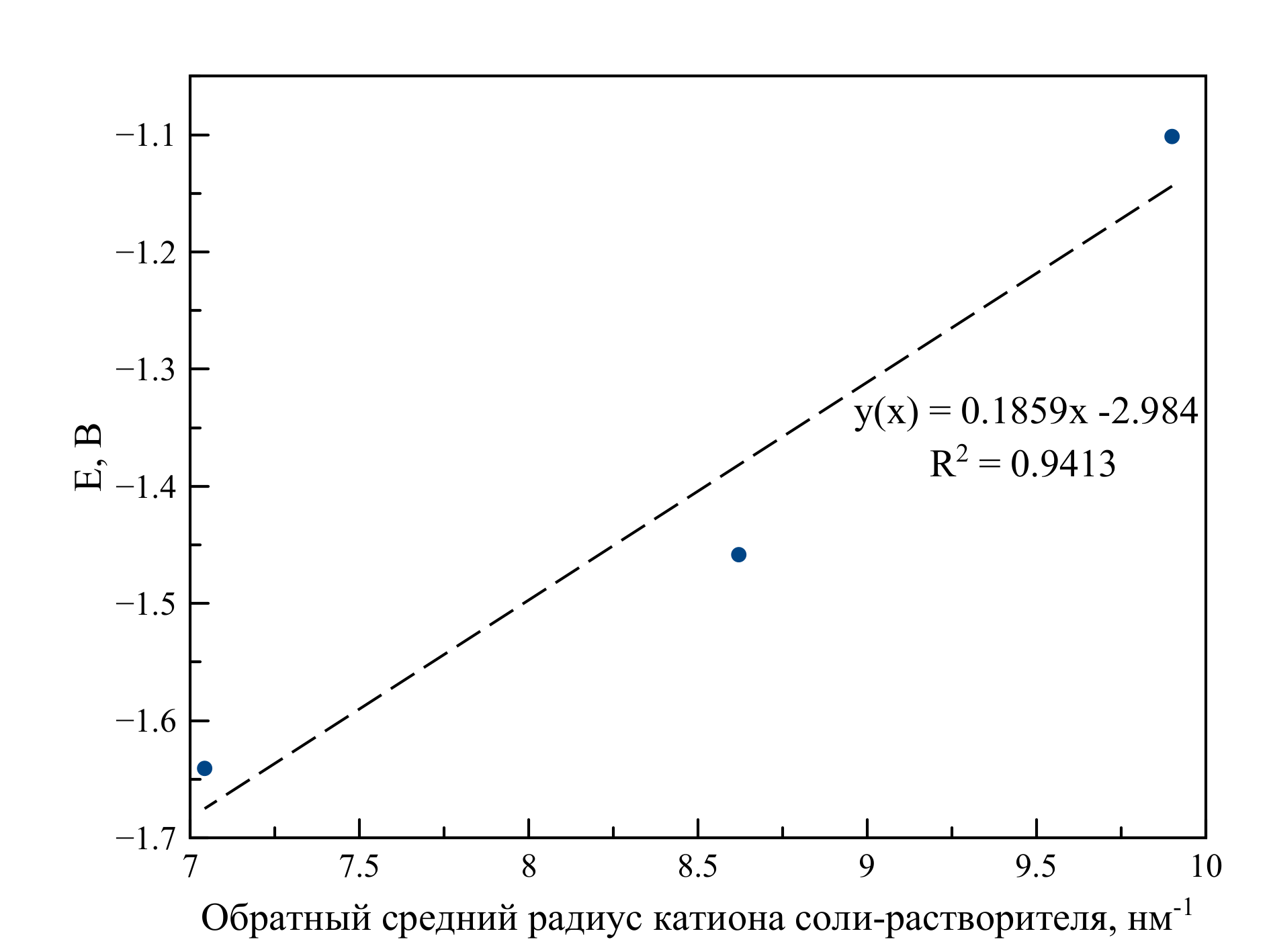
Рисунок 10 - Зависимость значения максимума потенциала пика, соответствующего процессу восстановления Zr(IV)/Zr(0), от обратного среднего радиуса катиона соли-растворителя при 750 ℃
Таблица 3 - Радиусы ионов щелочных металлов по Гольдшмиту и значения Ep для процессов восстановления Zr(IV)/Zr(0) в различных хлоридных расплавах при температуре 750 ℃
Ион | Радиус* катиона по Гольдшмиту, нм | Обратный радиус, нм-1 | Ep, В |
Индивидуальные соли | |||
LiCl | 0,078 | 12,82 | – |
NaCl | 0,098 | 10,20 | – |
KCl | 0,133 | 7,52 | – |
CsCl | 0,165 | 6,06 | – |
Эвтектические смеси | |||
LiCl–KCl | 0,101 | 9,89 | –1,1015 |
NaCl–KCl | 0,116 | 8,66 | –1,4584 |
NaCl–CsCl | 0,142 | 7,03 | –1,6408 |
Примечание: средний радиус катиона для эвтектических смесей
4. Заключение
В ходе работы было оценено влияние добавки фторид-ионов на электрохимическое поведение циркония в хлоридных расплавах. Установлено, что введение ионов циркония в систему в виде гексафтороцирконата калия приводит к значительному смещению потенциала восстановления циркония в отрицательную область.
Исследовано влияние температуры, концентрации и среднего радиуса катиона соли-растворителя на значение потенциала восстановления ионов циркония. При повышении температуры потенциалы восстановления циркония смещаются в область положительных значений. В случае повышения концентрации данные потенциалы смещаются в область отрицательных значений. При увеличении среднего радиуса катиона соли-растворителя происходит смещения потенциалов восстановления в область отрицательных значений.
