ТРАСТУЗУМАБ-ИНДУЦИРОВАННАЯ КАРДИОТОКСИЧНОСТЬ – МЕЖДИСЦИПЛИНАРНАЯ ПРОБЛЕМА СОВРЕМЕННОЙ МЕДИЦИНЫ
ТРАСТУЗУМАБ-ИНДУЦИРОВАННАЯ КАРДИОТОКСИЧНОСТЬ – МЕЖДИСЦИПЛИНАРНАЯ ПРОБЛЕМА СОВРЕМЕННОЙ МЕДИЦИНЫ
Научная статья
Трушин А. Ю. *
ORCID: 0000-0003-0841-1464,
Федеральное Государственное Автономное Образовательное Учреждение Высшего Образования Первый Московский Государственный Медицинский Университет имени И.М. Сеченова Министерства Здравоохранения Российской Федерации (Сеченовский Университет), Москва, Россия
* Корреспондирующий автор (iundead1996[at]gmail.com)
АннотацияТрастузумаб – основа адъювантной терапии HER2 позитивного рака молочной железы. На данный момент получены отдалённые (более 5 лет) результаты клинических исследований, подтверждающие данный факт. Хотя трастузумаб лишён классической токсичности при лечении рака, огромное беспокойство вызывает его как симптоматическое, так и бессимптомное влияние на функцию сердца. Для этого препарата характерен второй тип кардиотоксичности (обратимая кардиотоксичность). В метаанализе, посвящённом развитию кардиотоксичности у пациенток с раком молочной железы, принимающих трастузумаб, было выяснено, что 3% всех пациентов испытывали тяжёлую кардиотоксичность. В современной клинической практике у пациентов часто встречаются сердечно-сосудистые заболевания, поэтому невозможно обойтись без правильной оценки рисков предстоящего лечения. На мой взгляд, оптимальным решением проблемы мониторинга функции сердца является междисциплинарное взаимодействие кардиологов и онкологов.
Ключевые слова: трастузумаб, кардиотоксичность, рак молочной железы.
TRASTUZUMAB-INDUCED CARDIOTOXICITY – INTERDISCIPLINARY PROBLEM OF MODERN MEDICINE
Research article
Trushin A.Y.*
ORCID: 0000-0003-0841-1464,
Federal State Autonomous Educational Institution for Higher Education, I.M. Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
* Corresponding author (iundead1996[at]gmail.com)
AbstractTrastuzumab is the basis of adjuvant therapy for HER2 positive breast cancer. This fact is confirmed by currently received remote (more than five years) results of clinical studies. Although trastuzumab is devoid of classical toxicity in the treatment of cancer, its symptomatic and asymptomatic effects on heart function are of great concern. This drug is characterized by the second type of cardiotoxicity (reversible cardiotoxicity). The meta-analysis devoted to the development of cardiotoxicity in patients with breast cancer, taking trastuzumab, showed that 3% of all patients experienced severe cardiotoxicity. In modern clinical practice, patients often have cardiovascular diseases, so it is impossible to go without a proper assessment of the risks of the upcoming treatment. According to the author’s opinion, the best solution to this problem is interdisciplinary interaction between cardiologists and oncologists.
Keywords: trastuzumab, cardiotoxicity, breast cancer.
ВведениеРак молочной железы (РМЖ) – самая распространённая злокачественная опухоль у женщин, и также занимающая второе место в структуре смертности [1]. Хотя рак молочной железы упоминается как одно заболевание, он содержит множество гистологических подтипов и, по крайней мере, четыре молекулярных подтипа, которые различаются по своему лечению и прогнозу [2]. Молекулярные подтипы (см. рисунок 1) были идентифицированы с использованием общепринятых биологических маркеров: РЭ (рецепторы эстрогена), РП (рецепторы прогестерона), HER2 (human epidermal growth factor receptor 2); к ним относятся: люминальный А, люминальный Б, HER2 позитивный, трижды негативный (сейчас рассматривается как группа заболеваний, имеющая свои подтипы) [2], [3], [4].
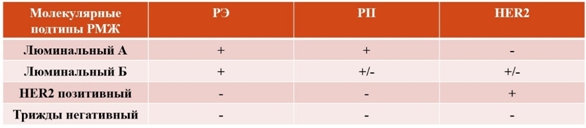
Рис. 1 – Молекулярные подтипы рака молочной железы
В раке молочной железы амплификация HER2 встречается в 20-30% случаев, этот молекулярный подтип ассоциирован с агрессивным течением заболевания и плохим прогнозом [6], [7]. HER2 – это мембранный белок, один из семейства четырёх мембранных тирозинкиназ, которое также включает EGFR (Epidermal growth factor receptor), HER3, HER4 [7], [8]. При взаимодействии с лигандом, рецептор димеризуется с образованием гомодимеров и гетеродимеров. Это приводит к последующему трансфосфорилированию, которое активирует несколько внутриклеточных сигнальных путей, что в свою очередь влияет на пролиферацию, подвижность, адгезию и выживание опухолевой клетки [9].
Трастузумаб – это гуманизированное моноклональное антитело, которое избирательно связывается с HER2. Трастузумаб получают по технологии рекомбинантной ДНК в клетке млекопитающего (клетки яичника китайского хомяка), содержащей антибиотик гентамицин. Гентамицин не обнаруживается в конечном продукте [11]. Будучи анти-HER2 антителом, трастузумаб имеет два основных механизма действия: он подавляет сигнализацию HER2 и вызывает антитело-опосредованный иммунный ответ. Было показано, что трастузумаб может ингибировать передачу сигнала HER2 либо путем дестабилизации HER2 гетеродимеров или путем интернализации HER2-рецепторов с последующей лизосомной деградацией [7], [12]. Трастузумаб, связываясь с HER2, метаболизируется внутриклеточно до пептидов и аминокислот. Внутриклеточное связывание объясняет дозозависимую (нелинейную) элиминацию. Выведение антител из плазмы — это сложный процесс и зависит от многих факторов, таких как генетика, клинический статус пациента [14]. Трастузумаб характеризуется низким системным клиренсом, низким объемом распределения и очень длительным периодом полураспада (28 дней), сравнимым с таковым у эндогенных иммуноглобулинов G [15]. Знания о влиянии трастузумаба на развитие плода человека ограничены. Есть данные о развитии олигогидрамниоза во время второго и третьего триместров беременности и обратимой фатальной почечной недостаточности. Если потенциальная польза для матери перевешивает потенциальный риск для плода, то можно проводить лечение трастузумабом, но показатели плода должны строго контролироваться врачом. Во время лактации следует избегать приём трастузумаба и в течение 6 месяцев после последнего введения [14].
Трастузумаб – основа адъювантной терапии HER2 позитивного РМЖ. На данный момент получены отдалённые (более 5 лет) результаты клинических исследований, подтверждающие данный факт [16], [17], [18]. Хотя трастузумаб лишён классической токсичности при лечении рака, огромное беспокойство вызывает его как симптоматическое, так и бессимптомное влияние на функцию сердца [13].
Кардиотоксичность
Кардиотоксичность – это группа нежелательных явлений, часто представленных снижением фракции выброса левого желудочка (ФВЛЖ) и сердечной недостаточностью, возникающая на фоне лекарственного лечения онкологических заболеваний. По виду повреждающего действия на сердце (кардиотоксичность) цитостатические и таргетные препараты разделяются на два типа. Первый тип – необратимая дисфункция миокарда, второй тип – обратимая дисфункция миокарда, за счёт митохондриальных повреждений. Для трастузумаба характерен второй тип кардиотоксичности [19]. Механизм, с помощью которого трастузумаб вызывает кардиотоксичность ещё изучается. На данный момент известно, что появление нежелательных сердечно-сосудистых явлений связано с блокировкой нормального физиологического действия через HER2 на кардиомиоциты [20], [21]. В отсутствии функции HER2 кардиомиоциты не способны активировать сигнальные пути для собственного выживания, а также накапливаются активные формы кислорода (АФК), что в итоге приводит к сердечной дисфункции [20], [22]. В метаанализе, посвящённом развитию кардиотоксичности у пациенток с РМЖ, принимающих трастузумаб, было выяснено, что 3% [95% ДИ, 2,41-3,64; P>0.05] всех пациентов испытывали тяжёлую кардиотоксичность. Уровень заболеваемости составил 2,62% [95% ДИ, 1,97-3,35; P>0.05] у пациентов с ранним раком молочной железы и 3,14% [95% ДИ, 2,12-4,37; P>0.05] у пациентов с метастатическим раком молочной железы. Исследователи отметили, что клинические испытания обычно исключают пациентов с историей сердечно-сосудистых заболеваний, поэтому частота сердечной недостаточности может быть ещё выше в реальной жизни [23]. В современной клинической практике у пациентов часто встречаются сердечно-сосудистые заболевания, поэтому невозможно обойтись без правильной оценки рисков предстоящего лечения. Метаанализ 17 включенных исследований показал, что диагнозы: гипертоническая болезнь [95% ДИ: 1,14-2,26, P <0,01], диабет [95% ДИ: 1,10-2,38, P <0,02] и предыдущее использование антрациклинов [95% ДИ: 1,17-3,92, P <0,02] были связаны с риском развития трастузумаб-индуцированной кардиотоксичности. Было также установлено, что увеличение возраста (старше 65 лет) P = 0,013, значительно связано с трастузумаб-индуцированной кардиотоксичностью [24].
Возможности кардиологии
Пациенты, получающие анти-HER2-терапию, часто, хотя и не всегда, принимают антрациклины перед началом таргетной терапии. В таких случаях наблюдение за функцией сердца должно начинаться до назначения антрациклинов. Режим наблюдения во время лечения зависит от местных протоколов и рекомендаций, но, как правило, мониторинг сердечно-сосудистой деятельности выполняется каждые 3 месяца во время лекарственного лечения по поводу РМЖ и один раз после завершения лечения трастузумабом [25]. В нескольких исследованиях было продемонстрировано улучшение раннего выявления снижение ФВЛЖ при помощи измерения уровня тропонинов и выполнения эхокардиографии каждые 3 месяца (вовремя адъювантной терапии трастузумабом). Учитывая изменчивость сроков возникновения дисфункции левого желудочка, вызванной трастузумабом, рекомендуется рассмотреть измерение тропонина с каждым циклом таргетной терапии у пациентов с исходным высоким риском кардиотоксичности [25], [26], [27]. Использование NT-proBNP (N-terminal pro brain natriuretic peptide/N-терминальный участок мозгового натрийуретического пептида) для выявления сердечной недостаточности широко распространено, и даже очень низкие уровни могут идентифицировать пациентов с высоким риском [28]. NT-proBNP может оказаться полезным для раннего выявления дисфункции левого желудочка после применения антрациклинов и трастузумаба, но его роль в регулярном наблюдении не установлена [28], [29]. Mary Putt и др. предложили возможность использования миелопероксидазы для прогнозирования риска кардиотоксичности. В этом исследовании увеличение миелопероксидазы было связано с кардиотоксичностью в течение всего курса лечения доксорубицином и трастузумабом [28], [30]. Исследования по поиску оптимального прогностического биомаркера продолжаются.
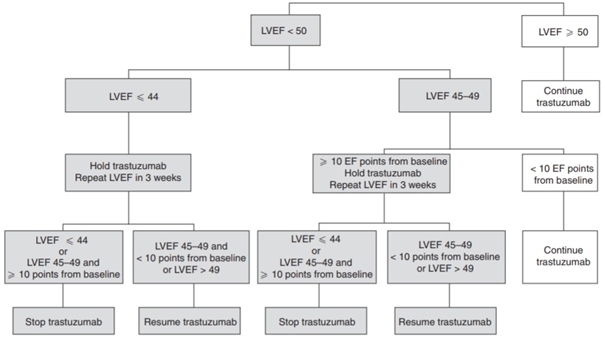
Совместное применение антрациклинов и трастузумаба заметно увеличивает вероятность дисфункции левого желудочка и сердечной недостаточности, но кардиотоксичность может быть значительно снижена путем введения интервала между приёмом антрациклинов и трастузумаба. Наблюдается связь между лечением ингибиторами АПФ (ангиотензинпревращающего фермента) плюс бета-блокаторами и восстановлением функции левого желудочка в течение 12 месяцев. Так же известно, что у пациентов с HER2 положительным раком молочной железы и нормальной ФВЛЖ до приема трастузумаба и антрациклинов, непрерывное использование бета-блокаторов снижает частоту развития сердечной недостаточности [25], [31]. Является ли это открытие значимым также для пациентов, которые лечились преимущественно с неантрациклинами до того, как был назначен трастузумаб? Европейское общество кардиологии (ESC) заявляет, что данные противоречивые, и рекомендации не могут быть сделаны [25]. Для упрощения ведения пациентов был разработан следующий алгоритм (см. рисунок 2) [32].
Рис. 2 – Рекомендации по мониторингу функции сердца у пациентов, получающих трастузумаб
Лечением кардиотоксичности должен заниматься врач кардиолог или специалист в кардио-онкологии. Основными препаратами выборы являются ингибиторы АПФ и/или бета-блокаторы. Также, при снижении ФВЛЖ меньше 49% + снижение более чем на 10 процентных пунктов от исходного значения ФВЛЖ, трастузумаб должен быть отменён до восстановления функции сердца [25].
Возможности онкологии
Продолжительность адъювантной терапии трастузумабом у пациентов с HER2 позитивным РМЖ составляет 12 месяцев. Это является стандартом на протяжении многих лет, однако, оптимальная продолжительность терапии неизвестна [33]. Основной путь решения проблемы кардиотоксичности в онкологии — это уменьшение продолжительности адъювантной терапии трастузумабом, без потери онкологических результатов лечения, и снижение частоты трастузумаб-индуцированной кардиотоксичности. Первым шагом в этом направлении стало рандомизированное клиническое исследование PHARE, в котором сравнивалась продолжительность адъювантной терапии трастузумабом (6 месяцев против 12 месяцев). Основная гипотеза говорит о том, что продолжительность терапии на протяжении 6 месяцев не хуже (non-inferiority) 12 месячного введения трастузумаба [34]. Но после длительного наблюдения за пациентами (42.5 месяца), исследование не смогло доказать, что 6 месячный курс не уступает по эффективности 12 месячному курсу трастузумаба [35]. Так же были проведены аналогичные исследования, которые не смогли доказать вышеуказанную гипотезу.
Летом 2018 года были представлены обновлённые данные рандомизированного клинического исследования 3 фазы PERSEPHONE (non-inferiority). 4089 пациентов с HER2 позитивным РМЖ рандомизированы (1:1) на две группы: 6 месяцев трастузумаба не хуже 12 месячной терапии. Исследователи определяли non-inferiority как «не хуже 3%». Первичная конечная точка – безрецидивная выживаемость от момента диагностики заболевания (первый рецидив или смерть от любой причины). Дизайн исследования показан ниже (см. рисунок 3) [36].
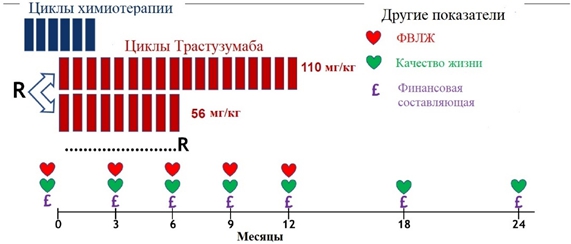
Рис.3 – Дизайн исследования PERSEPHONE
Безрецидивная выживаемость на отметке 4 года в обеих группах была примерна равна 89% ОР 1.07 (90% ДИ 0.93 – 1.24), P=0.01 (см. рисунок 4) [36].
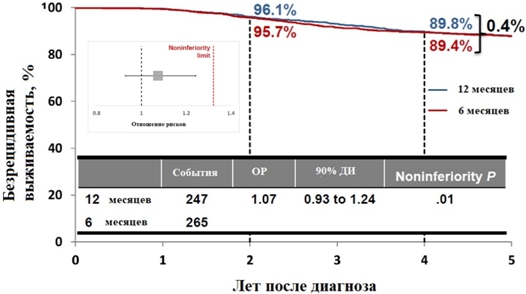
Рис. 4 – Результаты исследования PERSEPHONE - безрецидивная выживаемость на отметке 4 года
Нежелательные явления в виде кардиотоксичности, которые привели к прекращению приёма трастузумаба отмечались реже в группе 6 месячной терапии (4% против 8%, P <0,0001). Учитывая достижения адекватных онкологических и кардиологических результатов, можно в ближайшее время надеяться на снижение стандартной адъювантной терапии трастузумабом до 6 месяцев [36].
Выводы
Трастузумаб-индуцированная кардиотоксичность является важной проблемой современной медицины, пока не имеющей чёткого плана её решения. На мой взгляд, профилактические мероприятия по выявлению сердечной недостаточности, а также междисциплинарное взаимодействие кардиологов и онкологов поможет выработать новую стратегию преодоления этой проблемы и добиться лучших результатов лечения у пациентов с HER2 позитивным РМЖ.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Siegel R. L. Cancer statistics, 2017. / Siegel R. L., Miller K. D., Jemal A. // CA: A Cancer Journal for Clinicians. – 2017. – Vol. 67(1). – P. 7–30. doi:10.3322/caac.21387
- Breast cancer facts & figures 2017-2018 [Electronic resource] - URL: https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/breast-cancer-facts-and-figures/breast-cancer-facts-and-figures-2017-2018.pdf (accessed: 27.02.19)
- Cheang M. C. U. Defining breast cancer intrinsic subtypes by quantitative receptor expression / Cheang M. C. U., Martin M., Nielsen T. O. et al. // The Oncologist. - 2015. – Vol. 20(5). - P. 474–482. doi:10.1634/theoncologist.2014-0372
- Brian D. Lehmann Pietenpol Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies / Brian D. Lehmann, Joshua A. Bauer, Xi Chen et al. // J Clin Invest. - 2011. – Vol. 121(7). - P. 2750-2767. doi:10.1172/JCI45014
- Cho N. The molecular subtypes and imaging phenotypes of breast cancer / Cho N. // Ultrasonography. - 2016. – Vol. 35(4). - P. 281-288. doi:10.14366/usg.16030
- Slamon D. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene / Slamon D., Clark G., Wong S. et al. // Science. - 1987. – Vol. 235(4785). - P. 177–182. doi:10.1126/science.3798106
- Larionov A.A. Current therapies for human epidermal growth factor receptor 2-positive metastatic breast cancer patients / Larionov A.A. // Front. Oncol. - 2018. – Vol. 8:89. doi:10.3389/fonc.2018.00089
- Gutierrez C. HER 2: Biology, detection, and clinical implications / Gutierrez C, Schiff R. // Archives of pathology & laboratory medicine. - 2011. – Vol. 135(1). - P. 55-62. doi:10.1043/2010-0454-RAR.1
- Krishnamurti, U. HER2 in breast cancer: a review and update / Krishnamurti, U., Silverman, J. F // Advances in Anatomic Pathology. - 2014. – Vol. 21(2). - P. 100–107. doi:10.1097/pap.0000000000000015
- Loibl, S. HER2-positive breast cancer / Loibl, S., Gianni, L. // The Lancet. - 2017. – Vol. 389(10087). - P. 2415–2429. doi:10.1016/s0140-6736(16)32417-5
- HERCEPTIN® (trastuzumab) [Electronic resource] - URL: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/103792s5337lbl.pdf (accessed: 27.02.19)
- Klapper L.N. Tumor-inhibitory antibodies to HER-2/ErbB-2 may act by recruiting c-Cbl and enhancing ubiquitination of HER-2 / Klapper L.N., Waterman H., Sela M., Yarden Y. // Cancer Res. - 2000. – Vol. 60(13). - P. 3384–3388. PMID: 10910043
- Fiuza Trastuzumab and cardiotoxicity / M. Fiuza and A. Magalhaes // Cardiotoxicity of oncologic treatments, ISBN: 978-953-51-0273-1, InTech [Electronic resource] - URL: http://www.intechopen.com/books/cardiotoxicity-of-oncologic-treatments/trastuzumab-and-cardiotoxicity (accessed: 27.02.19)
- Boekhout, A. H. Trastuzumab / Boekhout, A. H., Beijnen, J. H., Schellens, J. H. M. // The Oncologist. - 2011. – Vol. 16(6). - P. 800–810. doi:10.1634/theoncologist.2010-0035
- Leveque, D. Clinical pharmacology of trastuzumab / Leveque, D., Gigou, L., Bergerat, J. // Current Clinical Pharmacology. - 2008. – Vol. 3(1). - P. 51–55. doi:10.2174/157488408783329931
- Slamon DJ, Eiermann W, …and On Behalf of the BCIRG-006 Investigators. Ten year follow-up of BCIRG-006 comparing doxorubicin plus cyclophosphamide followed by docetaxel (AC→T) with doxorubicin plus cyclophosphamide followed by docetaxel and trastuzumab (AC→TH) with docetaxel, carboplatin and trastuzumab (TCH) in HER2+ early breast cancer. [abstract]. In: Proceedings of the Thirty-Eighth Annual CTRC-AACR San Antonio Breast Cancer Symposium: 2015 Dec 8-12; San Antonio, TX. Philadelphia (PA): AACR; Cancer Res 2016;76(4 Suppl): Abstract nr S5-04.
- Kristeleit H. Long-term follow-up data from pivotal studies of adjuvant trastuzumab in early breast cancer / Kristeleit H., Parton M., Beresford M. et al. // Targeted Oncology. - 2016. – Vol. 11(5). - P. 579–591. doi:10.1007/s11523-016-0438-5
- Cameron D. 11 years’ follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial / Cameron D., Piccart-Gebhart M. J., Gelber R. D. // The Lancet. - 2017. – Vol. 389(10075). - P. 1195–1205. doi:10.1016/s0140-6736(16)32616-2
- Suter T. M. Cancer drugs and the heart: importance and management / Suter T. M., Ewer M. S. // European Heart Journal. - 2012. – Vol. 34(15). - P. 1102–1111. doi:10.1093/eurheartj/ehs181
- Onitilo A. A. Cardiovascular toxicity associated with adjuvant trastuzumab therapy: prevalence, patient characteristics, and risk factors / Onitilo A. A., Engel J. M., Stankowski R. V. // Therapeutic Advances in Drug Safety. - 2014. – Vol. 5(4). - P. 154–166. doi:10.1177/2042098614529603
- De Keulenaer G. W. The vulnerability of the heart as a pluricellular paracrine organ: lessons from unexpected triggers of heart failure in targeted ErbB2 anticancer therapy / De Keulenaer G. W., Doggen K., Lemmens K. // Circulation Research. - 2010. – Vol. 106(1). – P. 35–46. doi:10.1161/circresaha.109.205906
- Zeglinski M. Trastuzumab-induced cardiac dysfunction: a “dual-hit” / Zeglinski M., Ludke A., Jassal D.S., Singal P.K. // Experimental & Clinical Cardiology. - 2011. – Vol. 16(3). - P. 70-74. PMID: 22065936
- Mantarro S. Risk of severe cardiotoxicity following treatment with trastuzumab: a meta-analysis of randomized and cohort studies of 29,000 women with breast cancer / Mantarro S., Rossi M., Bonifazi M. et al. // Internal and Emergency Medicine. - 2015. – Vol. 11(1). - P. 123–140. doi:10.1007/s11739-015-1362-x
- Jawa Z. Risk factors of trastuzumab-induced cardiotoxicity in breast cancer / Jawa Z., Perez R. M., Garlie L. // Medicine (Baltimore). - 2016. – Vol. 95(44), - e5195. doi:10.1097/md.0000000000005195
- Zamorano J. L.2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines / Zamorano J. L., Lancellotti P., Rodriguez Munoz D. et al. // European Heart Journal. - 2016. – Vol. 37(36). - P. 2768–2801. doi:10.1093/eurheartj/ehw211
- Cardinale D. Trastuzumab-induced cardiotoxicity: clinical and prognostic implications of troponin I evaluation / Cardinale D., Colombo A., Torrisi R. et al. // Journal of Clinical Oncology. - 2010. – Vol. 28(25). - P. 3910–3916. doi:10.1200/jco.2009.27.3615
- Ky B. Early increases in multiple biomarkers predict subsequent cardiotoxicity in patients with breast cancer treated with doxorubicin, taxanes, and trastuzumab / Ky B., Putt M., Sawaya H. // Journal of the American College of Cardiology. - 2014. – Vol. 63(8). - P. 809–816. doi:10.1016/j.jacc.2013.10.061
- A. Nicolazzi Anthracycline and trastuzumab-induced cardiotoxicity in breast cancer / M.A. Nicolazzi, A. Carnicelli, M. Fuorlo et al. // Eur Rev Med Pharmacol Sci. - 2018. – Vol. 22 (7). - P. 2175-2185. doi:10.26355/eurrev_201804_14752
- Ledwidge M. Natriuretic peptide–based screening and collaborative care for heart failure / Ledwidge M., Gallagher J., Conlon C. et al. // JAMA. - 2013. – Vol. 310(1). - P. 66-74. doi:10.1001/jama.2013.7588
- Putt M. Longitudinal changes in multiple biomarkers are associated with cardiotoxicity in breast cancer patients treated with doxorubicin, taxanes, and trastuzumab / Putt M., Hahn V. S., Januzzi J. L. et al. // Clinical Chemistry. - 2015. – Vol. 61(9). - P. 1164–1172. doi:10.1373/clinchem.2015.241232
- Cardinale D. Anthracycline-induced cardiomyopathy / Cardinale D., Colombo A., Lamantia G. et al. // Journal of the American College of Cardiology. - 2010. – Vol. 55(3). - P. 213–220. doi: 10.1016/j.jacc.2009.03.095
- Jones A. L. Management of cardiac health in trastuzumab-treated patients with breast cancer: updated United Kingdom National Cancer Research Institute recommendations for monitoring / Jones A. L., Barlow M., Barrett-Lee P. J. et al. // British Journal of Cancer. - 2009. – Vol. 100(5). - P. 684–692. doi:10.1038/sj.bjc.6604909
- Hiller L. Adjuvant trastuzumab duration trials in HER2 positive breast cancer – what results would be practice-changing? Persephone investigator questionnaire prior to primary endpoint results / Hiller L., Dunn J. A., Loi S. et al. // BMC Cancer. - 2018. – Vol. 18(1). - P. 391. doi:10.1186/s12885-018-4307-8
- Pivot X. 6 months versus 12 months of adjuvant trastuzumab for patients with HER2-positive early breast cancer (PHARE): a randomised phase 3 trial / Pivot X., Romieu G., Debled M. et al. // The Lancet Oncology. - 2013. – Vol. 14(8). - P. 741–748. doi:10.1016/s1470-2045(13)70225-0
- Kramar A. Trastuzumab duration effects within patient prognostic subgroups in the PHARE trial / Kramar A., Bachelot T., Madrange N. et al. // Annals of Oncology. - 2014. – Vol. 25(8). - P. 1563–1570. doi:10.1093/annonc/mdu177
- Earl H. M. PERSEPHONE: 6 versus 12 months (m) of adjuvant trastuzumab in patients (pts) with HER2 positive (+) early breast cancer (EBC): Randomised phase 3 non-inferiority trial with definitive 4-year (yr) disease-free survival (DFS) results / Earl H. M. et al. // Journal of Clinical Oncology. - 2018. - №36(15 Suppl.). - Abstr. 506. doi:10.1200/JCO.2018.36.15_suppl.506