ПРИМЕНЕНИЕ КРИОКОНСЕРВИРОВАННЫХ КЛЕТОК ФЕТАЛЬНОЙ ПЕЧЕНИ ДЛЯ КОРРЕКЦИИ ИММУНОЙ СИСТЕМЫ У КРЫС С АТОПИЧЕСКИМ ДЕРМАТИТОМ
Леонова Л.А.1, Останков М.В.2, Останкова Л.В.3, Гольцев А.Н 4
1 Аспирант, 2 старший научный сотрудник, к.б.н., 3 ведущий научный сотрудник, к.б.н., 4 академик НАН Украины, д.м.н. Институт проблем криобиологии и криомедицины НАН Украины
ПРИМЕНЕНИЕ КРИОКОНСЕРВИРОВАННЫХ КЛЕТОК ФЕТАЛЬНОЙ ПЕЧЕНИ ДЛЯ КОРРЕКЦИИ ИММУНОЙ СИСТЕМЫ У КРЫС С АТОПИЧЕСКИМ ДЕРМАТИТОМ
Аннотация
Одной из актуальных проблем современной дерматологии является атопический дерматит (АД), что обусловлено мультифакторностью патогенеза, значительной распостраненностью болезни, учащением осложненного течения, отсутствием радикальных методов терапии. В статье дана оценка эффективности применения криоконсервированных клеток фетальной печени (кКФП) для коррекции иммунной системы (ИС) в экспериментальной модели у крыс с АД.
Показано, что такая терапия в отличие от стандартного метода лечения с применением преднизолона, значительно улучшает лечебный эффект, что демонстрируется восстановлением показателей Т-клеточного звена иммунитета у животных с индукцией АД.
Ключевые слова: атопический дерматит, криоконсервированные клетки фетальной печени, иммунная система
Leonova l.a. 1, ostankov M.V. 2, Ostankova L.V. 3, Goltsev A.N. 4
1 Postgraduate student, 2 Senior scientist, PhD, 3 Senior scientist, PhD, 4 Academician of Institute for Problems of Cryobiology and Cryomedicine, Ph.D.
APPLICATION OF FETAL LIVER CRYOPRESERVED CELLS TO CORRECT IMMUNE SYSTEM INDICES IN RATS WITH ATOPIC DERMATITIS
Abstract
One of the urgent problems of modern dermatology is atopic dermatitis (AD), that is stipulated by multifactor pathogenesis, significant propagation of the disease. Designing the drugs which are able of modulating an immune response, based on regulation of the indices in cell, humoral links and monocyte-phagocyte system can reveal the new ways in pathogenetically substantiated treatment of AD.
The paper assesses the efficiency of cryopreserved fetal liver cells (cFLCs) to correct the immune system (IS) indices in an experimental model of AD.
AD was initiated in Wistar rats aged 6 months and weighing of 180–200 g. The animals daily for 21 days into dorsal skin (3×4 cm2) were rubbed with 0.5 ml. of 5% ethanol-acetone solution of dinitrochlorobenzene. Immune correcting effect of cHCB was assessed by the degree of reduction of cell immunity link (CIL) as well as monocyte-phagocyte system (MPS). In CIL by flow cytometry (FACSCalibur (BD, USA) there was determined the number of CD3+, CD4+, CD8+, CD16+, CD19+, CD25+ cells, using FITC-labelled anti-rat mAb (BD, USA).
It was shown that cFLCs like nFLCs caused a correcting effect on CIL of immunity in the animals with induced AD.
Key words: atopic dermatitis, fetal liver cryopreserved cells, immune system
Введение. В последнее время отмечается неуклонный рост частоты и распространенности аллергических заболеваний кожи: атопического дерматита (АД), контактного дерматита, экземы от которых в ряде стран страдает до 25% населения [1]. Повсеместно наблюдается нарастание тяжести течения и торпидности аллергодерматозов к проводимой терапии [4].
АД – это генетически обусловленное заболевание, имеющее хроническое, рецидивирующее течение. Развивающееся иммунозависимое воспаление усугубляется генетически детерминированным дефектом кожного барьера, обусловленным нарушением функции гена филаггрина [11]. Вместе с тем признается мультифакторность патогенетически значимых для развития АД факторов таких, как толл-подобные рецепторы [7], включая иммунологические нарушения в клеточном и гуморальном звеньях иммунитета [5]. На этом фоне наблюдается гиперпродукция иммуноглобулинов класса E (IgE) [4], которые не только способны непосредственно связывать антиген, вызывающий развитие атопического процесса, но и активно участвуют в его презентации дендритными клетками T-лимфоцитам – Th2 [12]. Присоединение вторичной инфекции, имеющей хронический и рецидивирующий характер [8], на фоне разбалансировки состояния местного и системного иммунитета при АД является показанием для лечения данного заболевания иммуномодуляторами [6, 9]. Создание препаратов, способных модулировать иммунный ответ, основанный на регуляции показателей в клеточном, гуморальном звеньях и моноцитарно-фагоцитарной системе может выявить новые пути в патогенетически обоснованном лечении АД [10].
В данной работе в качестве таковых применяли суспензию криоконсервированных клеток фетальной печени (кКФП), как было ранее показано в наших работах [2,3], обладают выраженной иммуномодулирующей активностью. Образцы кКФП хранили в низкотемпературном банке ИПКиК НАНУ в жидком азоте при температуре –196оС.
Цель исследования – оценить эффективность применения криоконсервированных клеток фетальной печени для коррекции иммунной системы у крыс с атопическим дерматитом
Объекты и методы исследования. Эксперименты проведены на крысах линии Вистар в возрасте 6 месяцев, массой 180–200 г., в соответствии с «Европейской Конвенцией о защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1986 г.) и одобренными Национальным конгрессом Украины по биоэтике (Киев, 2003 г.). Лабораторные животные содержались в условиях вивария ИПКиК НАНУ и были использованы в экспериментальной работе.
Инициировали АД по методу [Залкан, Ивлева, 1965] Животному ежедневно, в течение 21-х суток, в кожу спины (3×4 см2) втирали по 0.5 мл 5% спиртово-ацетонового раствора динитрохлорбензола. Криоконсервировали КФП по методу [2]. Всего под наблюдением находилось 63 крыс, которые были распределены в группы: 1 – интактные (контроль) (n=7); 2 – АД без лечения (n=14); 3 – АД+стандартное лечение (преднизолоновая мазь) (n=14); 4 – АД+нКФП (n=14); 5 – АД+кКФП (n=14).
Иммунокоррегирующий эффект кККЧ оценивали по степени восстановления клеточного (КЗИ) звена иммунитета на 7-е сутки после развития АД и лечения (28-е сутки после сенсибилизации). В КЗИ определяли количество CD3+, CD4+, CD8+, CD16+, CD19+, CD25+ клеток селезенки, а также CD16+ в популяции нейтрофилов и моноцитов на проточном цитофлюориметре (FACS Сalibur (BD, США)), используя соответствующие антикрысиные ФИТЦ-меченные МАТ (ВD, США). Процедуру окрашивания и фиксации клеток проводили стандартным способом в соответствии с указаниями фирмы производителя.
Статистическую обработку экспериментальных данных проводили методом Стьюдента-Фишера с применением программы Statistica 7.0, (Stat Soft Inc.), адаптированной к поставленным задачам и с учетом специфики данных.
Результаты и их обсуждение. Полученные данные свидетельствуют о том, что терапевтический эффект от стандартной терапии (преднизолоновая мазь) наблюдали у крыс с индукцией АД на 7-е сутки. В то время как при лечении с применением КФП его наблюдали уже на 3–5-е сутки от начала терапии и независимо от того, какой биообъект применяли нативный (нКФП) или криоконсервированный (кКФП). Так, уровень общего IgE в сыворотке крови на 7-е сутки после стандартного лечения cнижался относительно исходного уровня у 56% животных, а после применения нКФП или кКФП – у 80 и 82%, соответственно.
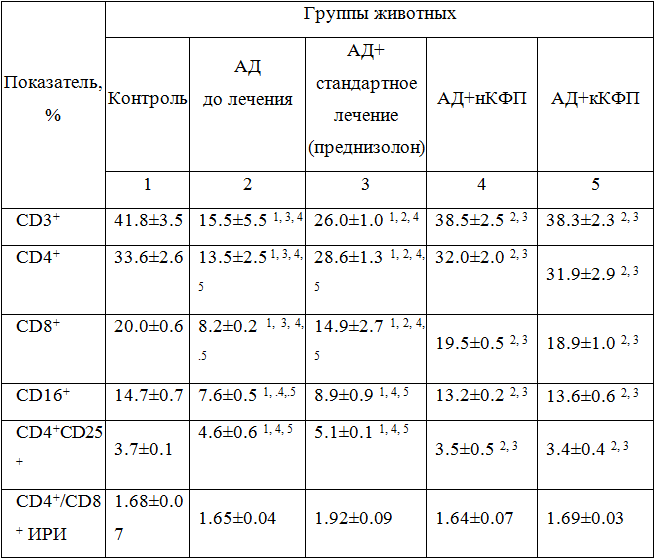
Данные анализа фенотипических характеристик Т-лимфоцитов селезенки приведены в таблице 1.
Таблица 1 - Содержание субпопуляций Т-лимфоцитов в селезенке крыс с индукцией АД до и после лечения
Примечания: Различия достоверны (р<0.05) в сравнении: 1 – с контролем; 2 – с группой 2; 3 – с группой 3; 4 – с группой 4; 5 – с группой 5 в соответствующие сроки.
Результаты оценки состояния Т-клеточного звена иммунитета показали, что для крыс с АД (группа 2) было характерным достоверное снижение содержания общего пула Т-клеток CD3+ (р<0.05), а также субпопуляции Т-хелперов CD4+ (p<0.001) и уровня CD8+ (p<0.001) лимфоцитов, хотя это не отражалось на показателях ИРИ (p>0.001). Заслуживает внимания почти двукратное снижение концентрации клеток с фенотипом CD16+ (p<0.001), которые идентифицируются с пулом ЕК, по сравнению с показателями у животных контрольной группы 1. было несколько повышенным у животных с АД и содержание регуляторных Т-лимфоцитов (CD4+CD25+) (p<0.001).
Проведение стандартной терапии оказывало выраженное повышение, но не нормализацию, содержания Т-лимфоцитов (p<0.001). Отмечалось повышение содержания CD4+ и CD8+ лимфоцитов (p<0.001), но эти показатели оставались ниже контрольных значений (p<0.01 в обоих случаях). Стандартная терапия не влияла существенно и на показатели содержания клеток с цитотоксической активностью (CD16+), а также на показатели содержания Т-рег. клеток (p>0.05).
Неоднократно нами отмечалось, что препараты фетального происхождения, включая и КФП проявляют иммунотропный и иммунокоррегирующий эффект [2]. Наши данные подтверждают этот тезис. Установлено, что применение как терапевтического средства лечения АД КФП у крыс группы 4 и 5 нормализовало содержание CD3+, CD4+, CD8+, CD16+ лимфоцитов и ИРИ (p>0.05 относительно показателей контроля). В сравнительном аспекте важно, что положительный эффект был получен при применении как кКФП, так и кКФП, который следует расценивать как сохранение в криоконсервирующем материале тех активных начал, которые реализуют иммунокоррегирующий эффект в отношении КЗИ.
Экспериментальное обоснование возможности применения КФП как лечебного препарата при широком спектре аутоиммунных заболеваний продемонстрировано во многих работах [2,3]. Состоятельность этого материала выступать в роли иммуномодулятора и иммунокорректора доказана и для кКФП, которые сохраняют все биологические свойства и доступность в очаг иммуновоспаления [3].
АД является хроническим иммунозависимым заболеванием с развитием очага воспаления в кожных покровах [1,6,8]. Многообразие проявления его клинических признаков и широта патогенетических факторов обусловливающих их манифестацию подтверждают мультифакторность развития данной патологии [4]. Не вызывает сомнения участия в индукции и поддержания развития АД инфекционной микрофлоры колонизирующей кожу [8], и агравации этого процесса при некоторых дефектах геномного профиля кожи выражающихся нарушением ее барьерной функции [11]. Очевидным остается и факт развивающихся «особых» взаимоотношений на этом плацдарме микрофлоры с субстратами иммунной системы (ИС), являющимися органически необходимым субстратом кожных покровов [6].
К настоящему времени накоплен огромный опыт применения КФП как в экспериментальных исследованиях, так и в клинике [3]. Обоснован и продемонстрирован иммуномодулирующий потенциал КФП при лечении целого ряда патологических состояний организма [2]. В данной работе мы продемонстрировали способность КФП выступать в роли лечебного препарата для весьма распространенного в настоящее время и трудно поддающегося лечению такого заболевания, как АД, особенно у детей.
Известно, что КФП после воздействия физико-химических факторов криоконсервирования (замораживания-оттаивания), так же как и нативные, сохраняют потенциал экспрессии таких иммунологически значимых генов, как α-цепи ИЛ2, TНФα, ИФНα и ИФНγ активировать пролиферацию и дифференцировку клеток гемопоэтической ткани и т.д. [2]. Вполне вероятно, что сохранение именно этих свойствами кКФП определяло их нормализующий эффект в отношении многих показателей ИС у животных с АД.
Известно, что большинство АИЗ и аллергических заболеваний, являющихся мультифакторной патологией, развиваются на фоне срыва естественной толерантности. Одной из главных причин несостоятельности естественной толерантности является снижение функциональной активности Т-супрессорного звена иммунитета и, прежде всего, Т-регуляторных клеток [3]. Следует заметить, потенциал их активации является одним из главных структурно-функциональных элементов фетальной печени, а именно, МСК.
Одним из механизмов иммуносупрессорной активности МСК, которые входят в состав КФП, является непосредственные межклеточные образования между МСК и Т-лимфоцитами [3].
Обобщенный анализ полученных данных показывает, что иммуномодулирующая терапия в виде применения КФП происходила на фоне не снижения, а даже повышения содержания клеток Т-лимфоцитов супрессорного типа, т.е. Т-рег. (CD4+25+). Коррегирующий эффект от применения КФП в отношении данных показателей очевиден.
Заключение. Полученные в работе результаты свидетельствуют о том, что кКФП, подобно нКФП, оказывают коррегирующее действие на т – клеточное звено иммунитета, восстанавливая их функциональные свойства у животных с индукцией АД.
Литература
- Белоусова Т. А. Белоусова Т.А.. Аллергодерматозы – болезни современной цивилизации / Т. А. Белоусова. // РМЖ. – 2003. – №27. – С. 1538–1542.
- Гольцев А.М. и др. 2000. Способ лечения аутоиммунных заболеваний. Патент №30723А Украина, МПК6 А61К35/50. Бюл. №7-II, 19.
- Грищенко В. И. Трансплантация продуктов эмбриофетоплацентарного комплекса. От понимания механизма действия к повышению эффективности применения. / В. И. Грищенко, А. Н. Гольцев. // Проблемы криобиологии. – 2002. – №1. – С. 54–84.
- Кунгуров Н. В. Об оптимизации терапии больных атопическим дерматитом детей и взрослых / Н. В. Кунгуров, М. М. Кохан, Ю. В. Кениксфест. // Вестник дерматологии и венерологии. – 2004. – №3. – С. 23–29.
- Матушевская Е.В., Богуш П.Г., Свирщевская Е.В. и др..Анализ аллергенспецифических IgE у больных атопическим дерматитом в Москве / [Е. В. Матушевская, П. Г. Богуш, Е. В. Свирщевская та др.]. // Вестник дерматологии и венерологии. – 2003. – №2. – С. 4–8.
- Атопический дерматит: современная диагностика и лечение. / [Ю. В. Сергеев, О. Л. Иванов, Д. К. Новиков та др.]. // Иммунопатология, аллергология и инфектология. – 2001. – №4. – С. 28–48.
- Снарская Е. С. Некоторые клинико-иммунологические аспекты патогенеза атопического дерматита и роль толл-подобных рецепторов / Е. С. Снарская. // 4. – 2012. – С. 109–110.
- Ardern-Jones M. R. Bacterial superantigen facilitates epithelial presentation of alergen to T-helper 2 cells / Ardern-Jones. // Proceedings of the National Academy of Sciences of the United States of America. – 2007. – №104. – Р. 5557–5562.
- Hultsch Т. Immunomodulation and safety of topical calcineurin inhibitors for the treatment of atopic dermatitis / Т. Hultsch, A. Kapp, J. Spergel. // Dermatology. – 2005. – №211. – С. 174–187.
- Leung D. Y. New insights into atopic dermatitis / Leung. // The Journal of Clinical Investigation. – 2004. – №113. – С. 651–657.
- Palmer С. N. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis / С. Palmer. // J. Nature Genetics. – 2008. – №38. – С. 441–446.
- Reefer A. J. Analysis of CD25hiCD4+ «regulatory» T-cell subtypes in et al atopic dermatitis reveals a novel T(H)2-like population / Reefer. // Journal of Alergy and Clinical Immunology. – 2008. – №121. – С. 415–422.
References
- Belousova T. A. Belousova T.A.. Allergodermatozy – bolezni sovremennoj civilizacii / T. A. Belousova. // RMZh. – 2003. – №27. – S. 1538–1542.
- Gol'cev A.M. i dr. 2000. Sposob lechenija autoimmunnyh zabolevanij. Patent №30723A Ukraina, MPK6 A61K35/50. Bjul. №7-II, 19.
- Grishhenko V. I. Transplantacija produktov jembriofetoplacentarnogo kompleksa. Ot ponimanija mehanizma dejstvija k povysheniju jeffektivnosti primenenija. / V. I. Grishhenko, A. N. Gol'cev. // Problemy kriobiologii. – 2002. – №1. – S. 54–84.
- Kungurov N. V. Ob optimizacii terapii bol'nyh atopicheskim dermatitom detej i vzroslyh / N. V. Kungurov, M. M. Kohan, Ju. V. Keniksfest. // Vestnik dermatologii i venerologii. – 2004. – №3. – S. 23–29.
- Matushevskaja E.V., Bogush P.G., Svirshhevskaja E.V. i dr..Analiz allergenspecificheskih IgE u bol'nyh atopicheskim dermatitom v Moskve / [E. V. Matushevskaja, P. G. Bogush, E. V. Svirshhevskaja ta dr.]. // Vestnik dermatologii i venerologii. – 2003. – №2. – S. 4–8.
- Atopicheskij dermatit: sovremennaja diagnostika i lechenie. / [Ju. V. Sergeev, O. L. Ivanov, D. K. Novikov ta dr.]. // Immunopatologija, allergologija i infektologija. – 2001. – №4. – S. 28–48.
- Snarskaja E. S. Nekotorye kliniko-immunologicheskie aspekty patogeneza atopicheskogo dermatita i rol' toll-podobnyh receptorov / E. S. Snarskaja. // 4. – 2012. – S. 109–110.
- Ardern-Jones M. R. Bacterial superantigen facilitates epithelial presentation of alergen to T-helper 2 cells / Ardern-Jones. // Proceedings of the National Academy of Sciences of the United States of America. – 2007. – №104. – R. 5557–5562.
- Hultsch T. Immunomodulation and safety of topical calcineurin inhibitors for the treatment of atopic dermatitis / T. Hultsch, A. Kapp, J. Spergel. // Dermatology. – 2005. – №211. – S. 174–187.
- Leung D. Y. New insights into atopic dermatitis / Leung. // The Journal of Clinical Investigation. – 2004. – №113. – S. 651–657.
- Palmer S. N. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis / S. Palmer. // J. Nature Genetics. – 2008. – №38. – S. 441–446.
- Reefer A. J. Analysis of CD25hiCD4+ «regulatory» T-cell subtypes in et al atopic dermatitis reveals a novel T(H)2-like population / Reefer. // Journal of Alergy and Clinical Immunology. – 2008. – №121. – S. 415–422.