ОЦЕНКА МОРФОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ ЛЕГОЧНОЙ ТКАНИ НА СРЕЗАХ, ПРИГОТОВЛЕННЫХ ПАРАФИНОВЫМ И КРИОСТАТНЫМ МЕТОДАМИ, ПРИ НОРЭПИНЕФРИН-ИНДУЦИРОВАННОМ ОТЕКЕ
ОЦЕНКА МОРФОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ ЛЕГОЧНОЙ ТКАНИ НА СРЕЗАХ, ПРИГОТОВЛЕННЫХ ПАРАФИНОВЫМ И КРИОСТАТНЫМ МЕТОДАМИ, ПРИ НОРЭПИНЕФРИН-ИНДУЦИРОВАННОМ ОТЕКЕ
Аннотация
Цель исследования — изучение морфологических изменений легочной ткани на криостатных и парафиновых срезах в модели норэпинефринового отека легких.
Исследование проведено на 40 взрослых самцах крыс Wistar (220±40 г), которых наркотизировали пентобарбиталом натрия (40 мг/кг). В контрольной группе однократно внутривенно вводили 0,9% раствор натрия хлорида, в опытной группе — 0.05% раствора норэпинефрина (500 мкг/кг). Животных выводили из эксперимента через 50 минут, легкие извлекали для гравиметрии. Из образцов каудальной доли левого легкого готовили парафиновые и криостатные срезы, которые окрашивали гематоксилин-эозином и выполняли морфометрический анализ. Обработку полученных данных проводили с использованием программы Statistica, версия 12.
Результаты гравиметрического исследования показали, что у животных опытной группы развитие норэпинефринового ОЛ сопровождается равнозначными повышениями и оводнения и кровенаполнения легких. Гистологический анализ показал, что у животных опытной группы на криостатных и парафиновых срезах гистоархитектоника легочной ткани представлена генерализованным полнокровием сосудов, очаговыми дисателектазами, диффузным отеком интерстиция и очагами альвеолярного отека. На криостатных и парафиновых срезах в легочных капиллярах выявлен частичный гемолиз эритроцитов, наличие белковой (эозинофильной) жидкости в альвеолах, на криостатных срезах — вспенивание жидкости, на парафиновых срезах выражен диапедез эритроцитов. При обеих методиках приготовления срезов интерстиций легких заполнен мастоцитами и нейтрофилами. Средние значения площади поперечного сечения альвеол, максимальных и минимальных их диаметров, были максимальными на криостатных срезах. Средняя толщина межальвеолярных перегородок была наибольшей на парафиновых срезах, а средний размер альвеолярного входа, был меньше, чем на криостатных срезах. На парафиновых срезах выявлялось наибольшее увеличение толщины межальвеолярных перегородок с наименьшими размерами альвеолярного входа и альвеол с сохраненной воздушностью по сравнению с таковыми данными, полученными на криостатных срезах.
Таким образом, криостатный и парафиновый методы позволяют безошибочно, более того, совершенно точно и достоверно верифицировать развитие альвеолярного отека, индуцированного введением норэпинефрина при более выраженных морфометрических изменениях, определяемых на парафиновых срезах.
1. Введение
Кардиогенный отек легких развивается вследствие повышения гидростатического давления в легочных капиллярах при неповрежденной альвеоло-капиллярной мембране , , , что приводит к фильтрации жидкости в интерстициальное и альвеолярное пространства. Кроме того, высокое гидростатическое капиллярное давление может вызвать разрушение альвеоло-капиллярной мембраны и, как следствие, повышение проницаемости альвеолярного эпителия и эндотелия капилляров , . Отечная жидкость в альвеолярном пространстве изменяет функцию сурфактанта и увеличивает поверхностное натяжение, перемещение белков из капилляров в интерстициальное пространство и альвеолы также увеличивает поверхностное натяжение , . Разрушение барьера приводит к острому воспалительному процессу, который поддерживает повышенную проницаемость и непосредственно дисфункцию сурфактанта . Таким образом, развитие кардиогенного отека легких приводит к накоплению жидкости через механизмы повышения гидростатической фильтрации и повышения проницаемости альвеоло-капиллярной мембраны.
В настоящее время для гистологических исследований широко используется и метод парафиновой заливки материала и метод криостатной техники подготовки среза , , . Cтандартные гистологические методы приготовления и окрашивания срезов широко применяются в научных исследованиях для подтверждения отека легких и более глубокого изучения его патогенетических механизмов, поскольку выявляют основные признаки отека интерстиция, отека альвеол и дают представление о морфологической картине существующей патологии , . Однако считается, что стандартное окрашивание легочной ткани для гистологического исследования отека легких является неэффективным с позиций невозможности дифференцировки и верифицикации его различных форм развития , .
Цель исследования состояла в изучении морфологических изменений легочной ткани на парафиновых и криостатных срезах при развившемся гемодинамическом отеке легких у крыс.
2. Методы и принципы исследования
Исследование проведено на 40 взрослых самцах крыс Wistar (220±40 г). Эксперименты одобрены Этическим комитетом ФГБОУ ВО ЯГМУ МЗ России (протокол №69 от 13.09.2024 г.). Всех животных наркотизировали путем однократного внутрибрюшинного введения пентобарбитала натрия (40 мг/кг). После наступления глубокой анестезии животных фиксировали на секционном столике вентральной стороной вверх и разделили на две группы — в каждой по n=20, которым вводили внутривенно однократно 0,9% раствор натрия хлорида (контрольная группа) и 0.05% раствора норэпинефрина в дозе 500 мкг/кг (опытная группа). Через 50 минут от момента введения веществ всем животным выполняли цервикальную дислокацию, торакотомию с последующим извлечением легких. Животных каждой группы разделили на две группы по 10 крыс методом простой рандомизации.
Для гравиметрического исследования оба сырых легких от 10 животных в каждой группе взвешивали на аналитических весах «ACULAB» ALC-210d4 (США) и рассчитывали легочный коэффициент (ЛК) как отношение массы сырых легких к массе животного (мг/г). После сушки легких до их постоянного веса в термостате при температуре 80–90°C рассчитывали индекс водного баланса (ИВБ, мг/мг) [3], сухой остаток (СО, %), индекс отечной жидкости (ИОЖ, мг/г) и прибавку кровенаполнения (ПК, мг/г) , (см. рис. 1).
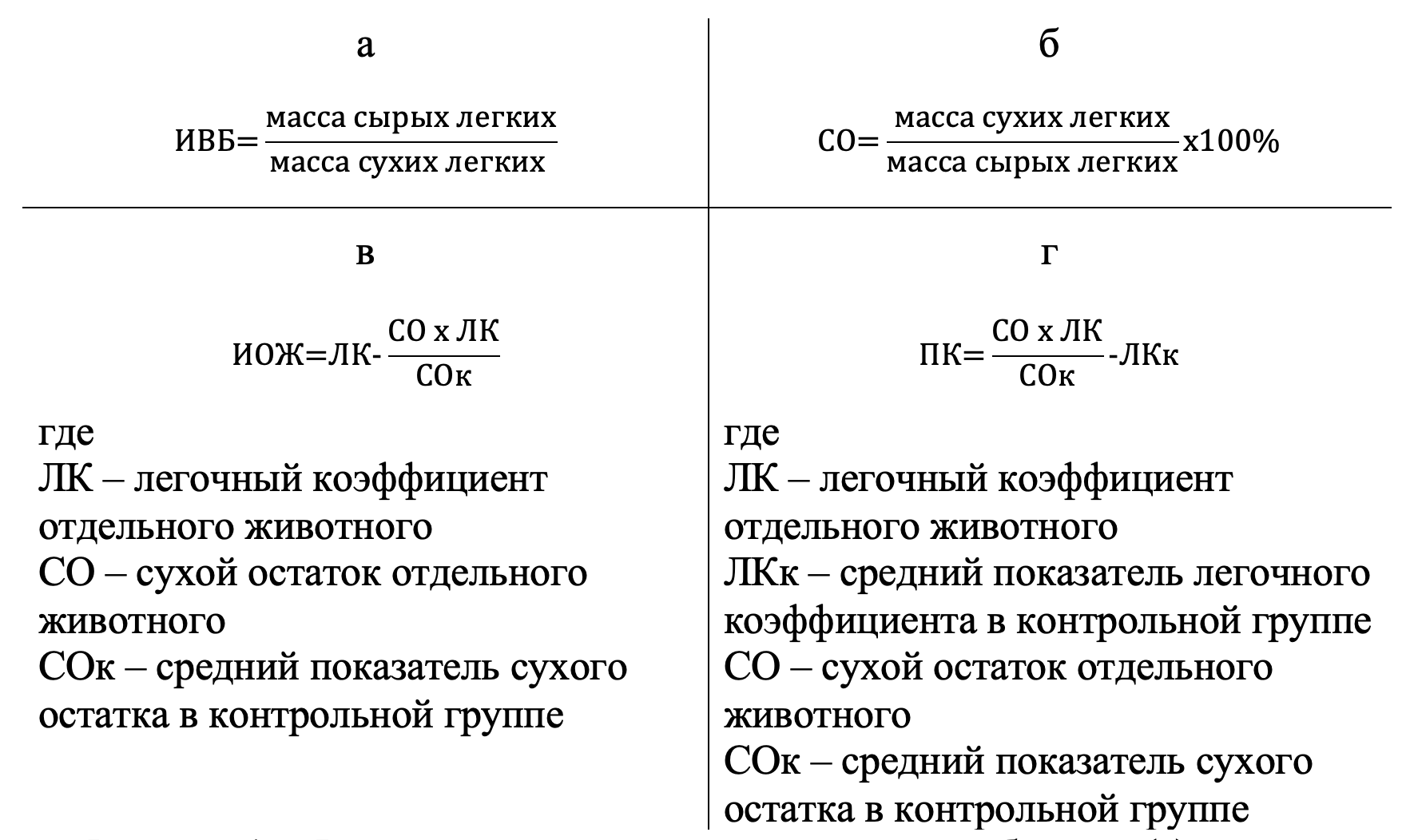
Рисунок 1 - Формулы для расчета индекса водного баланса (а), сухого остатка (б), индекса отечной жидкости (в) и прибавки кровенаполнения (г) у крыс контрольной и опытной групп
Для приготовления парафиновых срезов образцы фиксировали в 10% нейтральном формалине (водный раствор, получаемый при смешивании 1 части 40% водного раствора формальдегида (альдегид муравьиной кислоты) с 9 частями воды) при 37°C в течение 24 часов с последующей промывкой под проточной водой в течение 10 минут. Объем фиксирующей жидкости превосходил объем образцов каудальной доли левого легкого более чем в 20 раз, толщина образца не превышала 0,5 см, иссечение образцов происходило с захватом участка висцеральной плевры. Парафинизацию образцов ткани выполняли ступенчато с предварительной проводкой через ацетон ЧДА (диметилкетон) и ксилол ЧДА (орто-ксилол) и заключением в парафиновую среду (смесь алкановых, изопарафиновых, циклопарафиновых и нафтено-ароматических углеводородов с синтетическими пластификаторами, не содержащая воска, с температурой плавления 52–54°C) с трехкратной заменой при 60°C. Из парафиновых блоков готовили срезы с помощью микротома МЗП-01 Техном (ООО «КБ ТЕХНОМ», Россия), толщиной 5 мкм. Депарафинизацию выполняли путем трехкратного погружения срезов в ксилол с экспозицией в 10 минут и последующей дегидратацией в этаноле возрастающей концентрации. Окраску криостатных и парафиновых срезов проводили гематоксилин-эозином с последующей их дегидратацией в этаноле возрастающей концентрации, просветлением в ксилоле и заключением в монтирующую среду (смесь ксилола, акриловых смол (34,3+/-2,0%)), D-лимонена, пластификатора (дибутиловый эфир фталевой кислоты).
Световую микроскопию гистологических срезов выполняли с помощью микроскопа Olympus BX43 (Япония). Цифровые изображения получали через цифровую CCD-камеру Tucsen TCC 6.1ICE (Китай) в программе ISCapture 3.6 (Китай). В программе Image J (NIH, США) на изображениях срезов проводили морфологическое исследование легочной ткани с морфометрическим анализом. Морфометрический анализ включал измерение размеров альвеолярного входа (РАВ, мкм), площади поперечного сечения альвеол (ППСА, мкм2), максимального и минимального диаметров альвеол (Макс и МинДА, мкм), толщины межальвеолярных перегородок (ТМП, мкм).
Статистический анализ результатов проводили с использованием пакета прикладных программ Statistica, версия 12 (StatSoft, Inc., 2013, США). Все количественные данные представлены в виде M±m. Для выявления статистически значимых межгрупповых различий применяли однофакторный дисперсионный анализ вариаций ANOVA и критерий Тьюки Рost-hoc анализа. Различия принимали статистически значимыми при p<0,05.
3. Основные результаты
Результаты гравиметрического исследования показали, что у животных опытной группы средние значения ЛК и ИВБ увеличивались в 2,3 и 1, 4 раза соответственно, среднее значение СО — снижалось на 27,8% по сравнению с данными контрольной группы (p<0,05) (см. табл. 1).
Таблица 1 - Показатели гидратации и кровенаполнения легких у крыс
Показатели | Контрольная группа | Опытная группа |
Легочный коэффициент (мг/г) | 6,23±0,13 | 14,30±0,44* |
Индекс водного баланса (мг/мг) | 4,73±0,03 | 6,69±0,08* |
Сухой остаток (%) | 21,06±0,14 | 15,21±0,18* |
Индекс отечной жидкости (мг/г) | 0.00±0.08 | 4,01±0,23* |
Прибавка кровенаполнения (мг/г) | 0.00±0.02 | 4,05±0,22* |
Примечание: p<0,05 по сравнению с данными контрольной группы – *
У животных опытной группы выявлялось значимое увеличение ИОЖ и ПК, средние значения которых были равнозначными. У животных контрольной группы ИОЖ и ПК имели нулевые значения. Таким образом, развитие норэпинефринового ОЛ сопровождается равнозначными повышениями и оводнения и кровенаполнения легких.
Гистоморфологический анализ легочной ткани у животных контрольной группы на криостатных (см. рис. 2, а, в, д, ж) и парафиновых (см. рис. 3, а, в, д, ж) показал, что паренхима легких сохраняла воздушность, альвеолы выстланы эпителием, разделены тонкими межальвеолярными перегородками, содержащими капилляры (см. рис. 2, ж; см. рис. 3, ж).
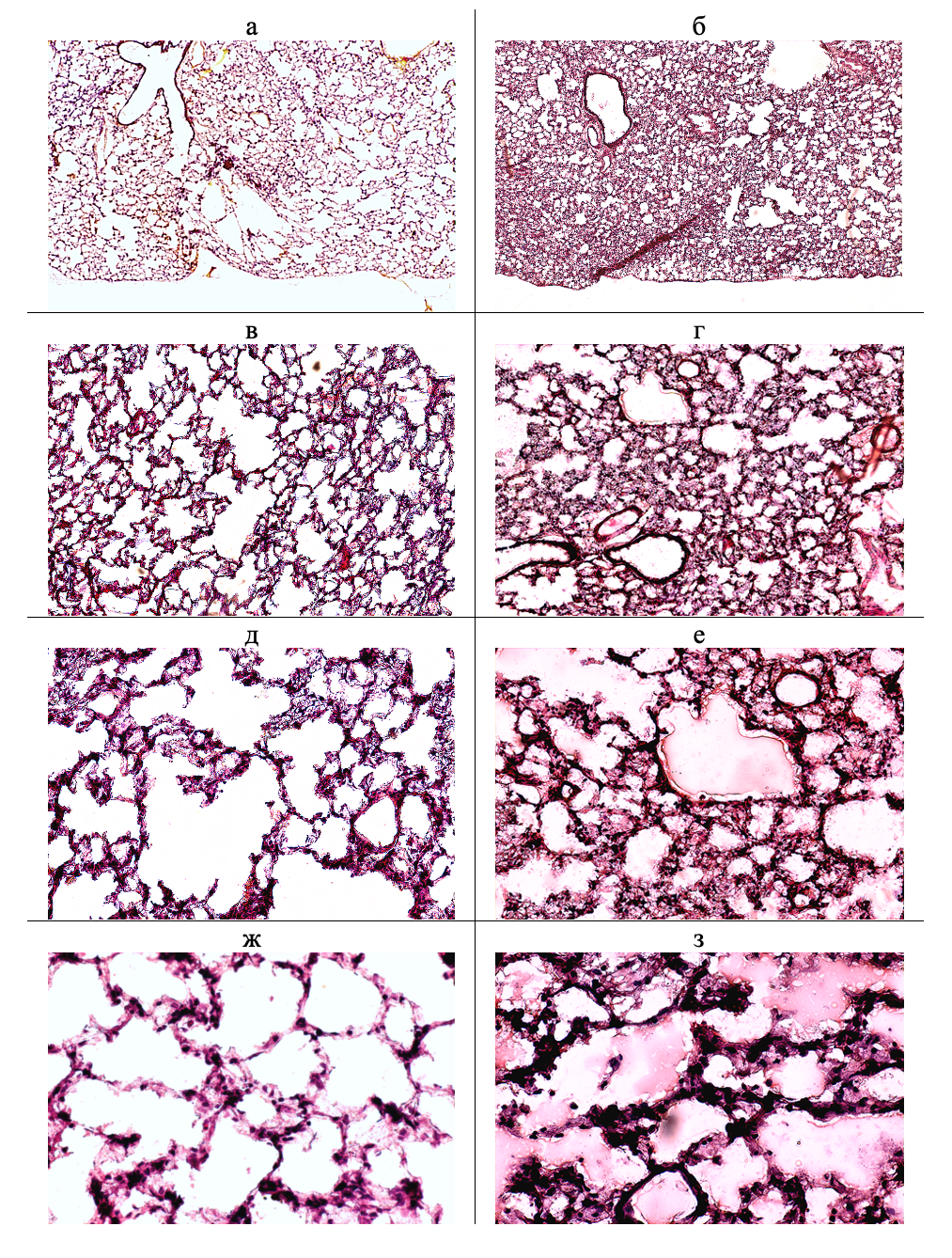
Рисунок 2 - Паренхима легких на криостатных срезах у животных контрольной (а, в, д, ж) и опытной (б, г, е, з) групп
Примечание: окрашивание гематоксилин-эозином; увеличение: а, б – х 40; в, г – х 100; д, е – х 200; ж, з – х 400
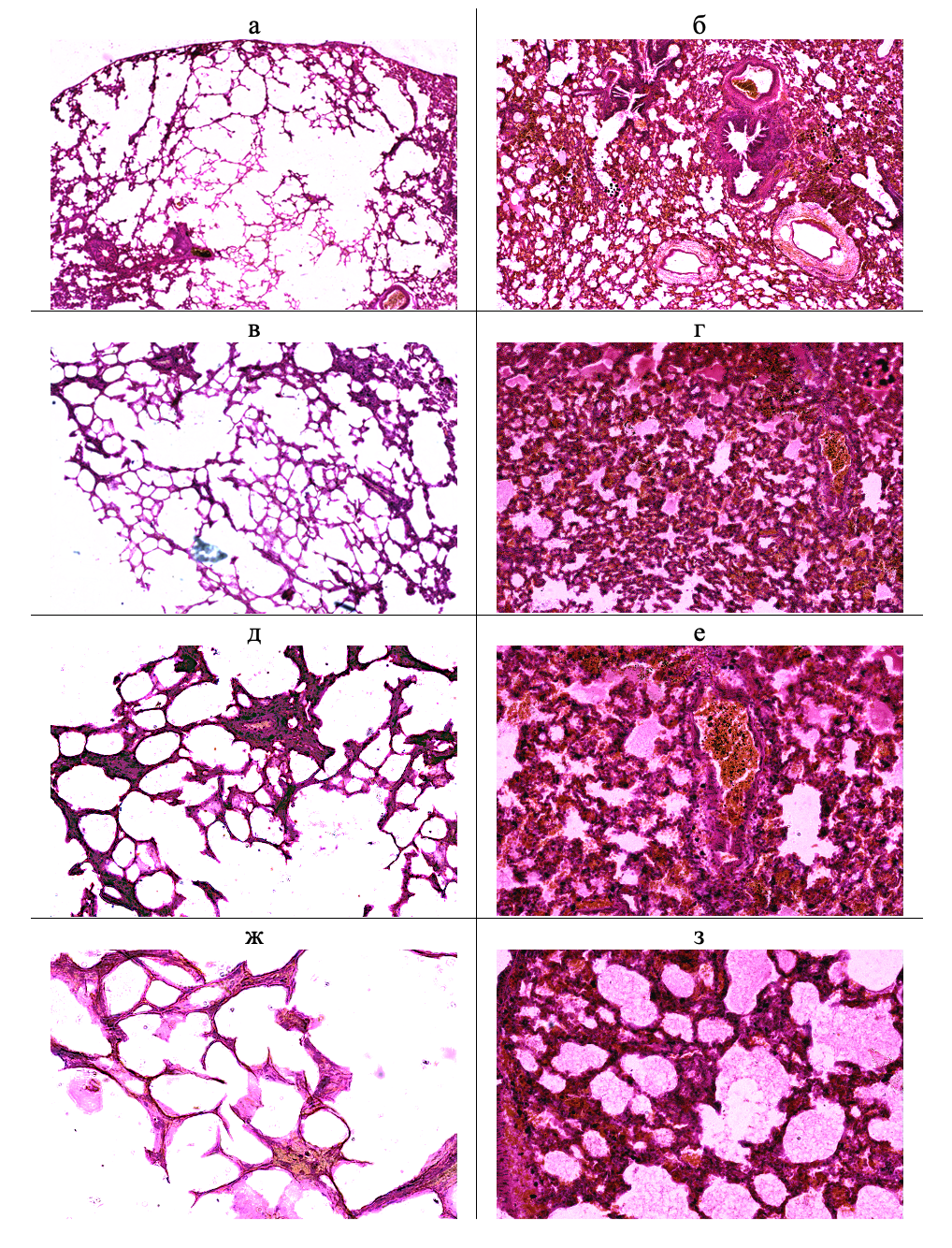
Рисунок 3 - Паренхима легких на парафиновых срезах у животных контрольной (а, в, д, ж) и опытной (б, г, е, з) групп
Примечание: окрашивание гематоксилин-эозином; увеличение: а, б – х 40; в, г – х 100; д, е – х 200; ж, з – х 400
У животных опытной группы на криостатных (см. рис. 2, б, г, е, з) и парафиновых (см. рис. 3, б, г, е, з) срезах гистоархитектоника легочной ткани гетерогенна с локальными очагами альвеолярного отека и дисателектазами на фоне диффузного отека интерстиция. Наблюдался перибронхиальный и периваскулярный отек (см. рис. 2, 3, б). Венулы расширены и заполнены эритроцитами с частичным их гемолизом (см. рис. 2, г; рис. 3, г), выраженный диапедез эритроцитов на парафиновых срезах (см. рис. 3, е). Интерстиций инфильтрирован нейтрофилами, тучными клетками (см. рис. 2, е; рис. 3, з). Часть альвеол заполнена эозинофильной бесклеточной жидкостью (см. рис. 2, 3, е, з), на криостатных срезах в альвеолах выявлена пенистая жидкость (см. рис. 2, е, з).
На рисунке 4 представлены обозначения вышеперечисленных изменений гистоархитектоники легочной ткани при развитии норэпинефринового отека легких на криостатных срезах и парафиновых срезах. Криостатные срезы рис. 4, а, в, д, ж соответствуют рис. 2, б, г, е, з. Парафиновые срезы рис. 4 б, г, е, з соответствуют рис. 3, б, г, е, з. Пояснения к обозначениям описаны в Примечании к рис. 4.
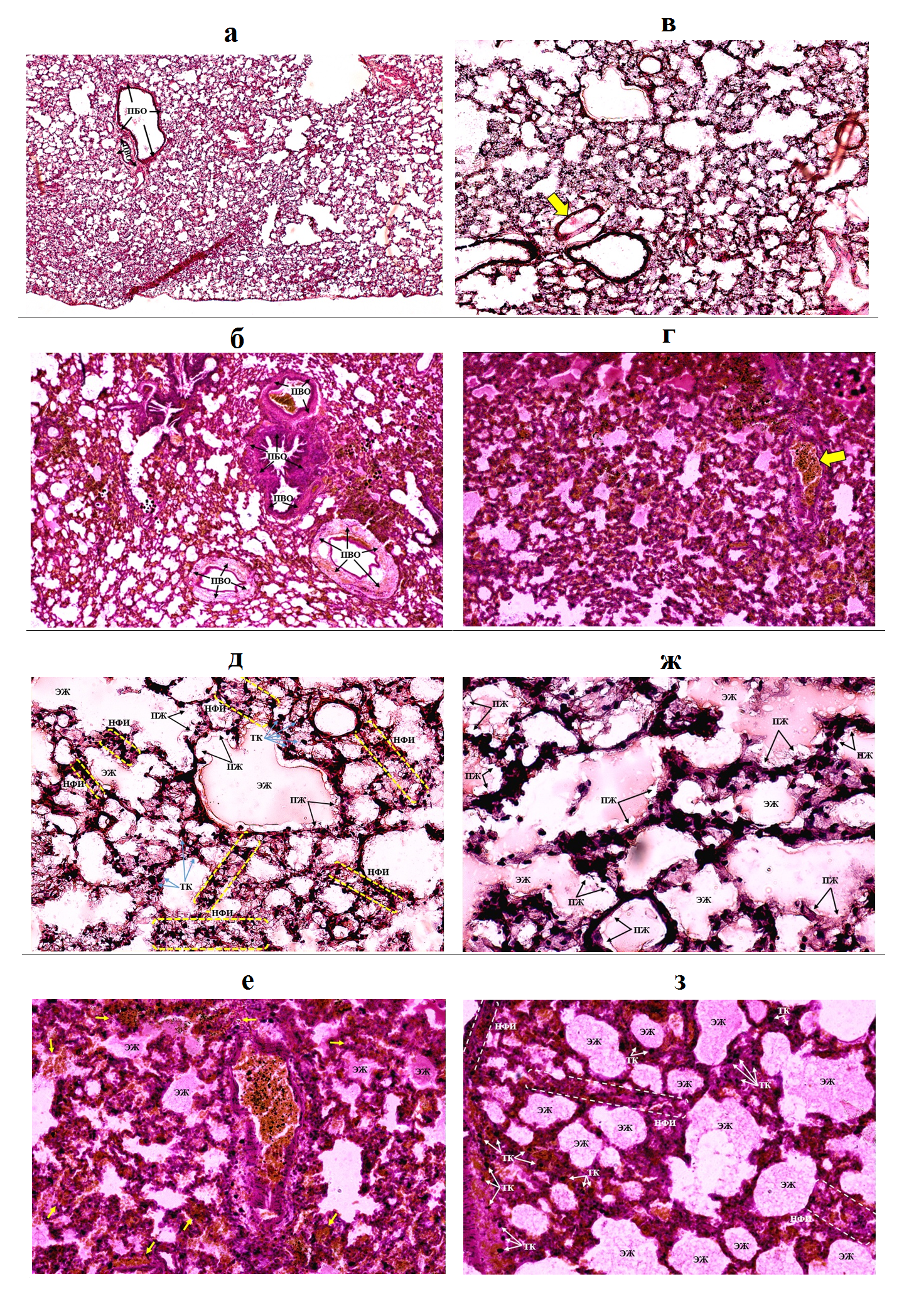
Рисунок 4 - Паренхима легких на криостатных (а, в, д, ж) и парафиновых (б, г, е, з) срезах у животных опытных групп
Примечание: окрашивание гематоксилин-эозином; увеличение: а, б – х 40; в, г – х 100; д, е – х 200; ж, з – х 400;
а, б – стрелками обозначены области перибронхиального отека (ПБО), периваскулярного отека (ПВО); в, г – полнокровие венул с частичным гемолизом обозначено стрелкой желтого цвета; д – эозинофильная жидкость в альвеолах обозначена ЭЖ, пенистая жидкость (ПЖ) указана стрелками, границы инфильтрации нейтрофилами (НФИ) выделены пунктирными линиями желтого цвета, тучные клетки (ТК) указаны стрелками голубого цвета; е – эозинофильная жидкость в альвеолах обозначена ЭЖ, области диапедеза эритроцитов обозначены стрелками желтого цвета; ж – эозинофильная жидкость в альвеолах обозначена ЭЖ, пенистая жидкость (ПЖ) указана стрелками; з – эозинофильная жидкость в альвеолах обозначена ЭЖ, границы инфильтрации нейтрофилами (НФИ) выделены пунктирными линиями белого цвета, тучные клетки (ТК) указаны стрелками белого цвета
Таким образом, гистоморфологический анализ позволил установить, что верификация легочного отека возможна при приготовлении срезов и парафиновым методом, и криостатным методом. Но, выявленные структурные изменения являются неоднозначными. Более качественные изменения в интерстиции отображаются на парафиновых срезах, где определяется повышенная клеточная инфильтрация, плазматическое пропитывание, значительное полнокровие капилляров. В то же время вспенивание жидкости в альвеолярном пространстве наблюдалось нами только на криостатных срезах.
Результаты морфометрического исследования показали, что у животных контрольной группы размерные характеристики структур альвеолярного пространства, определяемые на криостатных и парафиновых срезах не различались (см. табл. 2).
Напротив, у животных в опытной группе наблюдались значимые различия. Измерения структур альвеолярного пространства выполнялись в участках легочной ткани с сохраненной воздушностью. Так средняя ППСА была максимальной на криостатных срезах и превышала таковую на парафиновых срезах на 26,6%. Согласно этому средние МаксДА и МинДА криостатных срезов также превышали таковые парафиновых срезов на 17,3% и 23,8% соответственно. При этом форма альвеол на парафиновых срезах имела более вытянутую овальную форму. Средняя ТМП была наибольшей на парафиновых срезах и превышала в 1,6 раза таковую на криостатных срезах. При этом, средний РАВ, определяемый на парафиновых срезах, был в 2,8 раза меньше, чем на криостатных срезах.
Таблица 2 - Морфометрические характеристики структур альвеолярного пространства на криостатных (КС) и парафиновых (ПС) срезах легочной ткани у крыс
Показатели | Контрольная группа | Опытная группа | ||
КС | ПС | КС | ПС | |
Площадь поперечного сечения альвеол (мкм²) |
200,96±17,28 |
219,35±8,26 |
116,21±13,38*º |
85,25±2,16*º |
Максимальный диаметр альвеол (мкм) |
18,03±0,69 |
20,75±0,58 |
15,26±0,43*º |
12,62±0,26*º |
Минимальный диаметр альвеол (мкм) |
12,93±0,54 |
14,75±0,29 |
9,80±0,21*º |
7,47±0,16*º |
Толщина межальвеолярных перегородок (мкм) |
5,49±0,15 |
5,17±0,15 |
9,24±0,10*º |
14,46±0,30*º |
Размер альвеолярного входа (мкм) |
10,30±0,68 |
9,57±0,47 |
7,92±0,64*º |
2,84±0,15*º |
Примечание: p<0,05, по сравнению с данными контрольной группы – *, между данными в группах – º
Таким образом, морфометрический анализ позволил установить, что размерные параметры структур альвеолярного пространства у интактных животных, определяемые и на криостатных и на парафиновых срезах, являются идентичными, что полностью согласуется и с результатами гистоморфологического анализа. В условиях развившегося норэпинефринового отека легких размерные характеристики структур альвеолярного пространства, определяемые на криостатных срезах, совершенно отличаются от таковых на парафиновых срезах, что также согласуется с результатами гистоморфологического анализа. Безусловно, обе гистологические картины легочного отека — криостатная и парафиновая, позволяют безошибочно, более того, совершенно точно и достоверно верифицировать развитие альвеолярного отека.
4. Обсуждение
Развитие норэпинефринового ОЛ сопровождается повышенными кровенаполнением и оводнением легких, что установлено гравиметрическим исследованием. Результаты гистологического исследования позволили установить, что при данной модели ОЛ у самцов крыс через 50 минут в легких выявляются характерные структурные изменения в виде генерализованного полнокровия сосудов, наличия очаговых дисателектазов, диффузного отека интерстиция и очагового альвеолярного отека, которые выявлены и на парафиновых, и на криостатных срезах. Повышенное кровенаполнение легких с формированием перибронхиального и периваскулярного отека позволяет предположить развитие гемодинамических эффектов норэпинефрина вследствие преимущественной активации α1-адренорецепторов, что обусловлено увеличением системного сосудистого сопротивления и повышением давления заклинивания в легочных капиллярах с развитием венозного застоя в легких , , . В то же время как влияние норэпинефрина, так и развившийся гемодинамический стресс, инициируют синтез ключевого провоспалительного цитокина интерлейкина-6, хемотаксис и нейтрофильную инфильтрацию легких , . Активация цитокинов, воспаление и повышенное капиллярное давление способствуют увеличению проницаемости капилляров и разрушению альвеолярно-капиллярной мембраны. На криостатных и парафиновых срезах в легочных капиллярах выявлен частичный гемолиз эритроцитов, наличие белковой (эозинофильной) жидкости в альвеолах, на криостатных срезах — вспенивание жидкости, на парафиновых срезах выражен диапедез эритроцитов. При обеих методиках приготовления срезов интерстиций легких заполнен мастоцитами и нейтрофилами. Но в то же время на парафиновых срезах выявляется наибольшее увеличение толщины межальвеолярных перегородок с наименьшими размерами альвеолярного входа и альвеол с сохраненной воздушностью по сравнению с таковыми данными, полученными на криостатных срезах.
Известно, что степень гистологического сжатия или расширения ткани может изменяться в зависимости от метода обработки образца . Метод парафиновой заливки может приводить к сжатию легочной ткани . Метод криостатной техники позволяет лучше сохранить исходные объемы и размеры структур альвеолярного пространства, антигенов и нуклеиновых кислот, что делает этот метод незаменимым для иммуногистохимических и молекулярно-биологических исследований . Действительно, при приготовлении срезов криостатным методом мы наблюдали в части альвеол именно пенистую жидкость, что не выявлялось при парафиновом методе. В то же время часть авторов считает, что общее морфологическое качество замороженного среза несколько уступает таковому парафинового среза, однако особенности окрашивания и структура цитозоля являются сопоставимыми , что согласуется с нашими данными.
Так, у интактных животных морфометрический анализ изучаемых структур альвеолярного пространства позволил установить отсутствие значимых изменений при приготовлении срезов и парафиновым, и криостатным методами. Но, в условиях развившегося отека легких гистоархитектоника легочной ткани и данные морфометрии, полученные при изучении криосрезов и парафиновых срезов, различались. Возможно, это связано с особенностями приготовления срезов путем парафиновой заливки. Дело в том, что мы так же, как и при парафиновом методе, готовили фиксированные замороженные срезы, поскольку без предварительной фиксации они физически менее стабильны, чем парафиновые . Поэтому методы фиксации образцов ткани были аналогичными при приготовлении срезов обоими методами. Криостатная техника приготовления срезов используется для изучения жировых и липоидых веществ в ткани, которые теряются при пропитывании ткани парафином . По-видимому, выявленные более выраженные изменения легочной ткани, которые включают характерные признаки застойного полнокровия, определяемые на срезах, приготовленных парафиновым методом, связаны с уменьшением содержания липидов, являющихся своего рода барьером для движения воды.
5. Заключение
Развитие норэпинефринового отека легких у крыс сопровождается равнозначными повышениями и оводнения, и кровенаполнения легких, что на криостатных и парафиновых срезах определяется гетерогенностью изменений гистоархитектоники легочной ткани в виде локальных участков альвеолярного отека и дисателектазов на фоне диффузного отека интерстиция при выраженных морфометрических изменениях, выявляемых на парафиновых срезах, где определяется наибольшее увеличение толщины межальвеолярных перегородок с наименьшими размерами альвеолярного входа и альвеол с сохраненной воздушностью.
