Герпесвирусные инфекции и гиперчувствительность I типа
Герпесвирусные инфекции и гиперчувствительность I типа
Аннотация
В статьи представлены особенности течение герпесвирусных инфекций на фоне гиперчувствительности первого типа, IgE-зависимых заболеваний. Представлена частота ассоциированных форм аллергических заболеваний: аллергический ринит, бронхиальная астма, атопический дерматит и герпес вирусных инфекций 1. Показано, что не всегда хроническая герпетическая инфекция протекает тяжело у пациентов с IgE-зависимыми заболеваниями. Определенные иммунологические изменения и продемонстрировано, что не только изменения по гуморальному типу приводят к частым и неуправляем обострениям данного инфекционного процесса у некоторой категории пациентов. Приведены дополнительные маркеры аллергического воспаления, такие как катионный протеин эозинофилов, повышение которого связано с респираторными типами аллергии.
1. Введение
Герпесвирусные инфекции — вечные спутники человека. Контаминация в мире достигает по 1,2,3,4 и 5 штаммам до 100%
, . При соматическом здоровье клинических проявлений индивид не испытывает. Любые неблагоприятные воздействия на организм, изменяющие параметры гомеостаза, приводят к активации герпесвирусных инфекций. Клинические проявления крайне разнообразны от неспецифических изменений в рамках цереброастеничного синдрома до онкологических заболеваний .Особенности генетической предрасположенности в реализации иммунного ответа накладывают отпечаток на его формирование в рамках типичных или среднестатистических, слабых и гиперэргических реакций
, .Одним из таких генетических отклонений у индивида является атопия — неправильно активированный адаптивный иммунный ответ на внешние раздражители.
В этой связи представляет интерес течение хронических герпесвирусных инфекций у пациентов с атопией. Большинство авторов, как отечественных, так и зарубежных, считают, что на фоне атопии течение данных инфекций более тяжелое до генерализованных состояний. Пример дерматит Дюринга у пациентов атопическим дерматитом.
Авторы поставили перед собой цель изучить особенности течение герпес вирусных инфекций у пациентов с IgE-зависимыми заболеваниями.
2. Методы и принципы исследования
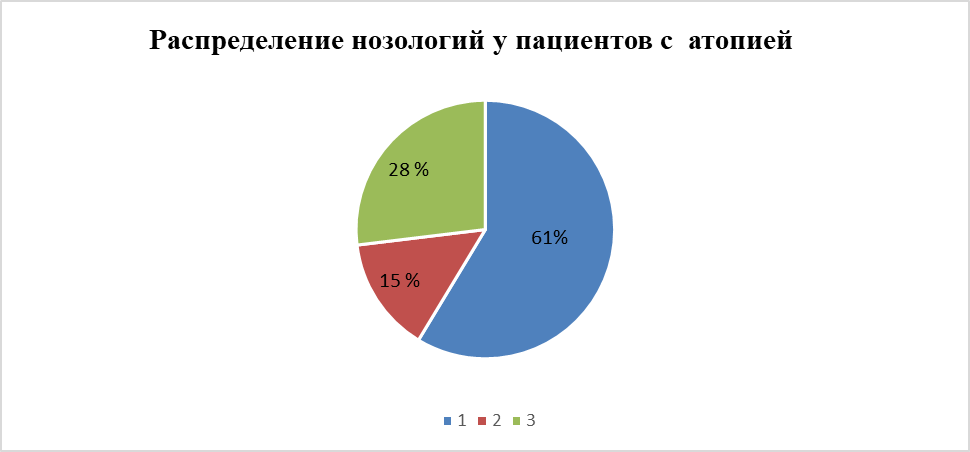
Рисунок 1 - Распределение нозологий у пациентов с атопией:
1 - пациенты с аллергическим ринитом (АР); 2 - пациенты с атопическим дерматитом (АД); 3 - пациенты с бронхиальной астмой (БА)
Все пациенты страдали рецидивами хронической герпес вирусной инфекции, высыпания фиксировались от 3 раз в год, до ежемесячных, средняя частота составляла 5±0,91. При этом синдром хронической усталости, заложенность носа, вне контакта с причинно-значимыми аллергенами по частоте отличались у пациентов с различными аллергическими заболеваниями.
В программу лабораторного исследования были включены следующие анализы: общий анализ крови, риноцитограмма, определение уровня катионного протеина эозинофилов (КПЭ), оценка общего и специфических IgE (к клещам домашней пыли, у шерсти и эпидермису животных: собака, кошка, хомяк, крыса, лошадь, смесь пыльцы деревьев, луговых и злаковых трав, сорных трав, грибов рода Cladosporium, Aspergillus, Alternaria и Penicillium), определение уровня специфических антител класса IgMи IgG к инфекциям семейства герпес 1,2,4 и 5 типов. При выраженном обострении проводили ПЦР исследования (количественные данные) биологических субстратов смывы и соскобы со слизистых оболочек носа, ротоглотки, слюны.
В используемых наборах ИФА для определения специфических титров антител, указанных в инструкциях, заявлены референсные значения по ВПГ1,2 типу IgG КП -1, по ЦМВ до 20 ед, по 4 типу герпеса — к раннему и ядерному антигенам не более 5 ед, к капсидному до 20 ед.
Для ПЦР-амплификации ДНК вируса простого герпеса 1 и 2 типов, цитомегаловируса (HSV1/HSV2/CMV) в режиме реального времени использовались наборы «Герпес комплекс».использовались для ПЦР на 4 тип герпеса.
При статистическом анализе результатов исследования использовались стандартные методы вычисления средних величин, отклонений, а также оценки достоверности различий по Фишеру — Стьюденту, описанные в специальных руководствах. Различия средних величин принимались за достоверные при Р < 0 05.
Работа соответствует этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266.
3. Результаты собственных исследований
В ходе проведенного проспективного исследования были получены следующие данные (Табл 1).
Таблица 1 - Клинико-лабораторные характеристики пациентов с IgEзависимыми заболеваниями
Нозология | Средняя частота обострения герпеса | Кол-во эозинофилов в крови | Кол-во базофилов крови | IgE об | IgE клещи дом. пыли | IgEшерсть животных | IgEк деревьям | IgEк луговым и злаковым травам | IgEк сорным травам | IgEк грибам |
АР | 5,23±0,92 | 10,24±1,02 | 1,04±0,33 | 864±10,21 | 56,47±4,61 | 25,19±1,54 | 64,81±5,84 | 12,47±0,94 | 7,05±0,92 | 25,79±2,04 |
БА | 3,85±1,01 | 8,14±0,94 | 0,94±0,11 | 395±12,91 | 59,15±5,38 | 32,85±2,41 | 48,36±4,72 | 10,12±1,03 | 5,83±0,71 | 39,64±3,57 |
АД | 3,01±0,84 | 6,82±0,71 | 0,82±0,09 | 183±9,57 | 3,64±0,48 | 0,95±0,14 | 0,72±0,02 | 0,26±0,01 | 0,36±0,04 | 42,62±3,88 |
Отдельно хотелось бы остановиться на количестве эозинофилов в крови, в риноцитограмме и концентрации КПЭ.
В последнее время в профессиональном сообществе усилилась дискуссия по поводу определения КПЭ при респираторной аллергии (РА). В ряде исследований, демонстрируется прямая зависимость уровня эозинофилов в крови, назальном секрете, общего IgEс концентрацией КПЭ и степенью тяжести РА у пациентов
, , , . Доминирующим мнением на сегодняшний день является убеждение, что достоверным маркером аллергического воспаления можно считать повышение уровня эозинофилов, как в крови, так и в назальном секрете. При сравнении клинико-анамнестических показателей пациентов с РА в период обострения уровень КПЭ значительно превышал свои нормативные значения и составлял 82,нг/мл при нормедо 24 нг/мл, прямая сильная корреляция была с уровнем IgE(сильная: ±0,7 до ±1), значения которого составилиот 864±10,21 при АР до 395±12,91 при БА ЕД\мл, средний уровень корреляции определялся с эозинофилами периферической крови 10,21±1,02% и назального секрета 11,42±094% при АР и 8,14±0,94% и 7,52±0,83% при БА соответственно.У большинства пациентов с высокими значениями IgE частота обострения герпеса не превышала 1–2 раз в год, но резко увеличивалась, при сочетании повышенного уровня IgE с высокими показателями эозинофилов в крови, в риноцитограмме и, что особенно интересно, при повышении КПЭ
.У этих же пациентов, была практически постоянная заложенность носа, даже в отсутствии длительного контакта с причинно-значимыми аллергенами. В группе с респираторной аллергией ею страдали 77,7% (n=63), у пациентов с АД это значение не превышало 20% (n=3).
Эти же пациенты, чаще других предъявляли жалобы астеновегетативного характера 89.8% с РА (n=72) и 26,6% (n=4) пациентов с АД.
Интересна, на взгляд авторов, распределение специфических антител у пациентов с IgE-зависимыми заболеваниями. Все пациенты были контаминированы и имели серопозитивность по IgG. При этом все пациенты были серонегативные по IgM. Отличительными были значения IgGв исследуемых группах.
Таблица 2 - Клинико-лабораторные характеристики пациентов с IgEзависимыми заболеваниями
Нозология | Средняя частота обострения герпеса | Кол-во эозинофилов в крови | Кол-во базофилов крови | IgE об | IgE клещи дом.пыли | IgEшерсть животных | IgEк деревьям | IgEк луговым и злаковым травам | IgEк сорным травам | IgEк грибам |
АР | 5,23±0,92 | 10,24±1,02 | 1,04±0,33 | 864±10,21 | 56,47±4,61 | 25,19±1,54 | 64,81±5,84 | 12,47±0,94 | 7,05±0,92 | 25,79±2,04 |
БА | 3,85±1,01 | 8,14±0,94 | 0,94±0,11 | 395±12,91 | 59,15±5,38 | 32,85±2,41 | 48,36±4,72 | 10,12±1,03 | 5,83±0,71 | 39,64±3,57 |
АД | 3,01±0,84 | 6,82±0,71 | 0,82±0,09 | 183±9,57 | 3,64±0,48 | 0,95±0,14 | 0,72±0,02 | 0,26±0,01 | 0,36±0,04 | 42,62±3,88 |
Таблица 3 - Значения специфических иммуноглобулинов и ПЦР к инфекциям семейства герпес
Нозология | ИФА | ПЦР | ||||||
ВПГ1,2 типа | ЦМВ | ВЭБ раннему антигену | ВЭБ ядерному антигену | ВЭБ к капсидному антигену | ВПГ1,2 типы | ЦМВ | ВЭБ | |
АР | 18, 14±0,92 | 32,57±3,05 | >5 | 7,31±0,92 | 13,52±1,63 | отр | 9,41±1,01 | 5,92±0,83 |
БА | 14,07 ±1,38 | 28,41±2,23 | >5 | 10,12±0,86 | 36,43±3,81 | отр | 6,47±0,73 | 3,64±0,75 |
АД | 11, 14±092 | 14,28±1,35 | >5 | 12,16±1,35 | 18,61±1,74 | отр | 2,83±0,95 | 1,58±0,92 |
Полученные результаты объясняют отличия в частоте заложенности носа у пациентов с IgE зависимыми заболеваниями и в значениях по астеновегетативному синдрому. Достоверные отличия в группах сравнения, демонстрируют значительную частоту по 5 и 4 типам герпесвирусных инфекций (Табл.2).
4. Обсуждение результатов
Авторы проспективного исследования хотели бы еще раз акцентировать внимание на основных понятиях работы.
Атопия — как гиперчувствительность 1 типа по классификации британских патофизиологов Robert Coombs и Philip Gel (1963), является IgE зависимым процессом и имеет несколько стадий в своем развитии
. Остановимся на первой стадии иммунологической или стадии первичного иммунного ответа. При первичном попадании антигена (у предрасположенных индивидов — аллергена), происходитего идентификация антигенпрезентирующими клетками (АПК), чаще Дендритными клетками (ДК). Процессинг, расщепление, с выведением эпитопов на мембрану клетки сформированием рецепторногокомплекса вместес HLAIIтипа. Последующая передача информации на Т клетки индукторы (хелперы наивные), приводит, под воздействием цитокинов, к реполяризации в Th2 и передачи сигнала на В клетки, дифференцировка которых в плазматические клетки заканчивается выработкой IgE. Ключевыми цитокинами в данных реакциях являются ИЛ4,5 и 13, реже 17 и 22. Данная стадия называется стадией сенсибилизации, при ней клинических проявлений нет. IgE фиксируются на поверхности тучных клетках, базофилах, эозинофилах. При повторном попадании аллергена в организм, наработка IgE происходит очень быстро, увеличивается их количество на рецепторах перечисленных клеток, с последующей дегрануляцией и выбросом биологически активных веществ (гистамин, серотонин и д.р.). Указанные медиаторы воздействуют на сосудистую проницаемость, повышая ее в «шоковых» органах с последующими клиническими проявлениями.Таким образом, механизм атопии, это генетические изменения адаптивного, гуморального иммунного ответа.
Но при индуцировании биохимической стадии и выбросе большого количества медиаторов аллергического воспаления, в очаг воспаления, хемотаксически, усиливается приток гранулоцитарных лейкоцитов — эозинофилов. Для этих клеток ключевым цитокином, помимо ИЛ4 и 13, является ИЛ5. Данные клетки обладают слабой фагоцитарной активностью, не участвуют в механизмах противоинфекционной, особенно противовирусной защиты.
Именно данной особенность течения аллергических заболеваний, эозинофильным фенотипом, клеточным, можно объяснить рецидивирующий характер герпетической инфекции. Помимо отвлечённости по Th2 типу, гуморальному, слабо эффективному при вирусных инфекциях, с выработкой неаффинного к инфекционным антигенам IgE, именно эозинофилы, и их повышение, препятствуют эффективной клеточной защите при герпесвирусных инфекциях при РА
.Более выраженная контаминация инфекциями семества герпес зафиксирована у пациентов РА (АР и БА) с клиническими проявлениями частых рецидивов данных инфекций, заложенностью носа (клиническими проявления ЦМВ инфекции) и выраженным астеновегетативным синдромом.
Хотя помимо инфекционного синдрома и его сочетания с атопией, немаловажное значения имеют второй универсальный фактор альтерации — гипоксический, который и сопровождает респираторные виды аллергии, тем самым усугубляя иммунный дефект.
Выводы:
1. Все пациенты с IgE зависимыми видами аллергических заболеваний были серопозитивные по герпесвирусным инфекциям
2. При респираторных видах аллергии степень выраженности контамиции была выше
3. Вирусная нагрузка была выше в группе пациентов с РА
4. Частота обострений была выше в группах РА
5. Сочетание эозинофильного фенотипа + IgEзависимого варианта течение аллергических заболеваний приводит к более частым рецидивам герпеса
5. Заключение
Проведённое проспективное исследование показало, что у пациентов с IgE-зависимыми аллергическими заболеваниями герпесвирусная контаминация встречается повсеместно и подтверждается серопозитивностью по основным представителям семейства Herpesviridae. При этом, выраженность клинических проявлений и частота рецидивов, герпетической инфекции определяются не только фактом персистенции вируса, но и особенностями иммунного ответа, характерными для атопии. Наиболее неблагоприятный вариант течения герпетической инфекции наблюдается у пациентов с респираторными формами аллергии, особенно при сочетании IgE-зависимого механизма и эозинофильного фенотипа воспаления. Данная комбинация может формировать условия для снижения эффективности противовирусного иммунного контроля, что проявляется ростом вирусной нагрузки и повышением частоты обострений. Полученные результаты подчёркивают клиническую значимость контроля аллергического воспаления и своевременной коррекции факторов, поддерживающих рецидивирующее течение герпесвирусной инфекции у пациентов с атопией.
