Solid Electrolytes of Sodium and Potassium Chlorides in Porous Layers of Amorphous Silicon Dioxide and Aminoacetate Derivatives of PVC on Cellulose Fabric Fibres
Solid Electrolytes of Sodium and Potassium Chlorides in Porous Layers of Amorphous Silicon Dioxide and Aminoacetate Derivatives of PVC on Cellulose Fabric Fibres
Abstract
Two lines of solid electrolytes were synthesized, which consist of a donor solvent, a porous layer of glycinate derivatives of PVC grafted to aerosil microparticles and to cellulose fabric fibers, and dissolved sodium and potassium chloride aquacomplexes. The sorption characteristics of the solvents in terms of chloride and water content were studied. Infrared spectroscopy was used to study the effect of sorbed chlorides on the solid electrolyte composition, the current-voltage dependence in the Pt (+) – MSl solution – solid electrolyte bridge – MSl solution - Pt (-) and the internal resistance of the studied solutions (where M is Na or K). It was demonstrated that the limiting stage of charge movement in the circuit is their transfer through the solid electrolyte. For each electrolyte with potassium chloride, the voltage of the beginning of ion movement was lower and the ion movement rate was higher than that of the electrolyte with sodium chloride.
1. Введение
Материалы с растворами сернокислых натрия и калия в композиционном в пористом донорном растворителе на подложке из целлюлозной ткани (далее твердый электролит) ведут себя как Н+ проводящие мостики . Электролиты построены таким образом, что в порах растворителя имеются многоядерные комплексы {[M(H2O)jL]2SO4}n, где L - группировки донорных амино-, O=Si(O-)2 и O=Si(-O-)-О- СН< и -СОО- групп и амфипротонных O=Si(-O-)-ОН групп, входящих в структуру стенок пор. Электропроводность электролитов в пределах 6*10-8 – 1,1*10-7 См, что, согласно , , характерно для диэлектриков с ионной проводимостью. Движение Н+ происходит в комплексах с участием водородных связей из H2O и O=Si(-O-)-ОН.
Ион Cl-, так же как SO42- известен как мостиковый лиганд , то есть в твердых растворах МCl, весьма вероятно образование аналогичных комплексов. Вместе с тем Cl- и SO42- отличаются зарядом, числом неподеленных электронных пар и размером. В этой связи представляло интерес проследить влияние замены аниона на хлорид-ион на характеристики материалов.
Цель исследования:
- синтезировать твердые электролиты с комплексами на основе МCl в растворителе с разным содержанием аэросила и методом ИК –Фурье-спектроскопии исследовать их строение;
- измерить ионную проводимость электролитов и зависимость тока в цепи катод- раствор МCl – электролит (мостик) – раствор МCl – анод от напряжения на электродах и рассчитать величины напряжения начала движения и константы скорости движения Н+ в электролите, как находящимся на воздухе электрохимическим мостиком;
- сопоставить состав электролитов МCl и M2SO4, их электропроводность и показатели Н+ проводимости и проследить влияние природы анионов на указанные характеристики.
2. Экспериментальная часть и результаты
Величины содержания МCl и воды в хлоридсодержащих электролитах и содержания М2SO4 и воды в сернокислых электролитах приведены в таблице 1. Сами электролиты были приготовлены по методике .
Таблица 1 - Состав электролитов с МCl и М2SO4
Соль | Содержание, ммоль/г | |||||
I | II | III | ||||
Соль | H2O | Соль | H2O | Соль | H2O | |
NaCl | 2,88 | 1,87 | 3,79 | 3,56 | 3,28 | 4,17 |
Na2SO4 | 1,64 | 1,56 | 2,84 | 3,61 | 3,89 | 7,01 |
KCl | 1,56 | 2,15 | 2,42 | 3,74 | 2,01 | 5,99 |
K2SO4 | 3,11 | 2,04 | 5,22 | 3,90 | 6,84 | 5,85 |
Из таблицы 1 видно, что значения содержания солей и воды в электролитах зависят от состава растворителя и природы катиона и аниона. Содержание NaCl для каждого хлоридсодержащего растворителя больше, чем КCl, тогда как содержание Na2SO4 в сернокислых твердых электролитах меньше чем К2SO4. Содержание ионов Na+ и K+ в хлоридсодержащих электролитах меньше, чем в соответствующих сернокислых электролитах. Среднее число naq молекул воды, приходящихся на один катион, в I(NaCl), II(NaCl) и III(NaCl) равное 0.65, 0.94 и 1.27, а в I(КCl), II(КCl) и III(КCl) – 1.38, 1.54 и 2.98. Во всех случаях этих количеств недостаточно, для формирования первой сольватной оболочки ионов. В I(Na2SO4), II(Na2SO4) и III(Na2SO4) naq равно 0.47, 0.63 и 0.9 и в I(К2SO4 ), II(К2SO4) и III(К2SO4) – 0.33, 0.37 и 0.43, то есть для одного и того же растворителя и катиона naq в МCl больше, чем в М2SO4.
ИК спектры электролитов приведены на рис. 1-2. Для сравнения, спектры исходных растворителей приведены в .
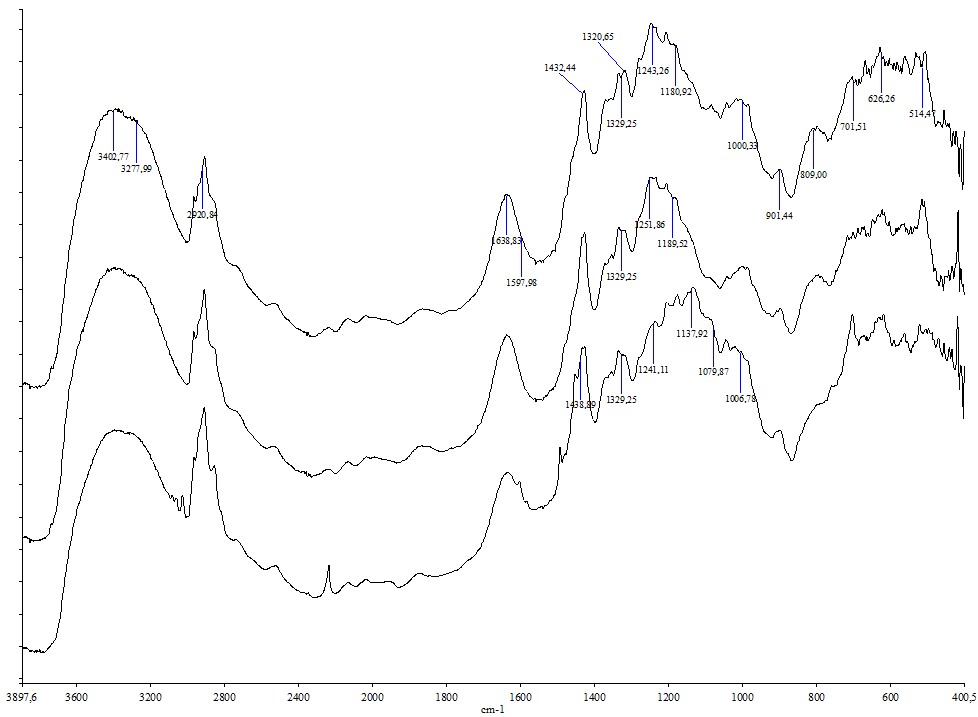
Рисунок 1 - ИК спектры I(NaCl), II(NaCl), III(NaCl), I(КCl), II(КCl), III(КCl)
Примечание: часть 1
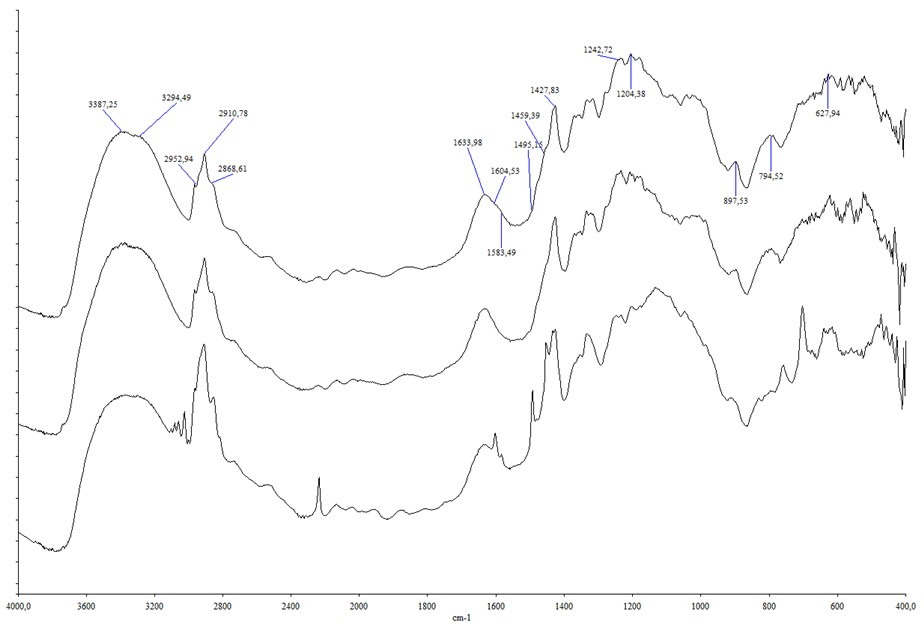
Рисунок 2 - ИК спектры I(NaCl), II(NaCl), III(NaCl), I(КCl), II(КCl), III(КCl)
Примечание: часть 2
Спектры электролитов МCl были сопоставлены со спектрами электролитов М2SO4, приведенными . Установлено, что спектры электролитов МCl в областях 1440 – 1400 см-1, 1240 – 1080 см-1, около 895, 805 – 796 см-1 коррелируют со спектрами соответствующих электролитов с сольватокомплексами {[M(H2O)jL]2SO4}n. Судя по составу I(МCl), I I(МCl) и III(МCl) и их ИК – спектрам, очевидно, что в них находятся многоядерные комплексы [M(H2O)jLCl]n. Сферы М+ в этом комплексе такие же как в {[M(H2O)jL]2SO4}n, Cl- дислоцированные в объеме пор, вступают как мостики.
В табл. 2 приведены значения электропроводности электролитов МCl и для сравнения электролитов M2SO4 .
Таблица 2 - Электропроводность электролитов
Соль | σ, 10-7 | ||
I | II | III | |
NaCl | 4,87 | 4,35 | 3,57 |
Na2SO4 | 2,0 | 1,02 | 0,92 |
KCl | 5,88 | 5,55 | 4,76 |
K2SO4 | 1,11 | 0,83 | 0,66 |
Растворитель состоит из двух твердых фаз. Одна – аэросил, а другая - полимер из сочлененных циклических аминов с -СН2СОО- заместителями, макромолекулы которого окружают микрочастицы аэросила, а отдельные их участки привиты к развитой поверхности аэросила через O=Si(-O-)-О- СН< группы. Электропроводность зависит от подвижности ионов. В первой подвижность катионов и анионов ниже, чем во второй. Как видно из таблицы 2, для одного и того же растворителя σ электролитов МCl больше, чем М2SO4. В электролитах МCl ионы Na+ более подвижны, а в электролитах М2SO4 менее подвижны, чем К+.
Зависимости J от Е приведены на рис 3.
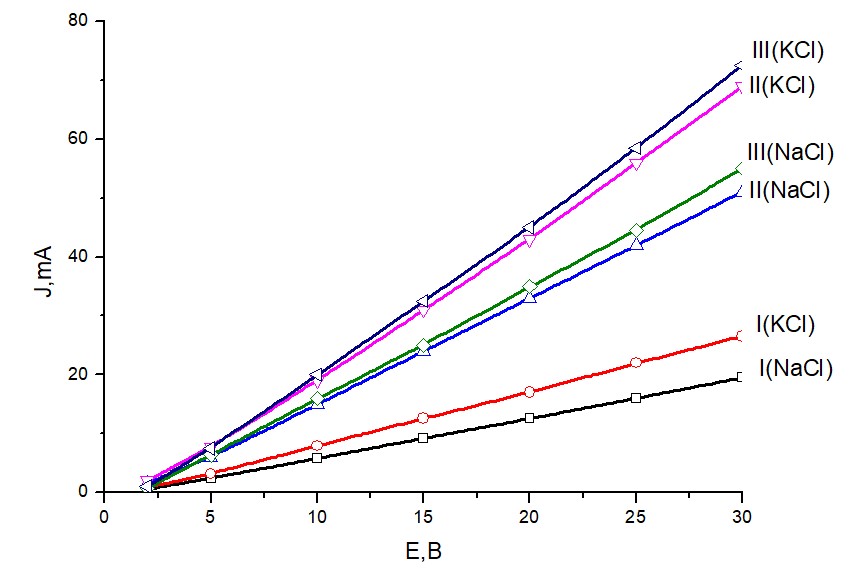
Рисунок 3 - Зависимости тока от напряжения в цепи катод- раствор МCl- электролит- раствор МCl – анод
Таблица 3 - Напряжение начала движения Н+ и константа скорости переноса в электролитах
Электролит | U0, В | kск 105, г-экв/секВ |
I(NaCl) | 1,53 | 0,70 |
I(Na2SO4) | 0,12 | 0,19 |
I(KCl) | 1,59 | 0,97 |
I(K2SO4) | 0,1 | 0,39 |
II(NaCl) | 1,66 | 1,86 |
II(Na2SO4) | 0,21 | 0,29 |
II(KCl) | 1,93 | 2,47 |
II(K2SO4) | 0,2 | 0,81 |
III(NaCl) | 1,59 | 1,97 |
III(Na2SO4) | 0,28 | 0,38 |
III(KCl) | 2,0 | 2,59 |
III(K2SO4) | 0,22 | 1,24 |
Движения Н+ в электролитах NaCl начинается при меньшем Енач, чем для KCl, как видно из таблицы 3. В случае Na2SO4 – при большем Енач, чем К2SO4. Во всех электролитах с солями калия величины kск больше, чем с солями натрия. Движение Н+ в электролитах с М2SO4 начинается при меньших значениях Енач, чем с МCl, тогда как kск для электролитов МCl выше чем с М2SO4. Во всех случаях kск возрастает с увеличением массовой доли аэросила.
3. Заключение
Исследования показали, что состав электролитов, величины ионной проводимости, а также значения напряжения, при котором начинается движение Н+ в цепи и kск движения Н+ в электролите, как в электрохимическом мостике, для солей натрия и калия зависят от природы аниона. В SO42- имеются 10 неподеленных электронных пар, а в Cl- – четыре пары. Как мостиковый лиганд SO42- может координировать до 6 катионов, а Cl- – до четырех. Протяженность фрагмента 2М-- О2SO2--2М примерно равна 2rкатион + rанион. Расчеты с использованием значений r согласно показали, что эти величины в сернокислых твердых электролитах для Na+ составляет 0.49 нм, а для К+ - 0.56 нм, а М- Cl -М – для Na+ – 0. 37нм, а для К+ - 0.45 нм. Следовательно, в электролитах М2SO4 в одних и тех же порах упаковка комплексов больше, чем в электролитах МCl. Этим можно объяснить, что содержание М+ в электролитах с МCl меньше, чем М2SO4, а naq в электролитах в МCl больше, чем в М2SO4, а также влияние указанных факторов на подвижность анионов.
Растворитель построен таким образом, что из раствора с анодом Н+ попадая в поры полимера притягиваются к анионам. Значение рК для НSO4- около 3, а для НCl – менее 0.5, то есть сродство к Н+ у SO42 + существенно больше, чем у Cl-. При этом SO42- менее гидратирован чем Cl-. Соответственно, перенос Н+ из раствора в электролит М2SO4 происходит при меньшем Енач, чем с МCl. Перенос Н+ через электролит, как было показано в происходит по эстафетному механизму. Как отмечалось выше kск для электролитов МCl выше чем для М2SO4. В движении Н+ участвуют атомы водорода из Н2О и O=Si(-O-)-ОН групп. В электролитах М2SO4 величины naq меньше, чем в электролитах МCl, то есть в эстафете в электролитах М2SO4 участвует меньшее число атомов водорода, чем в электролитах МCl. Этим можно объяснить, что kск движения Н+ в электролитах МCl, больше, чем М2SO4.
