ELECTROCHEMICAL RESEARCH OF PATINA PROPERTIES
Ким Е.Т.1, Абдульменова Е.В.2, Лямина Г.В.3
1 Магистрант; 2 бакалавр; 3 кандидат химических наук, доцент, Национальный исследовательский Томский Политехнический Университет
ЭЛЕКТРОХИМИЧЕСКОЕ ИЗУЧЕНИЕ СВОЙСТВ ПАТИН
Аннотация
В работе методом циклической вольтамперометрии были изучены медные образцы покрытые патиной, сформированной в растворах различного состава. Лучшая коррозионная устойчивость наблюдается у патины, сформированной в кислом растворе нитрата меди и нитрата серебра.
Ключевые слова: циклическая вольтамперометрия, патина, коррозия металлов.
Kim Е.Т.1, Abdulmenova Е.V.2, Lyamina G.V.3
1 Graduate student; 2 undergraduate student; 3 PhD in chemistry, associate professor, National Research Tomsk Polytechnic University
ELECTROCHEMICAL RESEARCH OF PATINA PROPERTIES
Abstract
The copper patinas samples were formed in the solutions various composition and researched by a cycling voltammetry. The patinas formed in the acid solution of copper nitrate and silver nitrate have the best corrosion stability.
Keywords: cyclic voltammetry, patina, metal corrosion.
Немалую часть среди объектов, требующих реставрации занимают изделия из меди и ее сплавов. Зачастую для защиты от внешних воздействий и создания декоративной окраски такие объекты покрывают слоем патины. Однако даже если использовать известные рецепты для патинирования, воспроизводимый фазовый состав на поверхности меди получить достаточно сложно.
Цель работы – изучение защитных свойств патин, сформированных на поверхности меди из растворов различного состава методом циклической вольтамперометрии.
Методика эксперимента
В работе использовали потенциостат-гальваностат IPС-Pro MF. Регистрацию циклических вольтамперных кривых (ЦВА) проводили трех электродной ячейке. В качестве фонового электролита использовали растворы 0,1М KCl и 0,1М HCl, приготовленные с использованием деионизованной воды; электрода сравнения – насыщенный хлорид серебряный электрод; вспомогательного электрода – графитовый стержень. Исследуемые образцы – медные пластины, со сформированными на них патинами (5х5 мм) – использовали в качестве индикаторного электрода. Регистрацию ВА кривых проводили в диапазоне изменения потенциалов от -1000 до 700 мВ со скоростью развертки 10 мВ/c.
Таблица 1 – Составы растворов для патинирования (г/л)
|
Патина № 1 Коричневая |
Патина № 2 Темно-коричневая |
Патина № 3 Темно-оливковая |
|
Cu(CH3COO)2 – 5 NH4OH – 7 CH3COOH – 3 |
NiSO4 – 2 KClO3 – 3 |
Cu(NO3)2 – 20 AgNO3 – 0,8 HNO3 – 1 |
Перед патинированием поверхность меди была очищена травителем (HNO3:H2SO4:NaCl:ZnSO4 = 300:200:2:1,5, %, масс.). На очищенной поверхности электродов были сформированы три вида патин (табл. 1) [1, 2].
Результаты и их обсуждения
На рис. 1 представлены ЦВА кривые патин, сформированных в растворе 1, 2 и 3 (3-я регистрация) в растворе KCl. Катодное восстановление окислителей – молекул электролита на поверхности третьего образца проходит с большей скоростью (рис. 2, кривая 3).
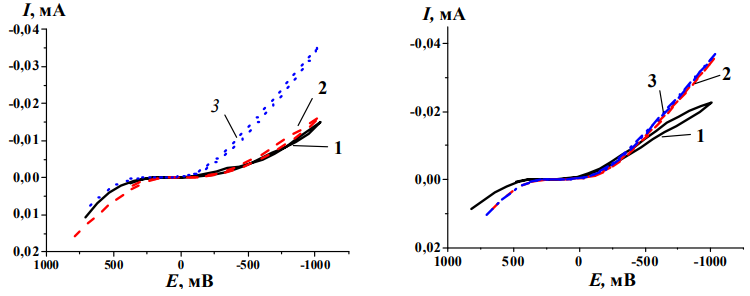
Рис. 1 – ЦВА кривые патин, сформированных в растворах 1, 2, 3; Фоновый электролит (а) 0,1М КСl, (б) 0,1М HCl

Рис. 2 – Оптические изображения патин, сформированных в растворе: (а) № 1; (б) № 2; (в) № 3
Так как выделение окислителей, например, водорода, на поверхности металла протекает более активно, чем на поверхности оксидов, очевидно, что медь, выдержанная в KCl имеет ювенильные участки, свободные от патины. На поверхности патин, сформированных в растворах 1 и 2, восстановление окислителя проходит не так активно (рис. 1а, кривые 1, 2). В растворе HCl катодное восстановление окислителя на поверхности патин (рис. 1, б) закономерно проходит с большей скоростью, чем в KCl. Необходимо отметить, что и в кислой и в нейтральной среде большей коррозинной устойчивостью обладает патина, сформированная в растворе нитрата меди.
Таблица 2 – Характеристики патин, сформированных в растворах №1, 2, 3, полученные при 3-ей последовательной регистрации ЦВА кривых
|
Характеристика |
KCl |
HCl |
||||
|
1 |
2 |
3 |
1 |
2 |
3 |
|
|
I, A·10-9 |
20±1,2 |
170±85,5 |
21±6 |
40±6,8 |
15±3,1 |
18±0,6 |
|
Eкорр, мВ |
217±51 |
118±102 |
284±30 |
338±34 |
256±61 |
261±32 |
|
Ер.Ox, мВ |
161±49 |
95±91 |
289±14 |
329±43 |
252±62 |
260±80 |
|
Ер.Red, мВ |
177±50 |
140±136 |
300±41 |
350±36 |
260±55 |
267±29 |
По величине доверительного интервала (табл. 2) видно, что патина, сформированная в растворе сульфата никеля, имеет невоспроизводимую поверхность (состав, структура). Данный факт подтверждают оптические изображения патин (рис. 2), на которых видны дефектные участки, не покрытые патиной, (рис. 2 б).
Выводы
- В растворе КСl катодное восстановление окислителей проходит с большей скоростью у патины, сформированной в растворе нитрата меди. На поверхности патин 1 и 2 окисление проходит не так активно.
- Патина, сформированная в растворе сульфата никеля, имеет невоспроизводимый фазовый состав.
- Большей коррозионной устойчивостью в нейтральной и кислой средах, обладает патина, сформированная в растворе нитрата меди.
Литература
1. Никитин М. К. Химия в реставрации: Справочное пособие – Л.: Химия, 1990. – 304 с.
2. Ким Е. Т., Лямина Г. В. Реставрация меди и ее сплавов полимерным гель – электролитом // Высокие технологии в современной науке и технике: тезисы докл. Всерос. конф. (Томск, 27-29 марта 2013г.). Томск – 2013.
