ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ТКАНЯХ ПЕЧЕНИ УМЕРШИХ ОТ ВИЧ-ИНФЕКЦИИ ПАЦИЕНТОВ
ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ТКАНЯХ ПЕЧЕНИ УМЕРШИХ ОТ ВИЧ-ИНФЕКЦИИ ПАЦИЕНТОВ
Аннотация
ВИЧ-инфекция (СПИД) является частой причиной смертности в молодом возрасте, однако механизмы патогенеза полностью не раскрыты. На современном этапе исчерпывающие данные о повреждающихся вирусами клеточных мишенях ограничены, что препятствует разработке таргетной терапии. Целью исследования являлось изучение патоморфологических особенностей изменений в тканях печени у умерших от ВИЧ-инфекции больных. Выполненный патоморфологический анализ препаратов материала 44 пациентов, умерших в результате ВИЧ-инфекции за период с 2014 по 2024 год, имевших сопутствующие заболевания, включая гепатит С, позволил выявить многочисленные деструктивные изменения в ткани печени с сопоставлением данных, представленных в 17 зарубежных литературных источниках по данному вопросу. Анализ собственных и литературных данных дал возможность расширить представления о патогенетических механизмах развития морфологических изменений в организме ВИЧ инфицированных пациентов с гепатитом С. Установлено, что патогенез СПИД и его прогрессирование связаны с нарушением метаболизма гемоглобина в эритроцитах, который разрушаясь, поступает в просвет кровеносных сосудов печени. Свободный гемоглобин не способен участвовать в клеточном дыхании, приводя к гипоксии структурных элементов печени. Невозможность использования клетками свободного кислорода приводит к усугублению гипоксии, затем к аноксии и возникновению интоксикации в результате массивного разрушения гемоглобина и появления в плазме трансферрина, который захватывается макрофагами. Освободившийся из эритроцита гемоглобин, поступая в сосудистое русло, приводит к гибели клеток, как результат токсического действия на клетки тканей печени, а в результате возникающей ишемии ухудшается кислородное снабжение всех структур. Образующиеся продукты распада гемоглобина, включающие железо, билирубин и порфирин способствуют развитию желтухи или острой порфирии в сопровождении каскада гибели гепатоцитов, манифестом чего является развитие цирроза или онкозаболеваний. Таким образом, одним из патогенетических звеньев СПИД, наряду с известным нарушением дифференцировки Th пула лимфоцитов, являются эритроциты.
1. Введение
Известно, что ВИЧ-ассоциированный СПИД является одной из частых причин летальности в молодом возрасте. Коинфекция вируса гепатита С (ВГС) с вирусом иммунодефицита человека (ВИЧ) растёт из-за схожих путей передачи, при этом хроническая инфекция ВГС является наиболее частым осложнением среди ВИЧ инфицированных
, . Многие авторы считают гепатит С на фоне ВИЧ-инфекции и хронические гепатиты провоцирующим фактором для поражения структур печени и развития в последующем цирроза . Kaspar M.B., Sterling R.K. (2016) считают, что в связи с применением антивирусных препаратов развивается гемолиз и повышается билирубинемия , причем авторы исследовали результаты лечения ВИЧ на фоне гепатита С у 344 инфицированных пациентов и выявили значительное увеличение гипербилирубинемии после начала применения препаратов. В целом, по данным многих авторов, эффективность стандартного противовирусного лечения не превышает 50-80%. Однако, несмотря на появление значительного количества лекарственных препаратов для лечения ВИЧ-инфекции, вопросы патогенеза ВИЧ-инфекции полностью не раскрыты и патогенетически обоснованное лечение на современном этапе не является достаточным . Контроль и прогнозирование ВИЧ на основе современной стратегии лечения обеспечили возможность реального увеличения медианы выживаемости пациентов, однако агрессивное лечение сопровождают новые проблемы. Среди ВИЧ инфицированных пациентов увеличилось количество заболевших раком . Патоморфологический анализ аутопсийного материала погибших больных с подтверждённым диагнозом ВИЧ-инфекции не даёт полного ответа на вопросы патогенетических процессов, ведущих к смертельному исходу . Развивающаяся стойкая анемия характерна для большинства больных СПИД на фоне гепатита С, которая еще более усугубляется из-за приёма токсических антиретровирусных препаратов , . Исчерпывающее патофизиологическое обоснование анемии на современном этапе отсутствует, как и понимание механизмов снижения гемоглобина в крови больных гепатитом С и ВИЧ инфицированных. Поддерживается концепция многофакторной природы анемии , , . Отсутствием правильных представлений о патогенезе СПИД можно объяснить неудачи в попытках эмпирического использования эритропоэтина в лечебных целях для пациентов с гепатитом С и ВИЧ инфицированных , , .Актуальность изучения патоморфологических проявлений ВИЧ-инфекции на фоне гепатита С связана с необходимостью решения вопросов своевременной диагностики и стратегии патогенетически обоснованного лечения, с прогнозированием исходов и выполнения реабилитации с профилактикой раннего присоединения оппортунистических инфекций, поражающих различные органы и системы больных
, . Для полного представления о механизмах патогенеза при развитии ВИЧ/СПИД-инфекции необходимы более глубокие патоморфологические исследования, оценка и анализ появления новых данных о морфологических особенностях диагностируемого материала.Цель исследования: изучение патоморфологических особенностей изменений в тканях печени у умерших от ВИЧ-инфекции больных.
2. Методы и принципы исследования
В работе использованы материалы аутопсии инфицированных ВИЧ 9 детей в возрасте от 4-х месяцев до 12 лет и 35 взрослых больных от 30 до 38 лет, умерших от СПИД, осложнённого присоединившимися оппортунистическими инфекциями. Пациенты с ВИЧ-инфекцией и сопутствующим гепатитом С составили группу 15 человек, и 13 человек вошли в группу пациентов с гепатитом С. Данные получены с разрешения этического комитета ФГАОУ ВО «Дальневосточный федеральный университет» с использованием положений Хельсинской декларации (2013). Группу контроля составил аутопсийный материал 17 пациентов мужского пола, погибших в результате травм, несовместимых с жизнью в возрасте от 3 мес. до 38 лет (табл. 1).
Таблица 1 - Распределение аутопсийного материала ВИЧ-инфицированных пациентов
№ п/п | Возрастные группы (мужской пол) | Контроль (мужской пол) | Патология | Материал | ||
Печень, почки, легкие | ||||||
Гепатит С | Гепатит С + ВИЧ инфекция | ВИЧ инфекция | ||||
1 | 3 мес. – 12 лет | 3 |
| 3 | 6 | 9 |
2 | 30-33 года | 3 | 7 | 4 | 3 | 14 |
3 | 34-35 лет | 3 | 3 | 3 | 3 | 9 |
4 | 36-38 лет | 8 | 3 | 5 | 4 | 12 |
ИТОГО | 17 | 13 | 15 | 16 | 44 | |
Примечание: в таблице указаны абсолютные числа; составлена авторами по результатам данного исследования
Фиксация материала проводилась в 10% формалине, затем после удаления фиксатора и промывки биоптатов, осуществляли заливку в смесь ксилола и парафина с нарастающим преобладанием парафина. Окончательная заливка проведена в чистую порцию парафина, из застывшего блока изготовлены срезы с последующим депарафинированием в нескольких порциях ксилола. Окрашивание гистологических срезов биоптатов печени выполнили с помощью классического протокола для использования гематоксилина и эозина. Анализ материала для получения оценки патоморфологической характеристики особенностей вирусного повреждения структурных элементов органов выполнен на микроскопе Olympus – Bx82, оснащённым цифровой камерой CDх82 с фирменным IT- программным обеспечением при увеличении х200, х400.
3. Результаты исследования и их обсуждение
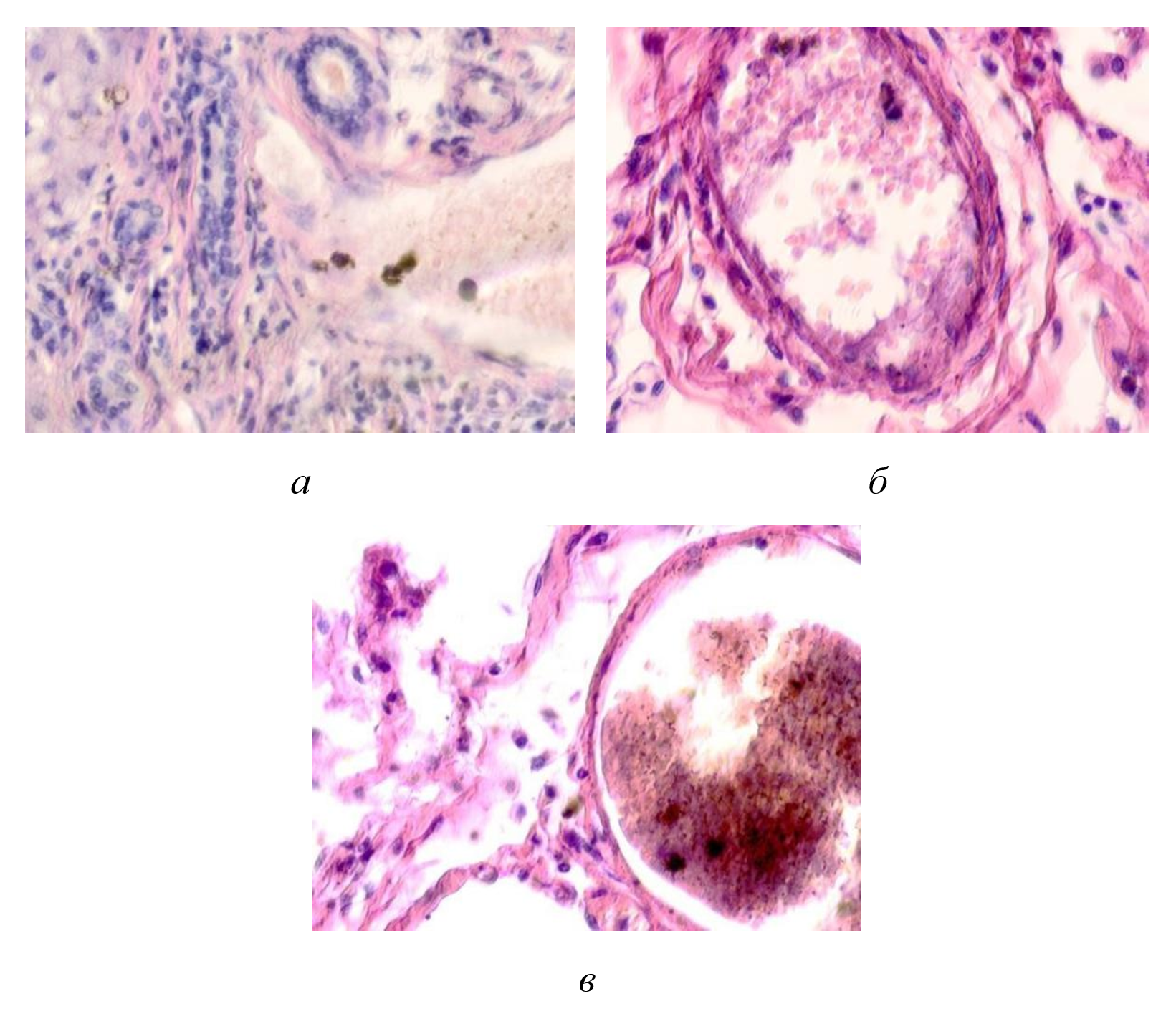
Рисунок 1 - Паренхимные структуры печени человека у ВИЧ инфицированных пациентов:
а - макрофагальные клетки с внедрением в цитоплазму пигмента в проеме сосуда; б - пигмент в цитоплазме макрофагальных клеток и диффузно расположенный в проеме сосуда; в - пигмент в проеме сосуда
Примечание: окраска гематоксилином и эозином; микрофото; ув. х 200; составлен авторами по результатам данного исследования
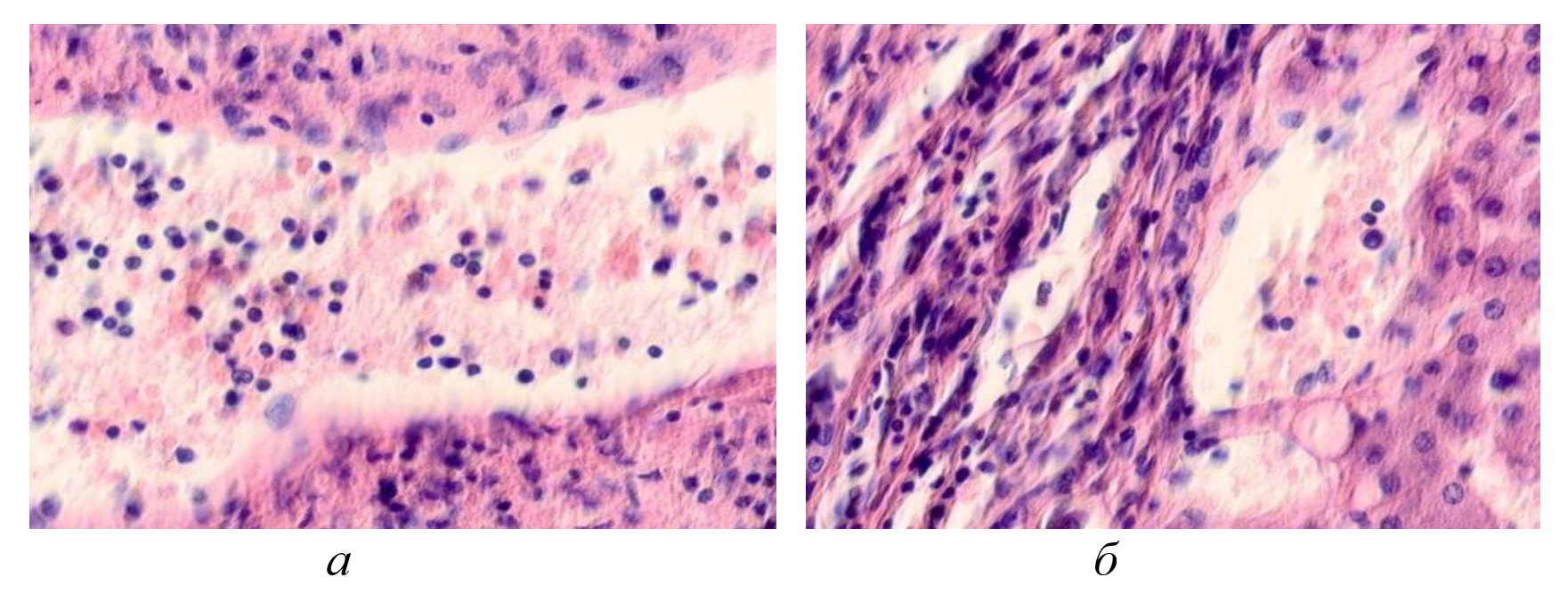
Рисунок 2 - Паренхимная структура печени у ВИЧ инфицированных пациентов на фоне гепатита С, псевдодолька печени:
а, б - лейкоциты в проеме выносящего сосуда
Примечание: окраска гематоксилином и эозином; микрофото; ув. х 200; составлен авторами по результатам данного исследования
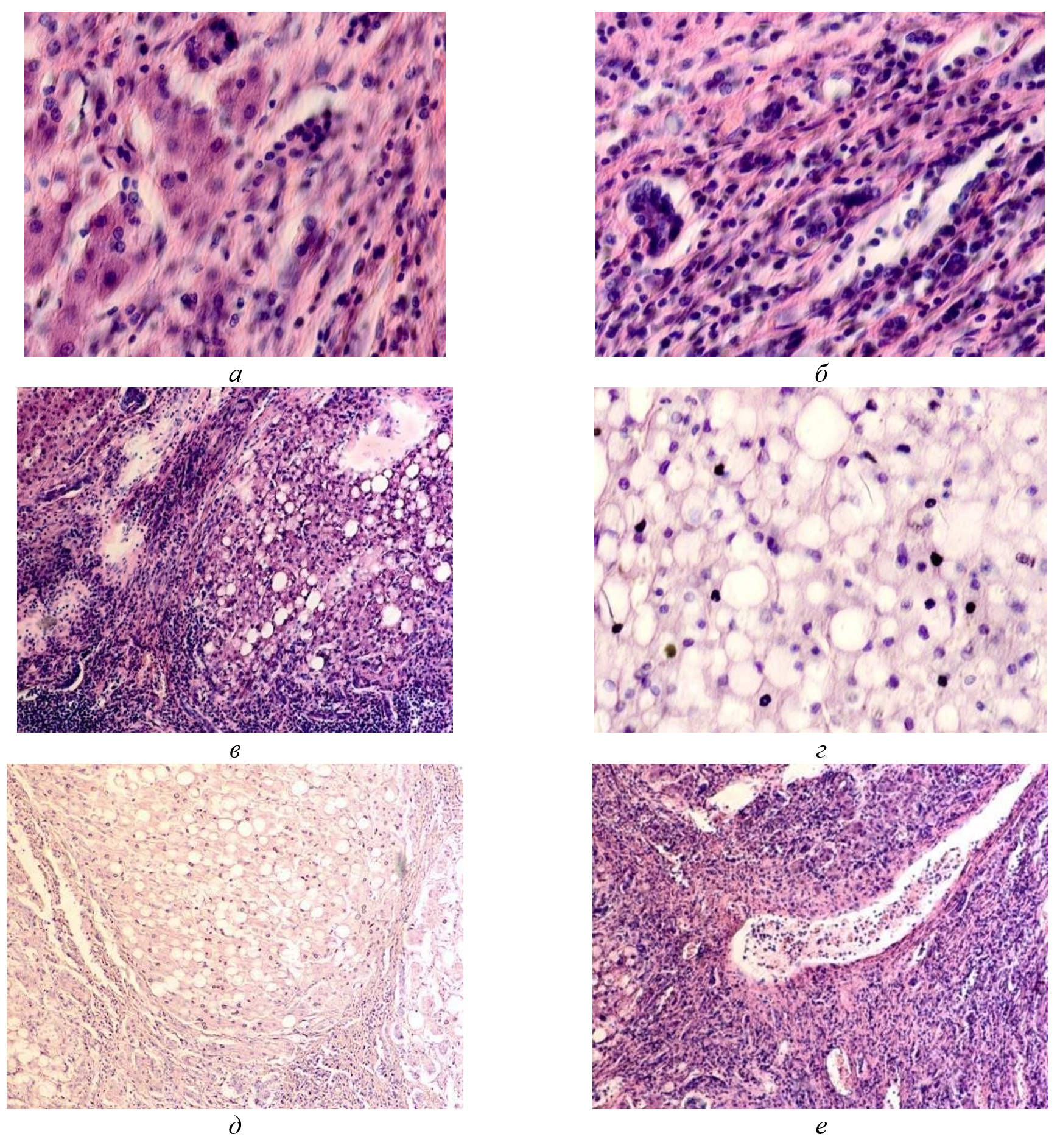
Рисунок 3 - Паренхимная структура печени больных с гепатитом С у ВИЧ инфицированных пациентов, псевдодолька печени:
а, б - лейкоцитарная диффузия междольковых структур; в, г - жировой гепатоз; д, е - цирроз
Примечание: окраска гематоксилином и эозином; микрофото; ув. х 200; составлен авторами по результатам данного исследования
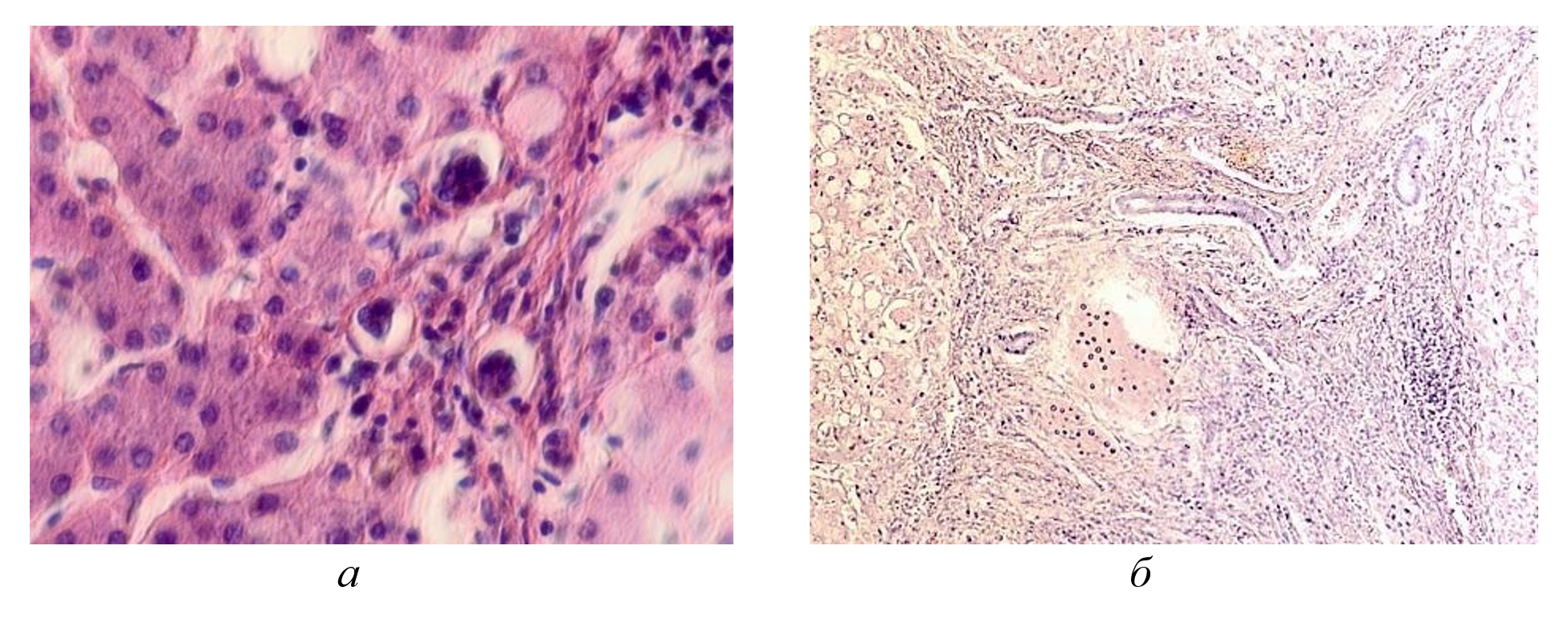
Рисунок 4 - Паренхимная структура печени больных с гепатитом С у ВИЧ инфицированных пациентов, псевдодолька печени:
а - тельца Councilman; б - замещение клеток паренхимы печени рубцовой тканью и клеточный некроз, отсутствует центральная вена, апоптоз гепатоцитов
Примечание: окраска гематоксилином и эозином; микрофото; ув. а - х 200; б - х 400; составлен авторами по результатам данного исследования
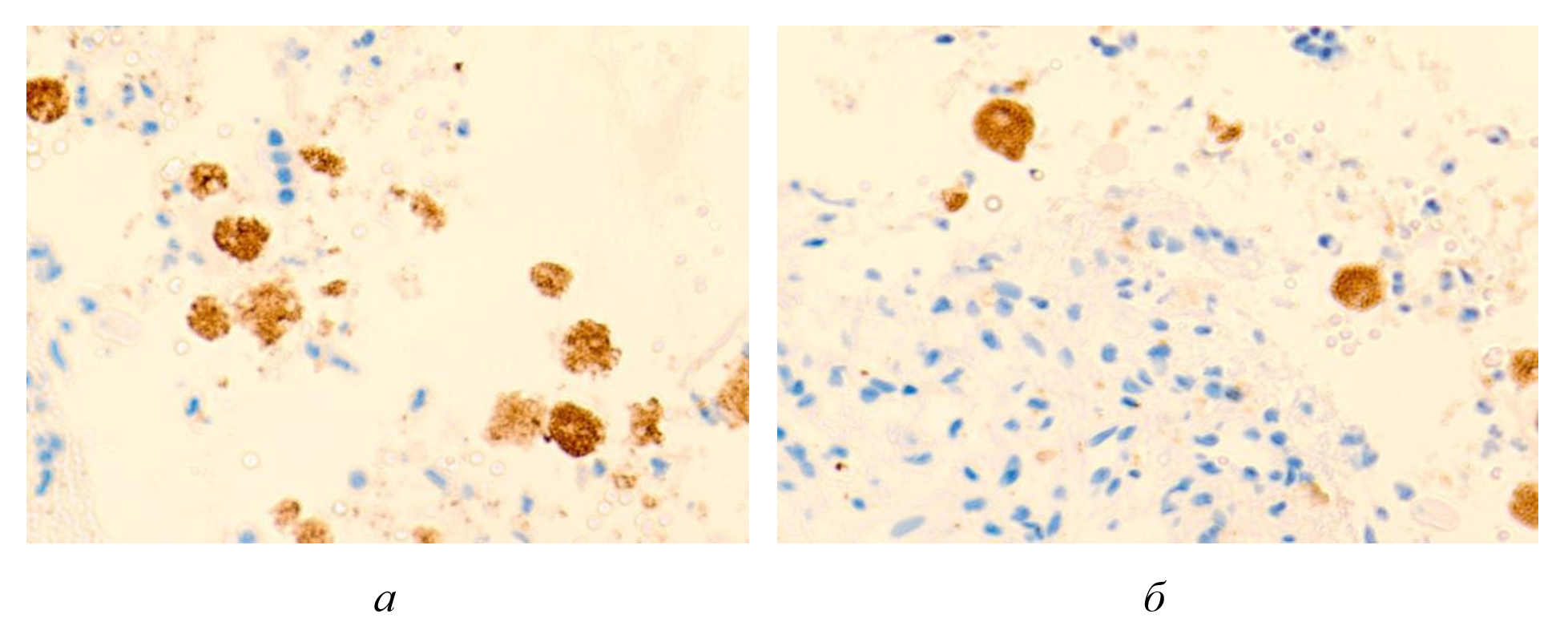
Рисунок 5 - Макрофагальные клетки с трансферрином внутри проема кровеносных сосудов печени больного гепатитом С на фоне ВИЧ инфицирования
Примечание: микрофото; окраска гематоксилином и эозином; ув. х400; составлен авторами по результатам данного исследования
Иммунологический профиль характеризовался выраженной анергией: медиана CD4+ лимфоцитов составила 52,3 кл/мкл при медиане CD8+ 601,2 кл/мкл, что отразилось в критическом снижении иммунорегуляторного индекса до 0,09. Параллельно регистрировалась высокая вирусная нагрузка — 310384 РНК HIV кл/мл.
У пациентов с коинфекцией ВГС, получавших антиретровирусную терапию, несмотря на структурные нарушения печени, зафиксированы более высокие иммунологические показатели: медиана CD4+ достигала 95,4 кл/мкл, CD8+ — 488,7 кл/мкл, иммунорегуляторный индекс — 0,19, при существенном снижении вирусной нагрузки вплоть до неопределяемого уровня.
Микроскопически в 73% случаев (n=32) идентифицированы нарушения микроциркуляции в виде венозного полнокровия с дилатацией центральных вен и капилляров. На фоне гипоксически-индуцированного гемолиза отмечена редукция популяции клеток Купфера, коррелирующая с системным иммунодефицитом.
Морфологический анализ выявил комплексные патологические изменения печеночной паренхимы, характеризующиеся внутрипеченочным холестазом с обструкцией билиарных протоков и последующим развитием склеротических изменений в соединительнотканном компоненте печени. При светооптическом исследовании гематоксилин-эозиновых препаратов у всех пациентов (n=44) обнаружены дегенеративные изменения гепатоцитов, при этом в 75% случаев (n=33) визуализировалась жировая дистрофия с формированием множественных вакуолей различного калибра и периферическим смещением ядер. Нарушение дольковой архитектоники печени сопровождалось фиброзом портальных трактов различной степени выраженности с мононуклеарной инфильтрацией у 35% пациентов (n=15). Сочетание различных видов дистрофических изменений с очаговыми некрозами и портальным фиброзом вплоть до цирротической трансформации наблюдалось во всех исследуемых образцах. В 16% случаев (n=7) зафиксировано развитие продуктивных васкулитов с фибриноидным набуханием и некрозом стенок артериол на фоне циркуляторных нарушений, что привело к формированию микроабсцессов и инициации канцерогенеза.
Патоморфологическое исследование выявило, что структурные изменения печеночной паренхимы у пациентов с коинфекцией ВИЧ и гепатита С обусловлены гемолизом эритроцитов, деградацией гемоглобина и последующим развитием клеточной аноксии. При остром течении гепатита С наблюдается характерная морфологическая картина с перидольковой лейкоцитарной инфильтрацией и поражением зоны триад при сохранении архитектоники классической печеночной дольки. Трансформация острого гепатита в хроническую форму сопровождается формированием псевдодолек, дилатацией желчевыводящих путей и апоптозом гепатоцитов, что соответствует общепринятым представлениям о патогенетических механизмах поражения печени при сочетанной ВИЧ/HCV-инфекции.
Комплексный анализ органов ВИЧ-инфицированных пациентов выявил, помимо классических патоморфологических изменений (гиперемия паренхимы, апоптотические и дегенеративные процессы, фибротизация, цирротическая трансформация печени с последующим развитием очаговых некрозов и лейкоцитарной инфильтрации), универсальную депозицию коричневого пигмента в венозном русле всех исследованных органов.
В результате комплексного исследования установлено, что темная пигментация цитоплазмы макрофагов представляет собой накопление трансферрина, обусловленное нарушением катаболизма гемоглобина при массивном гемолизе эритроцитов. При коинфекции ВИЧ и вирусного гепатита С патоморфологические изменения печеночной паренхимы инициируются гипоксическим состоянием, индуцирующим последовательное развитие апоптоза и некроза гепатоцитов. Данные деструктивные процессы усугубляются прогрессирующей ишемией тканей, вызванной токсическим воздействием свободного гемоглобина, поступающего в синусоидальное русло при массированном эритроцитолизе.
В процессе деградации гемоглобина образующиеся метаболиты — железо, билирубин, порфирин и трансферрин — подвергаются фагоцитозу печеночными макрофагами.
Прогрессирующая ишемическая дегенерация гепатоцитов обусловливает комплексное нарушение эритропоэтической функции печени, включая дефицит синтеза компонентов эритропоэтина, дисрегуляцию эритропоэза и угнетение регенерации эритроидного ростка на фоне метаболических расстройств. Данная патогенетическая концепция находит непрямое подтверждение в документированных клинических наблюдениях, свидетельствующих о снижении уровня гемоглобина у пациентов с HCV-инфекцией и ВИЧ, хотя механизмы развития анемического синдрома при этих состояниях ранее детально не рассматривались.
Коинфицированные ВИЧ и вирусом гепатита С пациенты характеризуются повышенным риском развития цирротических изменений печени, что обусловлено недостаточной изученностью патогенетических механизмов анемического синдрома и отсутствием научно обоснованных подходов к его коррекции. Необходимость минимизации потенциальных осложнений определяет актуальность проведения высококачественных рандомизированных исследований, направленных на оценку эффективности терапевтических стратегий при анемии у данной категории больных.
4. Заключение
Освобождение токсичного несвязанного гемоглобина в кровоток при разрушении эритроцитов выступает ключевым патогенетическим фактором системного поражения паренхиматозных органов. Индуцированная гипоксически-аноксическая альтерация гепатоцитов инициирует каскад метаболических нарушений: депрессию энергетического обмена, дисрегуляцию эритропоэза вследствие дефицита эритропоэтина, дисфункцию детоксикационных механизмов. Указанные патобиохимические сдвиги манифестируют стеатозом, активацией апоптотических и некротических процессов с последующим развитием цирротической трансформации и онкогенеза как в печени, так и экстрагепатически.
