СТАТИСТИЧЕСКИЙ АНАЛИЗ ПРИ РАСЧЕТАХ ПО КИНЕТИКЕ ХИМИЧЕСКИХ РЕАКЦИЙ
1 ORCID: 0000-0002-4579-0507, Кандидат физико-математических наук,
2 ORCID: 0000-0001-7391-6835, Кандидат геолого-минералогических наук,
1,2 Институт геологии и природопользования Дальневосточного отделения Российской академии наук, Благовещенск, Россия
СТАТИСТИЧЕСКИЙ АНАЛИЗ ПРИ РАСЧЕТАХ ПО КИНЕТИКЕ ХИМИЧЕСКИХ РЕАКЦИЙ
Аннотация
В данной статье для расчетов кинетических параметров химических реакций использовались методы регрессионного и корреляционного анализа. Вопрос о зоне реакции в данной работе решался по минимуму погрешностей аппроксимаций, рассчитанных для четырех параметрических функций: степенного и экспоненциального законов, уравнений Авраами и Праута-Томпкинса. На основе нелинейных регрессионных моделей для каждой из этих функций создана модель обобщенной линейной регрессии, которая позволила разработать программу с использованием трехмерных переменных и развить проверку ряда статистических гипотез, в частности, об адекватности регрессионной модели, о значимости коэффициентов регрессии и о практической значимости регрессионной модели. Проверка этих трех гипотез производится также для уравнения Аррениуса. Результаты расчетов зон реакций сопоставлялись с результатами определения зон реакций по значению энергии активации.
Ключевые слова: константа скорости, диффузионная зона, механизм реакции, нелинейная регрессия, линейная регрессия, обобщенная линейная регрессия, процедура.
Pushkin A.A.1, Rimkevich V.S.2
1 ORCID: 0000-0002-4579-0507, PhD in Physics and Mathematics,
2 ORCID: 0000-0001-7391-6835, PhD in Geology and Mineralogy,
1,2 Institute of Geology and Nature Management of the Far Eastern Branch of the Russian Academy of Sciences, Blagoveshchensk, Russia
STATISTICAL ANALYSIS IN CALCULATION OF KINETICS OF CHEMICAL REACTIONS
Abstract
In this paper, regression and correlation of analysis methods were used to calculate the kinetic parameters of chemical reactions. The problem of the reaction zone in this work was solved by minimizing the errors of the approximations calculated for four parametric functions: power and exponential laws, the equations of Avraham and Prout-Tompkins. On the basis of nonlinear regression models, a generalized linear regression model was created for each of these functions, which allowed developing a program using three-dimensional variables and developing a test of a number of statistical hypotheses, in particular, the adequacy of the regression model, the importance of regression coefficients and the practical significance of the regression model. Verification of these three hypotheses is also carried out for the Arrhenius equation. The results of calculations of the reaction zones were compared with the results of the determination of the reaction zones by the value of the activation energy.
Keywords: rate constant, diffusion zone, reaction mechanism, nonlinear regression, linear regression, generalized linear regression, procedure.
В Институте геологии и природопользования ДВО РАН разрабатываются фторидная и гидрофторидная технологии переработки минерального силикатного и алюмосиликатного сырья. Экспериментальные исследования по кинетике химических реакций предваряются расчетами термодинамических вероятностей их протекания [1], а также требуют математической обработки их результатов [2]. Исследуемые химические реакции обычно гетерофазные, поэтому они протекают в две стадии: химическое взаимодействие частиц и диффузия реагентов к фронту реакции, а также продуктов реакции от него [3]. Если определяющим является процесс химического взаимодействия между частицами, то реакция протекает в кинетической зоне, если диффузия - то в диффузионной зоне [4]. В кинетической зоне зависимость концентрации продуктов от времени протекания описывается степенным законом
![]() (1)
(1)
где ti – i-ый отсчет времени, wi – скорость реакции, Ci – концентрация продукта в момент времени ti, k – константа скорости, m – порядок реакции [5]. Таким образом, имеем систему функций, в которых параметрами являются константы скоростей и порядки реакций.
Степенному закону подчиняется химическое взаимодействие при столкновении частиц. Степенной закон используется в двух формах: первая форма степенного закона является выражением закона действующих масс и используется для вычисления константы скорости и порядка реакции, вторая –выражает зависимость концентрации от времени и используется во всех остальных расчетах.
По экспоненциальному закону распределена вероятность наступления хотя бы одного благоприятного исхода к моменту времени t в пуассоновском процессе, если вероятность неблагоприятного исхода равна ![]() . Под благоприятным исходом здесь следует понимать образование частицы продукта реакции.
. Под благоприятным исходом здесь следует понимать образование частицы продукта реакции.
Уравнение Авраами представляет собой комбинацию степенного и экспоненциального законов. По-видимому, уравнение Авраами может описывать вероятность хотя бы одного благоприятного исхода после m неблагоприятных исходов ![]() . Число m должно быть нечетным, может быть дробным.
. Число m должно быть нечетным, может быть дробным.
Уравнение Праута-Томпкинса представлено в двух формах: одна более удобна для вычисления константы скорости, вторая – в остальных случаях. Уравнение Праута-Томпкинса предлагается в работе [5] для описания процессов, проходящих с индуцированием вторичных активированных комплексов. Это уравнение получается, если предположить, что вероятности гибели первичного активированного комплекса и ответвления с образованием вторичного комплекса пропорциональными числу образовавшихся активированных комплексов. Формально уравнение Праута-Томпкинса представляет собой сумму геометрической прогрессии, знаменатель которой ![]()
![]() . Если рассмотреть первые три члена этого знакопеременного ряда, отбросив члены выше второго порядка малости, то получим вероятность образования хотя бы одной частицы продукта в двух последовательных актах взаимодействия.
. Если рассмотреть первые три члена этого знакопеременного ряда, отбросив члены выше второго порядка малости, то получим вероятность образования хотя бы одной частицы продукта в двух последовательных актах взаимодействия.
Определение зоны реакции обычно происходит по значению энергии активации. В случае если энергия активации меньше 20кДж/моль, зона реакции диффузионная, если энергия активации больше 50кДж/моль, то зона реакции – кинетическая [5].
Определение зоны и механизма реакции в нашей работе осуществляется методами регрессионного анализа. Для каждого из четырех законов создается модель нелинейной регрессии. Далее, путем замены переменных переходим к обобщенной модели линейной регрессии [7]. Коэффициенты этой модели регрессии рассчитываются методом наименьших квадратов. Коэффициенты регрессии позволяют определить все кинетические характеристики гетерофазной химической реакции вместе с их погрешностями. Процесс, который характеризуется минимальной погрешностью аппроксимации, определяет механизм данной реакции, а, следовательно, и зону реакции.
В работе также проводится проверка ряда статистических гипотез, в частности, гипотезы об адекватности моделей регрессий, о значимости коэффициентов регрессий, а также о практической значимости моделей с использованием коэффициента корреляции и показателя согласованности между входными и выходными переменными. Проверка статистических гипотез проводится как для моделей, по которым рассчитываются константы скоростей, так и для модели, по которой рассчитывается энергия активации.
Исходной точкой для расчетов являются данные о зависимости массы образовавшегося вещества от времени для нескольких предварительно выбранных температур.
Для расчета в данной работе используется предположение о том, что физико-химический процесс при каждой исследуемой температуре подчиняется одному из четырех уравнений, указанных выше.
Результатами расчетов являются значения кинетических параметров реакции: констант скоростей, энергий активации, зон протекания и механизмов реакции для каждой из исследуемых температур. Знание значений констант скоростей и энергий активации позволяет сравнить между собой химические реакции, а знание зон и механизмов реакций дает нам понимание физико-химического процесса, который обусловливает протекание данной реакции. Так, например, уравнение, которое выражает механизм реакции при данной температуре с вычисленными значениями констант скоростей или порядков реакции, представляет собой функцию отклика данного процесса, по которой мы можем рассчитать вероятную концентрацию в любой заданный момент времени.
В качестве инструмента исследования в работе используются регрессионный и корреляционный анализы [8]. Поскольку все зависимости (1) – (4), используемые в качестве пробных функций, нелинейны, проводится их линеаризация. Линеаризация осуществляется путем логарифмирования в случае степенного, экспоненциального законов и уравнения Праута-Томпкинса и методом двойного логарифмирования в случае уравнения Авраами. Полученные уравнения парных регрессий нелинейны:
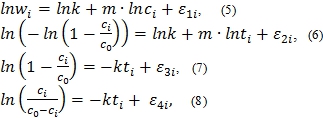
где ![]() – случайные величины с нулевым математическим ожиданием, называемые ошибками эксперимента.
– случайные величины с нулевым математическим ожиданием, называемые ошибками эксперимента.
Расчет энергии активации осуществляется по уравнению Аррениуса для констант скоростей [9]
![]() (9)
(9)
где ![]() – энергия активации реакции, а R – универсальная газовая постоянная.
– энергия активации реакции, а R – универсальная газовая постоянная.
На основе уравнений (5) – (9) строится уравнение обобщенной линейной регрессии, которое имеет вид:
![]() (10)
(10)
Переход к обобщенной линейной регрессионной модели происходит путем замен переменных, которые приведены в таблице 1. Переход к этому уравнению происходит при помощи замен переменных, показанных в таблице 1. Значения коэффициентов регрессии для этого уравнения (10) вычисляются методом наименьших квадратов.
Таблица 1 – Замены переменных при переходе от нелинейных моделей к обобщенной линейной модели

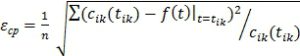 (11)
(11)
где cik(tik) – экспериментальные значения концентраций в моменты времени tik при температуре ![]() – расчетные значения пробной функции для наблюдаемого закона вида (1) - (4) в момент времени tik при температуре Tk и n – число измерений.
– расчетные значения пробной функции для наблюдаемого закона вида (1) - (4) в момент времени tik при температуре Tk и n – число измерений.
Расчет погрешностей констант скоростей и порядков реакций производится в соответствии с работой [10]. Погрешности констант скоростей имеют интервальные оценки и рассчитываются как погрешности коэффициентов регрессии
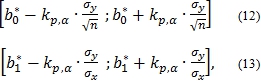
где ![]() - точечные оценки первого и второго коэффициентов регрессии, соответственно, kp,α – критические значения распределения Стьюдента для уровня значимости α и для числа степеней свободы p, σy – среднее квадратическое отклонение переменной y, вычисляемое по формуле
- точечные оценки первого и второго коэффициентов регрессии, соответственно, kp,α – критические значения распределения Стьюдента для уровня значимости α и для числа степеней свободы p, σy – среднее квадратическое отклонение переменной y, вычисляемое по формуле ![]() , где
, где ![]() – среднее значение выходной переменной,
– среднее значение выходной переменной, ![]() .
.
Помимо расчетов кинетических параметров и их погрешностей в работе проводится проверка ряда статистических гипотез регрессионного анализа: гипотезы об адекватности регрессионной модели по критерию Фишера-Снедекора, о значимости коэффициентов регрессии по t-критерию Стьюдента и о точности предсказываемого отклика [11]. Приведем формулы, которые нами использовались для проверок гипотез.
Для проверки гипотезы об адекватности регрессионной модели по Снедекору-Фишеру сравнивается остаточная дисперсия, вычисляемая по формуле
![]() (14)
(14)
где yi – экспериментальные значения выходной переменной, ![]() - значение выходной переменной, рассчитанное по уравнению регрессии; с дисперсией воспроизводимости
- значение выходной переменной, рассчитанное по уравнению регрессии; с дисперсией воспроизводимости ![]()
![]() (15)
(15)
где ![]() – среднее значение выходной переменной y.
– среднее значение выходной переменной y.
Для сравнения рассеивания экспериментальных точек относительно линии регрессии с рассеиванием относительно математического ожидания используется F-отношение Снедекора-Фишера, которое, если ![]() , вычисляется по формуле
, вычисляется по формуле
![]() (16)
(16)
где k1 – число степеней свободы для остаточной дисперсии, k2 – число степеней свободы для дисперсии воспроизводимости. Гипотеза об адекватности не отклоняется, если
![]() (17)
(17)
где ![]() – значение в таблице F-распределения Фишера для уровня значимости α с числами степеней свободы k1 и k2, соответственно. Если
– значение в таблице F-распределения Фишера для уровня значимости α с числами степеней свободы k1 и k2, соответственно. Если ![]() , то в формуле (16) в числителе должна быть
, то в формуле (16) в числителе должна быть ![]() и число степеней свободы k должно представлять собой число степеней свободы для
и число степеней свободы k должно представлять собой число степеней свободы для ![]() , а k2 - для
, а k2 - для ![]() .
.
В качестве нулевой гипотезы принимаем гипотезу H0 о том, что коэффициенты регрессии равны нулю при альтернативной гипотезе H1 о том, что коэффициенты не равны нулю. Проверка осуществляется с использованием t-критерия Стьюдента. Вычисляется статистика t* по формуле
![]() (18)
(18)
где ![]() - точечная оценка i-го коэффициента линейной регрессии,
- точечная оценка i-го коэффициента линейной регрессии, ![]() - точечная оценка среднеквадратического отклонения для i-го коэффициента линейной регрессии.
- точечная оценка среднеквадратического отклонения для i-го коэффициента линейной регрессии.
Расчетное значение статистики t* сравнивается с табличным значением tα с заданным уровнем значимости α. Если
![]() (19)
(19)
то нулевая гипотеза не отклоняется.
Практическая значимость полученной регрессионной модели проверяется с использованием коэффициента корреляции
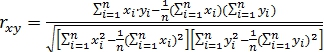 (20)
(20)
где xi и yi – координаты экспериментальных точек.
Если коэффициент корреляции больше 0,7, то это указывает на тесную связь между входными и выходными переменными. Аналогично указывает на тесную связь и математическое неравенство
![]() (22)
(22)
В процессе математической обработки результатов экспериментальных исследований по кинетике гетерофазных химических реакций рассчитывались кинетические характеристики реакций и выявлялись оптимальные условия их протекания. С целью автоматизации математической обработки создавалась расчетная программа Кинетика на языке Visual Basic [12].
Исходными данными в программе являются массивы весов исследуемого реагента Cik, отсчетов времени tik и строка температур Tk, где i – порядковый номер отсчета времени, k – порядковый номер исследуемой температуры (обычно исследования проводятся при трех или четырех температурах). Импорт данных осуществляется из таблицы Excel, подключенной к программе. Ввиду того, что в программе осуществляется статистическая обработка результатов, задается также уровень значимости с использованием ComboBox-поля, в списке которого 8 значений уровня значимости. По выбранному уровню значимости определяются коэффициенты Стьюдента и Снедекора-Фишера из соответствующих таблиц Excel, подключенных к программе [13]. В данной работе расчеты погрешностей проводились на уровне значимости α=0,05.
Веса Cik и времена tik нормированы на максимальные значения веса продукта и продолжительности опыта и в программе обозначены и , соответственно. Для степенного закона введена переменная скорости реакции по формуле Rate(i, j)=Conc_norm(i, j)/Time_norm(i, j).
Введены обобщенные переменные: четырехмерные массивы abscissa(i, j, k) и ordinate(i, j, k), в которых первый индекс означает последовательный номер закона (1, …, 4), второй индекс указывает номер температурного ряда (1, …, 4) и третий индекс – последовательные номера отсчетов времени (1, …, 8). Ниже приведен фрагмент кода, в котором вводятся обобщенные переменные путем задания сечений i =Const:
If i = 1 Then ordinate (i, j, k) = Math.Log (Rate (j, k)): abscissa (i, j, k) = Math.Log (Conc_norm (j, k))
If i = 2 Then ordinate (i, j, k) = Math.Log (-Math.Log (1 - Conc_norm (j, k))): abscissa (i, j, k) = Math.Log (Time_norm (j, k))
If i = 3 Then ordinate (i, j, k) = Math.Log (1 - Conc_norm (j, k)): abscissa (i, j, k) = Time_norm (j, k)
If i = 4 Then ordinate (i, j, k) = Math.Log (Conc_norm (j, k) / (1 - Conc_norm (j, k))): abscissa (i, j, k) = Time_norm (j, k).
Вычисление сумм метода наименьших квадратов (МНК) осуществляется следующим образом:
Sx (i, k) = Sx (i, k) + abscissa (i, j, k)
Sy (i, k) = Sy (i, k) + ordinate (i, j, k)
Sxy (i, k) = Sxy (i, k) + abscissa (i, j, k) * ordinate (i, j, k)
Sx2 (i, k) = Sx2 (i, k) + Math.Pow (abscissa (i, j, k), 2),
где Sx (i, k), Sy (i, k), Sxy (i, k) и Sx2 (i, k) – суммы абсцисс, ординат, произведений абсцисс на ординаты и квадратов абсцисс, соответственно.
Далее в программе по формулам МНК вычисляются значения свободного члена и углового коэффициента в уравнении (10) для каждого из законов и при каждой температуре. Затем по формулам замен переменных в таблице 1 вычисляются кинетические характеристики:
для степенного закона (i=1) и Авраами (i=2), (k= 1, …, 4)
![]() (23)
(23)
Погрешности аппроксимации (εср)i,k вычисляется по формуле (11), а погрешности вычислений коэффициентов (b0)i,k и (b1)i,k вычисляются по формулам (12) - (13). Подстрочные индексы указывают, что данное значение относится к i-ому закону и -ой температуре.
Энергии активации и их погрешности рассчитываются по формуле
![]() , (25)
, (25)
в которой угловой коэффициент рассчитывается по формуле (9), а его погрешность по формуле (13) (подстрочный индекс i указывает, что данный угловой коэффициент относится к i –му закону).
Статистические проверки гипотез проводятся в работе по формулам: гипотезы об адекватности регрессионной модели - по формуле (17), гипотезы о значимости коэффициентов регрессии - по формуле (19) и гипотезы о практической значимости модели регрессии - по формуле (22).
Результаты расчетов констант скоростей, порядков реакции и средних погрешностей аппроксимаций для реакции фторирования каолина Чалганского месторождения Амурской области гидродифторидом аммония приведены в таблице 2, а значения энергий активации для этой же реакции - в таблице 3.
В таблице 4 приводятся данные по определению зоны реакции для каждой температуры с соответствующими характеристиками. Зона реакции определяется по закону, который имеет минимальную погрешность аппроксимации при данной температуре: в 5-ой, 8-ой, 10-ой и 12-ой строках в таблице 2. Так, например, при Т = 50, 100 и 1500С минимальной погрешностью аппроксимации обладает уравнение Авраами, а при Т = 2000С – экспоненциальный закон. В случае уравнения Авраами энергия активации равна 15,4 кДж/моль (строка 3 в таблице 3), а в случае экспоненциального закона – 18,6 кДж/моль (строка 4 в таблице 3). Следует заметить, что энергии активации для двух законов отличаются не сильно и значения констант скоростей монотонно возрастают от 0,003087мин-1 до 0,019338мин-1 (строка 2 в таблице 4). По-видимому, это связано с тем, что порядки реакции в уравнении Авраами, равные 0,74; 0,8; 0,85; 1,13 (строка 7 в таблице 2), близки к 1 при всех температурах, кроме нижней, а из сравнения формул (2) и (3) очевидно, что уравнение Авраами переходит в экспоненциальный закон при порядке реакции m=1.
Адекватность моделей регрессии проверялась при помощи статистики Снедекора-Фишера. Расчет соответствующих статистик для Авраами (строка 6 в таблице 5) и экспоненциального (строка 12 в таблице 5) показывает, что адекватность моделей для обоих законов выполняется при всех температурах, кроме Т = 500С для экспоненциального закона.
Таблица 2 – Константы скоростей и порядки реакций с их погрешностями и погрешностями аппроксимаций для исследуемой реакции
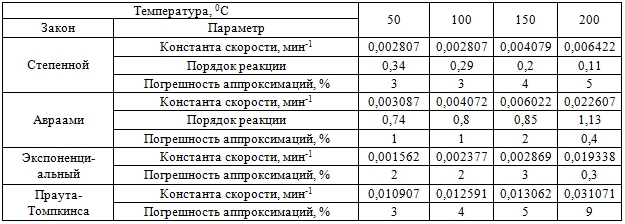
Таблица 3 – Результаты расчетов энергий активаций и их погрешностей
| Закон | Энергия активации, кДж/моль |
| Степенной | 9,0 |
| Авраами | 15,4 |
| Экспоненциальный | 18,6 |
| Праута-Томпкинса | 7,5 |
Таблица 4 – Результаты определения зоны реакции
| Температура, 0С | 50 | 100 | 150 | 200 |
| Константа скорости, мин-1 | 0,003087 | 0,004072 | 0,006022 | 0,019338 |
| Погрешность аппроксимации, % | 1 | 1 | 2 | 0,3 |
| Энергия активации, кДж/моль | 15,4 | 18,6 | ||
| Механизм реакции | Авраами | Экспоненциальный | ||
| Зона реакции | Переходная | Диффузионная | ||
Проверка тесноты связи между входными и выходными переменными выполнялась при помощи расчета коэффициента корреляции и показателя тесноты Стьюдента. Значения коэффициентов корреляции для обоих законов (строки 7 для Авраами и 13 для экспоненциального закона в таблице 5) превышают 0.7, а показатели согласованности Стьюдента (строки 8 и 14, соответственно, в таблице 4) превышают критические значения распределения Стьюдента (строки 2 и 9, соответственно, в таблице 5), что свидетельствует о тесной связи между входными и выходными данными и практической значимости функций отклика.
Статистическая проверка гипотез о значимости коэффициентов регрессии показывает, что значения статистик для свободного члена для уравнения Авраами при всех температурах (строка 3 в таблице 5) меньше соответствующих критических значений распределения Стьюдента (строка 2 в таблице 5) поэтому коэффициенты не являются значимыми. Значения статистик для углового коэффициента (строка 4 в таблице 5) также меньше коэффициента Стьюдента (2,57), но они сравнимы по величине. Статистики для углового коэффициента при экспоненциальном законе (1,85; 2,05; 1,87 и 2,4) также меньше критического значения 2,45, но близки к нему по величине.
Таким образом, в таблице 4 в качестве механизма реакции при трех нижних температурах указывается Авраами, а при верхней температуре – экспоненциальный. Но в таблице 2 представлены результаты отбора только по минимуму средних погрешностей аппроксимаций. Если учесть результаты статистического анализа, то следует заметить, что результаты расчета для константы скорости при Авраами не являются значимыми, на порядок величины меньше критических значений. Поэтому значения порядков реакции, вычисляемые через угловой коэффициент, не изменят ситуацию и, в целом закон Авраами не может описывать физико-химический процесс при всех температурах. В отличие от уравнения Авраами, экспоненциальный закон определяется только константой скорости, которая, в свою очередь, вычисляется через угловой коэффициент. Статистики для углового коэффициента, правда, немного меньше критического значения, но, близки к нему и экспоненциальный закон, по-видимому, может быть использован в качестве предполагаемого механизма реакции. Тогда основным механизмом в данной температурной области следует считать экспоненциальный закон со значениями константы скорости, равными 0,001562; 0,002377; 0,002869 и 0.019338 мин-1 (строка 13 в таблице 2), и со значением энергии активации, равным 18,6 кДж/моль (строка 4 в таблице 3).
Таблица 5 – Результаты статистической проверки трех гипотез регрессионного анализа
| Температура, 0С | 50 | 100 | 150 | 200 | Закон |
| Коэффициент Стьюдента | 2,57 | Авраами | |||
| Статистик для свободного члена | 0,29 | 0,14 | 0,68 | 1,98 | |
| Статистика для углового коэффициента | 2,17 | 2,19 | 2,16 | 2,23 | |
| Коэффициент Фишера | 5,05 | ||||
| Статистика Фишера | 2,04 | 1,69 | 1,29 | 1,3 | |
| Коэффициент корреляции | 0,97 | 0,98 | 0,97 | 0,99 | |
| Показатель согласованности Стьюдента | 8,73 | 11,09 | 8,25 | 30,78 | |
| Коэффициент Стьюдента | 2,45 | Экспоненциальный | |||
| Статистика для углового коэффициента | 1,85 | 2,05 | 1,87 | 2,4 | |
| Коэффициент Фишера | 4,28 | ||||
| Статистика Фишера | 4,42 | 2,09 | 3,12 | 1,59 | |
| Коэффициент корреляции | 0,76 | 0,84 | 0,76 | 0,98 | |
| Показатель согласованности Стьюдента | 2,58 | 3,45 | 2,63 | 10,95 | |
В работе также выполнялась проверка статистических гипотез регрессионного анализа и для энергии активации: уравнения Аррениуса (9). Статистическая проверка, результаты которой приведены в таблице 6, показывает адекватность регрессионной модели, как в случае Авраами, так и в случае экспоненциального закона: статистики Снедекора-Фишера равны 1,58 в первом случае и 1,19 во втором случае (строка 5 в таблице 6). Оба значения меньше коэффициента Снедекора-Фишера 9,28 (строка 4 в таблице 6). Проверка гипотез о значимости коэффициентов регрессии, показывает, что угловой коэффициент как для Авраами, так и для экспоненциального законов, не является значимым: статистики для углового коэффициента равны 1,54 и 1,47, соответственно (строка 3 в таблице 5), что меньше в обоих случаях критической точки распределения Стьюдента (3,18 в строке 2 таблицы 6). Высокие значения коэффициентов корреляции (0,89 и 0,85 в строке 6, в таблице 6) показывают наличие тесной связи между входными и выходными переменными. Правда, показатели согласованности (2,74 и 2,26 в строке 7 таблицы 6) в обоих случаях меньше, чем коэффициент Стьюдента (3,18 в строке 2, в таблице 5), но значения показателей согласованности близки к критическому значению. Незначимость углового коэффициента, по-видимому, связана с малым числом степеней свободы для уравнения Аррениуса р = 3, а также с зависимостью предэкспоненциального множителя в уравнении (9) для энергии активации от температуры.
Таблица 6 – Статистическая проверка гипотез регрессионного анализа для энергии активации
| Законы | Авраами | Экспоненциальный |
| Коэффициент Стьюдента | 3,18 | 3,18 |
| Статистика для углового коэффициента | 1,54 | 1,47 |
| Коэффициент Фишера | 9,28 | 9,28 |
| Статистика Фишера | 1,58 | 1,19 |
| Коэффициент корреляции | 0,89 | 0,85 |
| Показатель согласованности Стьюдента | 2,74 | 2,26 |
Использование замены переменных позволило свести к обобщенной линейной модели регрессии пять нелинейных уравнений, включая степенной и экспоненциальный закон, а также уравнения Авраами, Праута-Томпкинса и Аррениуса. Создание этой модели позволило разработать расчетную программу с использованием трехмерных переменных и позволило в дальнейшем развить статистическое исследование с применением регрессионного и корреляционного анализов. Использование t-критерия Стьюдента в дополнение к погрешности аппроксимации позволило помимо расчета констант скоростей и энергии активации определить зону и механизм реакции (таблица 7). Применение статистического анализа позволяет обобщить результаты расчета, исключить случайности при определении кинетических характеристик исследуемой реакции.
Поскольку зона реакции обычно определяется по значению энергии активации, то сравнивая определенное нами значение энергии активации, равное 18,6 кДж/моль, заметим, что оно меньше 20 кДж/моль. Следовательно, эта методика определения зоны реакции также указывает на то, что основным процессом в данной реакции является диффузия.
Таблица 7 – Кинетические характеристики реакции фторирования каолина гидродифторидом аммония c учетом результатов статистического анализа
| Температура, 0С | 50 | 100 | 150 | 200 |
| Константа скорости, мин-1 | 0,001562 | 0,002377 | 0,002869 | 0,019338 |
| Энергия активации, кДж/моль | 18,6 | |||
| Механизм реакции | Экспоненциальный | |||
| Зона реакции | Диффузионная | |||
Список литературы / References
- Пушкин А.А. Автоматизация расчетов изменений термодинамических потенциалов в ходе химических реакций / Пушкин А.А. Римкевич В.С. // Международный научно-исследовательский журнал. – 2015. – № 6 (37) – Часть 1. – С. 108 – 119.
- Пушкин А.А. Автоматизация расчетов кинетических параметров химических реакций / Пушкин А.А. Римкевич В.С. // Инновационная наука. –2016. – № 2. – В 5 частях. Часть 5. – С. 37-42.
- Бочкарев В.В. Теория химико-технологических процессов органического синтеза. Гетерофазные и гетерогенно-каталитические реакции. Учебное пособие. – Томск: Издательство ТПУ, 2005. – 118 с.
- Евдокимов А.Н. Теория химико-технологических процессов органического синтеза. Ч. 1. Гетерофазные реакции. Учебное пособие. – Санкт-Петербург, 2011. – 64 с.
- Стромберг А.Г. Физическая химия / Стромберг А.Г., Семченко Д.П. // 4-е изд., испр. – М.: Высшая школа, 1999. – 527 с.
- Пушкин А.А. Установление зон гетерофазных реакции / Пушкин А.А. Римкевич В.С. // Международный научно-исследовательский журнал. – № 3(57). – Часть 3. – С. 35-38.
- Балдин К.В. Теория вероятностей и математическая статистика. Учебник. 2-е изд. / Балдин К.В., БашлыковВ.Н., Рукосуев А.В. // М.: Издательско-торговая корпорация «Дашков К0», 2014. – 473 с.
- Гмурман В.Е. Теория вероятностей и математическая статистика: Учеб. пособие для вузов. 8-е изд., стер. – М.: Высш. шк., 2002. – 479 с.
- Киреев В.А. Краткий курс физической химии. – М.: Химия, 1969. – 620 с.
- Колемаев В. А. Теория вероятностей и математическая статистика. Учеб. пособие для экономических специальностей вузов / В.А. Колемаев, С.В.Староверов, В.Б. Турундаевский // – М.: Высшая школа, 1991. – 400 с.
- Феллер В. Введение в теорию вероятностей и её приложения. В 2-х томах. Т.1: Пер. с англ. – М.: Мир, 1984. – 528 с.
- Пушкин А.А. Программа для расчета Кинетики гетерофазных реакций на языке Visual Basic Community 2015 / Пушкин А.А., Римкевич В.С. // Фундаментальные исследования. – 2017. – № 10. – Ч. 3. – С. 518-523.
- Бикел П. Математическая статистика / Бикел П., Доксам К. // Пер. с англ. Ю.А.Данилова. Вып. 2. – М.: Финансы и статистика, 1983. – 254 с.
Список литературы на английском языке / References in English
- Pushkin A. Avtomatizatsiya raschetov izmenenii ter-modinamicheskih potentsialov v hode himicheskih reaktsii [Automatization of calculations of thermodynamic potentials change during chemical reac-tions] / Pushkin A., Rimkevich V.S. // Mezhdunarodny nauchno-issledovatelskii Zhurnal [International research journal]. – 2015. – № 6 (37). Part 1. – P. 108-119. [in Russian]
- Pushkin A. Avtomatizatsiya raschetov kineticheskih parametrov himicheskih reaktsii [Automatization of calculations of kinetic parameters of chemical reactions] / Pushkin A., Rimkevich V.S. // Innovatsionnaya nauka [Innovation science]. – 2016. – № 2. In 5 parts. Part 5. – P. 37-42. [in Russian]
- Bochkarev V. V. Teoriya himiko-tehnologicheskogo sinteza. Heterofaznie I heterogenno-kataliticheskie reaktsii. Uchebnoe posobie [The theory of chemical technological synthesis. Heterophase and heterogeneous catalytic reactions. Tutorial]. – Tomsk: Izdatelstvo TPU [Publisher of TPU], 2005. – 118 p. [in Russian]
- Evdokimov A.N. Teoriya himiko-tehnologicheskih processov organicheskogo sinteza [The theory of chemical-technological processes of organic synthesis]. Part 1. Geterophasnie reaktsii. Uchebnoe posobie [The heterophase reactions. Tutorial]. – Sankt-Peterburg, 2011. – 64 p. [in Russian]
- Stromberg A. G. Fizicheskaya himiya [Physical chemistry] / A.G.Stromberg, D.P.Semchenko // – M.: Vysshaya shkola [High school], 1999. – 528 p. [in Russian]
- Pushkin A. Ustanovlenie zon geterophasnih reaktzii [The determination of heterophase reactions zones] / Pushkin A., Rimkevich V.S. // Mezhdunarodny nauchno-issledovatelskii Zhurnal [International research journal]. – № 3(57). – Part – P. 35-38. [in Russian]
- Baldin K.V. Teoriya veroyatnostei I matematicheskaya statistika [The theory of probabilities and mathematical statistics] / Baldin K.V., Bashlykov V.N., Rukosuev A.V. // Tutorial, 2-nd edition –: Izdatelsko-torgovaya korporatziya «Dashkov & К0» [Publishing and trading Corporation «Dashkov & К0»], 2014. – 473 p. [in Russian]
- Gmurman V.E. Teoriya veroyatnostei I matematicheskaya statistika: Uchebnoe posobie dlya VUZov. [The theory of probabilities and mathematical statistics: Tutorial for Higher Education Institute] 8-th edition, ster.] – M.: Vishaya shkola [High school], 2002. – 479 p. [in Russian]
- Kireev V.A. Kratkii koorse phisicheskoi himii [Short course of physical chemistry]. – M.: Himiya [Chemistry], 1969. – 620 p. [in Russian]
- Kolemaev V.A. Turundaevskii. Teoriya veroyatnostei I matematicheskaya statistika. Uchebnoe posobie dlya ekonomicheskih specialnostei VUZov [The theory of probabilities and mathematical statistics. Tutorial for economic specialties of Higher Education Institute] / V.A. Kolemaev, S.V. Staroverov, V.B. Turundaevski // – M.: Vishaya shkola [High school], 1991. – 400 p. [in Russian]
- Feller V. Vvedenie v teoriyu veroyatnostei i eio prilozheniya V 2-uh chastiyah [Introduction in theory of probability and her applications. In 2 parts]. V. 1: Perevod s angliiskogo [Translation from English]. – M.: Mir [Peace], 1984. – 184 p. [in Russian]
- Pushkin A. Programma dlya rascheta kinetiki geterophasnih reaktzii na yazyke Visual Basic Community 2015 [Program for calculation of heterophase reactions kinetic on Visual basic community 2015] / Pushkin A., Rimkevich V.S // Phoondamentalnie issledovaniya [Phundamental Researches. – 2017. – № 10. – Part 3. – P. 518-523. [in Russian]
- Bikel P. Matematicheskaya statistika [Mathematical statistics] / Bikel P., Doksam K. // Perevod s angliiskogo Yu.A.Danilova. Vipusk 2 [Translation from English of Yu.A.Danilov. Issue 2]. – M.: «Financy I statistika» [Finance and statistics], 1983. – 254 p. [in Russian]
