СНИЖЕНИЕ КОЛИЧЕСТВА ИЗОФОРМЫ В КРЕАТИНФОСФОКИНАЗЫ В МОЗЖЕЧКЕ ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Терешкина Е.Б.1, Савушкина О.К.2, Прохорова Т.А.3, Воробьева Е.А.4, Бокша И.С.5, Бурбаева Г.Ш.6
1кандидат биологических наук, 2ORCID:0000-0002-8629-0445, кандидат биологических наук, 3научный сотрудник, 4 кандидат биологических наук, 5ORCID: 0000-0003-1369-8658, доктор биологических наук, 6 доктор биологических наук, профессор, ФГБНУ «Научный центр психического здоровья»
СНИЖЕНИЕ КОЛИЧЕСТВА ИЗОФОРМЫ В КРЕАТИНФОСФОКИНАЗЫ В МОЗЖЕЧКЕ ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Аннотация
Цель исследования – сравнение количества мозговой изоформы креатинфосфокиназы (КФК B) в мозжечке у больных болезнью Альцгеймера (БА) и в контрольной группе.
Определен уровень иммунореактивной КФК В у больных БА (n=13) и в контрольной группе (n=13) в аутопсийных образцах коры мозжечка. Образцы были подобраны по возрасту, полу и постмортальному интервалу. Количество иммунореактивной КФК В определено методом ЕСL-иммуноблоттинга с использованием моноклональных антител. Достоверное снижение количества иммунореактивной КФК В наблюдалось во фракции водорастворимых белков мозжечка больных БА по сравнению с контролем (p< 0,01). Различий между группами в уровнях иммунореактивной КФК В во фракции мембранных белков мозжечка не выявлено.
Заключение. Значительное снижение количества центрального фермента энергетического метаболизма мозга КФК ВВ свидетельствует о существенном нарушении энергетического обмена в мозжечке при БА и является одним из аспектов нейродегенеративного процесса при БА.
Ключевые слова: креатинфосфокиназа ВВ, моноклональные антитела, ECL-иммуноблоттинг, мозжечок, болезнь Альцгеймера.
Tereshkina E. B.1, Savushkina O. K.2, Prokhorova T. A.3, Vorobyeva E. А.4, Boksha, I. S.5, Burbaeva G. Sh.6
1PhD in Biology, 2ORCID:0000-0002-8629-0445, PhD in Biology, 3Research Scientist, 4 PhD in Biology, 5 ORCID: 0000-0003-1369-8658, PhD in Biology, , 6 PhD in Biology, Professor, Federal State Budgetary Scientific Institution «Mental Health Research Centre»
DECREASED LEVEL OF CREATINE PHOSPHOKINASE B ISOFORM IN CEREBELLUM IN ALZHEIMER'S DISEASE
Abstract
Aim – to compare levels of brain isoform creatine phosphokinase (CPK B) in cerebellum from patients with Alzheimer's disease (AD) and control subjects.
Levels of immunoreactive CPK B were dtermined in autopsied samples of cerebellum cortex from patients with AD (n=13) and controls (n=13). The samples were matched by age, gender and postmortem interval. Amounts of immunoreactive CPK B were determined by ECL-immunoblotting with monoclonal antibodies. Significant decrease in amounts of immunoreactive CPK B was observed in water soluble protein fraction of cerebellum from AD patients in comparison with controls (p<0.01). No differences were revealed between the groups in immunoreactive CPK B levels in membrane protein fraction.
Conclusion. Significant decrease in amount of CPK BB, the central energy metabolism enzyme, suggests a substantial impairment of energy metabolism in cerebellum in AD and represents an aspect of neurodegenerative process in AD.
Keywords: creatine phosphokinase BB, monoclonal antibodies, ECL-Western blotting, human cerebellum, Alzheimer's disease.
Введение. Процессы, лежащие в основе когнитивного функционирования, протекают со значительными затратами энергии, связанными с превращениями макроэргических соединений. Ведущий симптом болезни Альцгеймера (БА) – резкое снижение когнитивных функций вплоть до деменции. Неудивительно, что в протеомных исследованиях аутопсийного мозга больных БА обнаружены изменения уровней экспрессии генов и количества ферментов, вовлеченных в энергетический метаболизм мозга [1], в том числе, креатинфосфокиназы (КФК). КФК - фермент, играющий ключевую роль в энергетическом метаболизме и регулирующий уровень АТФ. КФК катализирует обратимую реакцию фосфорилирования/дефосфорилирования креатина (Кр), сопряженную с превращениями АТФ/АДФ. Для КФК характерна тканеспецифичность и компарментализованность. Особенно высоки концентрации КФК в тканях с большими потребностя,ми в энергии и существенными перепадами в интенсивности ее потребления – в мозге, сердце, мышцах. В мозге человека функционируют две формы КФК: цитоплазматическая (КФК ВВ), обеспечивающая транспортировку макроэргических связей фосфатных групп (в креатинфосфате, КрФ) к местам ее потребления (например, к АТФ-зависимым переносчикам нейромедиаторов) и конверсию КрФ в АТФ, и митохондриальная Мт1, использующая макроэргическую связь АТФ, синтезируемого при окислительном фосфорилировании в митохондриях, для превращения Кр в КрФ и переноса последнего в цитоплазму. Цитоплазматическая форма КФК ВВ обнаружена в большом количестве в астроцитах и олигодендроцитах и в меньшей степени в нейронах, а митохондриальная КФК присутствует в митохондриях всех типов клеток, но самый высокий ее уровень – в нейронах.
Ранее в наших работах при сравнительном исследовании аутопсийного мозга больных БА и контрольной группы было обнаружено снижение как ферментативной активности КФК, так и количества белка КФК ВВ в лобной коре и гиппокампе больных БА [2], а в настоящей работе исследован аутопсийный материал коры мозжечка больных БА и лиц контрольной группы.
Мозжечок – это структура мозга, подвергшаяся существенным эволюционным изменениям у человека по сравнению с другими приматами, при этом эволюция этой структуры сопровождалась приобретением ею значительно большего числа функций, чем предполагалось ранее. Это контроль внимания, эмоции, настроение, познавательные функции, социальное поведение. В связи с этими данными и свидетельствами того, что мозжечок имеет анатомические и функциональные связи с лобной корой, подкорковыми лимбическими структурами и ядрами ствола мозга, он представляет интерес при изучении БА. Участие мозжечка в когнитивном функционировании подробно освещено в обзоре [3]. B последнее время мозжечку все чаще уделяется внимание в нейрохимических исследованиях БА, при этом в мозжечке при БА обнаружено существенное изменение уровня ферментов метаболизма глутамата и ГАМК [4].
Цель настоящего исследования – сравнение уровня мозговой изоформы В КФК в мозжечке больных БА и в контрольной группе. С этой целью определялось количество иммунореативной КФК В в экстрактах коры мозжечка. В отличие от предыдущих исследований, при оценке уровня иммунореактивной изоформы КФК В использовались моноклональные антитела к КФК В, специфичные именно к этой изоформе и не дающие перекрестной реакции с Мт1 КФК. Использование иммуноблоттинга с хемилюминесцентным усилением сигнала (ECL-иммуноблоттинга) позволило провести полуколичественную сравнительную оценку данных об уровнях иммунореактивной изоформы КФК В.
Материалы и методы. Исследование проведено на образцах мозжечка из коллекции аутопсийного мозга, собранной и хранящейся при -80°С в лаборатории нейрохимии НЦПЗ РАМН. В качестве контроля использовались образцы аутопсийного мозга лиц без истории психических и неврологических расстройств из московских больниц (патологоанатомических отделений). Образцы мозга больных были получены из московских психиатрических клинических больниц №1 и №3; клинический диагноз «болезнь Альцгеймера» был подтвержден исследованиями срезов мозга, проведенными в лаборатории клинической нейроморфологии ФГБНУ НЦПЗ: обнаружены многочисленные отложения бета-амилоидного пептида, нейрофибриллярные бляшки и типичная атрофия мозга. Для исследования было отобрано 13 случаев БА и 13 контрольных образцов. Группа контроля и группа случаев БА достоверно не различались по постмортальному интервалу (ПМИ, 4-6 ч) и возрасту (в контрольной группе – 52-81 год, медиана 70 лет, в группе БА – 57-83 года, медиана 72 года). Обе группы были уравнены по числу представителей обоих полов (по 8 женщин и 5 мужчин в каждой), при этом отдельно рассматриваемые подгруппы мужчин и женщин из группы больных БА и контрольной также были уравнены по возрасту и ПМИ. Образцы мозжечка обеих групп хранились в течение сопоставимого времени перед исследованием.
Образцы ткани мозжечка (50 мг) гомогенизировали в гомогенизаторе Potter (стекло/тефлон) в 1мл 50мM TRIS-HCl буфера, pH 7,0, с добавлением 0,35 М сахарозы и коктейля ингибиторов протеаз Sigma P8340-5ml, с последующим центрифугированием при 1000 g и удалением осадка, содержащего ядерные фрагменты и осколки неразрушенных клеток, для дальнейшего анализа использовали полученные супернатант и осадок. Супернатант центрифугировали при 60000 g, 1 ч, 4 °С, к полученному супернатанту (фракция водорастворимых белков) перед электрофорезом добавляли 10%-ный раствор додецилсульфата натрия (SDS, 10% объема) и β-меркаптоэтанол (10% объема). Осадок (фракция белков, ассоциированных с мембранами) ресуспендировали в 100 мкл 50мM TRIS-HCl буфера, pH 7,0, с добавлением 4% SDS, и непосредственно перед электрофорезом добавляли β-меркаптоэтанол (10% объема). Образцы нагревали на кипящей водяной бане 5 мин и проводили 1-мерный электрофорез в ПААГ по Лэммли и последующий ECL-Вестерн-иммуноблоттинг.
Количество иммунореактивной КФК В определяли, используя внутренний стандарт (образец контрольного мозга) [5], с помощью конъюгированных с пероксидазой моноклональных мышиных антител в разведении 1:100000, антитела были получены совместно с сотрудниками лаборатории клинической иммунологии ФГБНУ НЦПЗ. Эти моноклональные антитела специфичны к КФК В и не дают перекрестной реакции с митохондриальной КФК.
Количество иммунореактивной КФК В оценивалось в относительных единицах (отн. ед.) после ECL-Вестерн-иммуноблоттинга, сканирования фотопленок и количественной обработки полученных изображений на установке KОDAK Image Station IS2000R.
Концентрация белка определялась спектрофотометрическим методом Лоури с использованием набора реагентов Bio-Rad DC Protein Assay (США), в соответствии с протоколом и с использованием бычьего сывороточного альбумина в качестве белкового стандарта для калибровки.
Все определения в каждом образце проводились трехкратно.
Для статистической обработки данных использовалась программа Statistica 6.0 (Statsoft), модуль – непараметрический анализ (поиск статистически значимых различий между группами – тест Манна-Уитни, корреляционный анализ – поиск ранговых корреляций и определение коэффициента корреляции Спирмена).
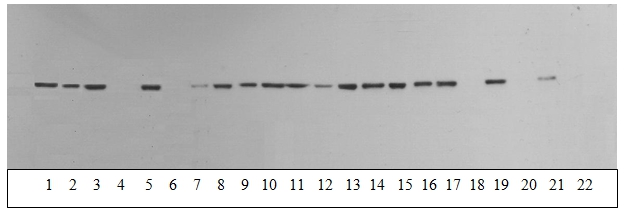
Результаты и обсуждение. На рисунке 1 приведен пример окрашивания ECL-иммуноблоттингом иммунореактивной КФК В во фракции водорастворимых белков мозжечка. Как видно из рисунка, интенсивность окрашивания зоны, соответствующей КФК В, во фракции водорастворимых белков в контрольных случаях значительно выше (нечетные дорожки), чем у больных БА (четные дорожки) (p<0,01).
Рисунок 1. Картина окраски иммунореактивной КФК В (фракции водорастворимых белков мозжечка) у лиц контрольной группы — нечетные дорожки и больных БА — четные дорожки.
Одной из причин снижения уровня изоформы В КФК во фракции водорастворимых белков мозга больных БА может быть перераспределение этого фермента между субклеточными фракциями. Однако анализ уровня иммунореактивной КФК В во фракции мембранных белков не показал различий между контрольными случаями и образцами от больных БА.
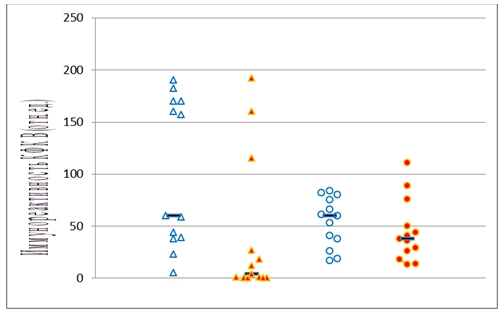
На диаграмме (рис. 2) представлены результаты определения количества иммунореактивной КФК В (в отн. ед.) в образцах мозжечка больных БА и контрольной группы.
Как показал U-тест Манна-Уитни, в водорастворимой белковой фракции мозжечка количество иммунореактивной КФК В было значительно снижено у больных БА по сравнению с контрольной группой (р = 0,006) (Рис. 2), а в мембранной белковой фракции мозжечка количество иммунореактивной КФК В у больных БА и в контрольной группе достоверно не различалось (р = 0,280) (Рис. 2).
Рисунок 2. Количество иммунореактивной КФК В в образцах мозжечка контрольной группы (синие символы) и группы больных БА (красные символы), оцененное ECL-Вестерн-иммуноблоттингом: треугольники – фракция водорастворимых белков, кружки – фракция мембранных белков.
Таким образом, обнаружено значительное снижение уровня иммунореактивной КФК В во фракции водорастворимых белков мозжечка больных БА по сравнению с контролем, что могло быть обусловлено рядом причин. Одной из этих причин мог быть аутолиз. Однако, проведенные нами эксперименты показали незначительное влияние ПМИ на активность КФК в первые 18-20 ч после смерти. Тем не менее, чтобы исключить возможные артефакты, возникающие вследствие аутолиза, группа больных и контрольная группы были уравнены по ПМИ. Различия между группами в количестве иммунореактивной КФК В, вероятно, обусловлены именно патологией (БА), поскольку группы (БА и контрольная) были уравнены по возрасту, ПМИ и количеству представителей обоих полов.
Кроме того, было показано, что количество КФК В в образцах от мужчин (n=16) и женщин (n=10) не различалось (U-тест Манна Уитни показал p=0,66 и p=0,18 для водорастворимой и ассоциированной с мембранами белковых фракций, соответственно).
Заключение. Значительное снижение количества центрального фермента энергетического метаболизма мозга КФК ВВ свидетельствует о существенном нарушении энергетического обмена в мозжечке при БА, что, по-видимому, вносит вклад в нейродегенеративный процесс при БА.
Литература
- Zahid S., Oellerich M., Asif A.R., Ahmed N. Differential expression of proteins in brain regions of Alzheimer's disease patients. // Neurochem Res.- 2014.- Vol.39, №1, Р. 208-215. doi: 10.1007/s11064-013-1210-1.
- Burbaeva G.Sh., Savushkina O.K., Boksha I.S. Comparative study of creatine kinase BB decrease in brain of patients with Alzheimer’s disease and schizophrenia. // NATO Science Series, IOS Press; Netherlands.- 2003.- Р. 125-132.
- Diamond A. Close interrelation of motor development and cognitive development and of the cerebellum and prefrontal cortex. // Child Dev.- 2000.- Vol. 71, № 1, P. 44-56.
- Burbaeva G.Sh., Boksha I.S., Tereshkina E.B., Savushkina O.K., Prokhorova T.A., Vorobyeva E.A. Glutamate and GABA-metabolizing enzymes in cerebellum in Alzheimer's disease: Phosphate-activated glutaminase and glutamic acid decarboxylase. // Cerebellum, 2014, Vol.13, N3, P.607-615. doi: 10.1007/s12311-014-0573-4.
- Burbaeva G.Sh., Boksha I.S., Tereshkina E.B., Savushkina O.K., Starodubtseva L.I., Turishcheva M.S. Glutamate metabolizing enzymes in prefrontal cortex of Alzheimer’s disease patients. // Neurochemical Res.- 2005.- Vol. 30, №11, Р.1443-1451. DOI: 10.1007/s11064-005-8654-x.