ЭНДОВАСКУЛЯРНЫЕ МЕТОДЫ В ЛЕЧЕНИИ КРОВОТЕЧЕНИЙ У БОЛЬНЫХ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Абидов Э.А. оглы
Младший научный сотрудник ГУ «Институт общей и неотложной хирургии им. В.Т. Зайцева НАМНУ», г. Харьков.
ЭНДОВАСКУЛЯРНЫЕ МЕТОДЫ В ЛЕЧЕНИИ КРОВОТЕЧЕНИЙ У БОЛЬНЫХ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Аннотация
За период с 2009 по 2013 гг. рентгенэндоваскулярное лечение выполнили 7 больным раком поджелудочной железы, течение основного заболевания осложнилось кровотечением. Всем пациентам произведена рентгенэндоваскулярная окклюзия (РЭО) кровоточащего сосуда.
Рецидив кровотечения наблюдался у 4 больных, 1 выполнено повторное рентгенэндоваскулярное лечение.
Ключевые слова: рак поджелудочной железы, кровотечение, рентгенэндоваскулярное лечение.
Abidov E.A. ogli
Junior research fellow."V.T. Zaitcev Institute of General and Urgent Surgery NAMS of Ukraine", Kharkiv.
INTERVENTIONAL ENDOVASCULAR TECHNIQUES IN THE TREATMENT OF PANCREATIC CANCER HEMORRHAGE
Abstract
For the period from 2009 to 2013 interventional treatment performed in 7 patients with pancreatic cancer, course of the basic disease complicated by the bleeding.
Recurrence of bleeding was observed in 4 patients, 1 rescheduled interventional treatment.
Keywords: pancreatic cancer, hemorrhage, embolization.
Введение: Актуальной проблемой в ургентной абдоминальной хиругии и по сей день остается лечение больных у которых рак поджелудочной железы осложнился внутрибрюшным кровотечением. Так, у больных раком поджелудочной железы кровотечение часто является первым признаком имеющегося заболевания, который одновременно свидетельствует о крайней запущенности заболевания и в большинстве случаев – об инкурабельности процесса [1,2]. Следствием запоздалой диагностики является низкий процент радикальных операций, не превышающий 25-30%, и высокая послеоперационная летальность, которая нередко достигает 25% [3,4]. Частота кровотечений колеблется от 4,5 до 23 % от всех заболевших раком поджелудочной железы. Кровотечение возникает в результате распада или изъязвления опухоли или разрыва кровеносного сосуда, пораженного опухолью. В других случаях деструкция опухоли и развитие гнойного и воспалительного процессов ведут к тромбированию и аррозии питающих ее сосудов, что в свою очередь является причиной гангрены значительных участков опухоли и ее распада, сопровождающегося кровотечением [4,5].
Снижению числа послеоперационных осложнений и летальности при выполнении полостных операций способствовало широкое внедрение в клиническую практику вмешательств, направленных на остановку кровотечения [4, 5, 6.].
В последние годы, благодаря развитию рентгенохирургических технологий стало возможным непосредственно воздействовать на очаг кровотечения путем проведения внутриартериальной эмболизации сосудов панкреатобилиарной зоны.
Целью исследования являлась оценка эффективности рентгенохирургического лечения внутрибрюшного кровотечения у больных раком поджелудочной железы.
Материалы и методы. Под наблюдением находились 7 больных, которые поступили в ГУ «ИОНХ им. В.Т. Зайцева НАМНУ» с 2009 по 2013 годы по поводу рака поджелудочной железы. У всех больных основное заболевание сопровождалась кровотечением из опухолевых сосудов поджелудочной железы. Мужчин было 5, женщин – 2 в возрасте от 56 до 83 лет. Первым этапом пациентам проводилась диагностическая ангиография для выявления очага кровотечения. Вторым этапом больным выполнялась эмболизация кровоточащих сосудов.
Ренгенохирургические процедуры.
Методика селективной ангиографии
Селективную ангиографию выполняли чрезбедренным доступом по методике Сельдингера (1953). Больного укладывали на спину на специальный стол с несколько отведенной ногой (правой или левой) в сторону. Предварительно выбритую паховую область смазывали йодом, а затем изолировали стерильными простынями так, чтобы со стороны ног приготовить широкую стерильную площадку для проводника и диагностического катетера. Левой рукой прощупывали пульсацию бедренной артерии сразу ниже пупартовой связки и фиксировали артерию между указательным и средним пальцами. Иглой для внутримышечных инъекций делали анестезию кожи и подкожной клетчатки 40,0-60,0 мл 0,25-0,5% раствора новокаина так, чтобы не потерять пульсацию артерии.
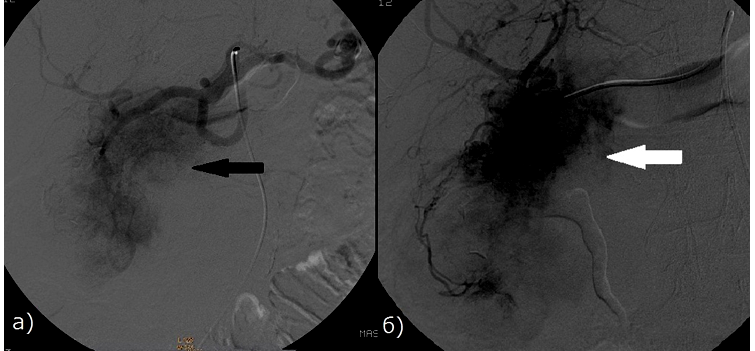
Рис. 1 - Больная раком ПЖ, 79 лет. Определяется экстравазация контрастного вещества (стрелка). а) Целиакография.
б) Ангиография гастродуоденальной артерии
Выждав несколько минут, делали узкую насечку кожи остроконечным скальпелем. Иглой для пункций, расположенной под углом 30° – 45° к поверхности кожи и ориентируясь на пульсацию бедренной артерии, через кожу пунктировали стенку артерии. Если была проколота одна стенка, то из иглы поступала пульсирующая струя крови. В случае если были проколоты две стенки артерии, иглу медленно подтягивали назад. Появление сильной пульсирующей струи крови указывало на правильное положение конца иглы в просвете артерии. В сосуд по игле вводили проводник, мягкий конец которого продвигали на 15 – 20 см в центральном направлении под пупартовую связку. Иглу удаляли, а проводник фиксировали в сосуде через кожу указательным и средним пальцем левой руки. На проводник нанизывали диагностический катетер и легким винтообразным движением вводили его в просвет бедренной артерии. Затем проводник из катетера извлекали, а сам катетер, без какого-либо усилия, продвигали под контролем рентгентелевидения по направлению к брюшной аорте до необходимого уровня. Далее по проводнику проводили диагностический катетер для селективной ангиографии, использовали катетеры типа “пастушьей клюшки” и “шляпы охотника” (“Shepherd Crook” и “Head Hunter”) фирмы “Сооk” (США) и “Angiomed” (Германия) с наружным диаметром катетера 5-4 F (1F = 0,3 мм) и внутренним просветом под проводник 0,035-0,038 inch фирмы “Cook” и “Cordis” (США).
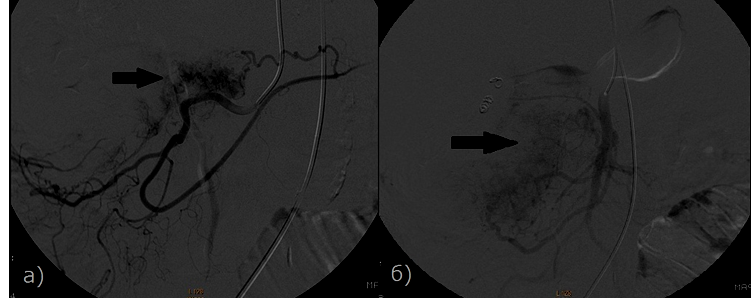
Рис. 2 - Больная раком ПЖ, 79 лет. Определяется экстравазация контрастного вещества (стрелка) а) Ветвь верхней брыжеечной артерии. б) Верхняя брыжечная артерия
С целью профилактики спазма перед началом манипуляций внутриартериально вводили спазмолитики или обезболивающие препараты.
По мнению большинства исследователей, для оптимального контрастирования всего бассейна чревного ствола необходимо ввести 40-45 мл 76% раствора контрастного вещества со скоростью 8-12 мл/сек. В режиме реального времени полученное ангиографическое изображение изучалось на предмет сосудистых аномалий и участков экстравазаций контрастного вещества (ангиографического признака кровотечения).
Методика РЭО
После селективной ангиографии, и выявления источника кровотечения пациентам произвели окклюзию аррозивного сосуда. Для РЭО использовались металлические спирали Гиантурко и синтетические эмболы из пенополиуретана с диаметром частиц от 1,5 до 3 мм. Во время выполнения РЭО проводили постоянный рентгентелевизионный контроль состояния приводящего сосуда. При появлении рефлюкса контрастного вещества или достижения окклюзии артерии дальнейшее введение эмболов и спиралей прекращали.
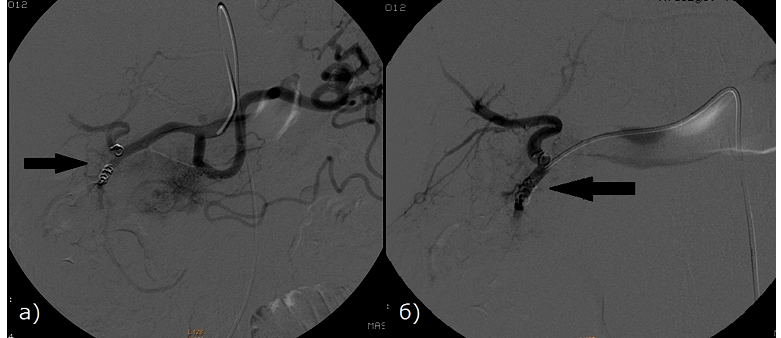
Рис. 3 - Больная раком ПЖ, 79 лет. Произведено РЭО а) Контрольная целиакография б) Контрольная ангиография гастродуоденальной артерии
Результаты: Технический успех РЭО достигнут у всех пациентов. Следует отметить, что у 5 больных РЭО выполнена в качестве самостоятельного лечения, у 2 с целью подготовки больного к полостной операции (1 этап). В ближайшем постоперационном (7 дней после РЭО) периоде у 57,1% больных отмечен рецидив кровотечения. 1 пациенту произведено повторное РЭО, 42,8% применялась консервативная терапия. Пациентам после РЭО назначались антибиотики широкого спектра действия для профилактики инфекционных осложнений и обезболивающие препараты. Осложнений после рентгенэндоваскулярного лечения потребовавших проведение экстренной хирургической операции, в данной группе не отмечено
Обсуждение: Рентгенохирургические вмешательства направленные на выявление и остановку кровотечения при кистах поджелудочной железы, являются методом выбора в комплексе с хирургическим лечением, либо в виде самостоятельного лечения [4,5.]. Большинство публикаций показывает необходимость проведения рентгенэндоваскулярного гемостаза, для снижения кровопотери открывающая возможность выполнения оперативных вмешательств, что позволяет достичь лучших результатов [6.].
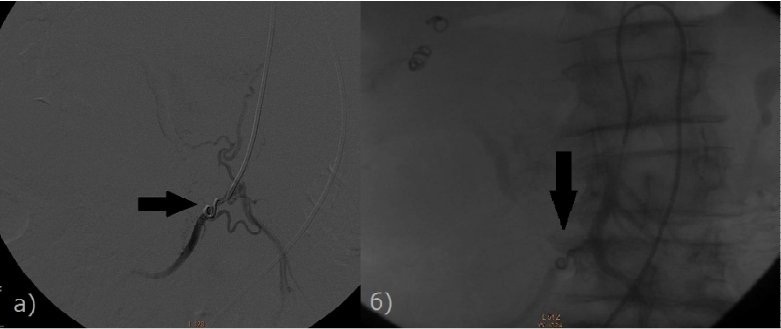
Рис. 4 - Больная раком ПЖ, 79 лет. Произведено РЭО а), б) Контрольная ангиография верхней брыжеечной артерии
Проведенное исследование подтвердило эффективность и безопасность этой методики. У всех пациентов был достигнут стойкий гемостатический эффект. По данным современной литературы РЭО является относительно безопасной процедурой [4, 5, 7.]. Не наблюдалось смертности и тяжелых осложнений после выполнения РЭО, что связано с использованием малотравматичной техники рентгенэндоваскулярных вмешательств.
Выводы. Таким образом, данное исследование показало, что рентгенохирургические методы являются альтернативным и безопасным способом остановки кровотечений у пациентов с кистами поджелудочной железы. РЭО позволяет быстро остановить кровопотерю и произвести в последующем хирургическое лечение.
Список литературы
Collins GS, Altman DG. Identifying patients with undetected pancreatic cancer in primary care: an independent and external validation of QCancer(®) (Pancreas). Br J Gen Pract. 2013 Sep;63(614):636-42.
Ilic M, Vlajinac H, Marinkovic J, Kocev N. Pancreatic cancer mortality in Serbia from 1991-2010 - a joinpoint analysis. Croat Med J. 2013 Aug 28;54(4):369-75.
Albert B. Lowenfels MD,Thomas Sullivan BS, John Fiorianti MD, Patrick Maisonneuve MS 3. The epidemiology and impact of pancreatic diseases in the United States. Current Gastroenterology Reports 2005, Volume 7, Issue 2, pp 90-95.
Gönüllü NN, Cantürk NZ, Utkan NZ, Yidirir C, Dülger M. Factors affecting surgical mortality and morbidity in patients with obstructive jaundice. Mater Med Pol. 1998 Jan-Jun;30(1-2):6-11.
Brown DB, Narayanan G. Interventional radiology and the pancreatic cancer patient. Cancer J. 2012 Nov-Dec;18(6):591-601.
Huang ZM, Pan CC, Wu PH, Zhao M, Li W, Huang ZL, Yi RY. Efficacy of minimally invasive therapies on unresectable pancreatic cancer. Chin J Cancer. 2013 Jun;32(6):334-41.
