ДЕЙСТВИЕ ПРОТИВОТУБЕРКУЛЕЗНЫХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ НА ТЕЧЕНИЕ ТУБЕРКУЛЕЗА В ЭКСПЕРИМЕНТЕ НА МЫШАХ
Авдиенко В.Г.1, Майоров К.Б.2, Бабаян С.С.2, Бочарова И.В.2, Онян А.В.3
1ORCID: 0000-0002-1991-9549, Кандидат медицинских наук, 2Кандидат биологических наук, 3Младший научный сотрудник, ФГБНУ "Центральный научно-исследовательский институт туберкулеза", г. Москва
Работа выполнена при поддержке гранта РФФИ №14-04-01043
ДЕЙСТВИЕ ПРОТИВОТУБЕРКУЛЕЗНЫХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ НА ТЕЧЕНИЕ ТУБЕРКУЛЕЗА В ЭКСПЕРИМЕНТЕ НА МЫШАХ
Аннотация
Представлены экспериментальные данные по поиску противотуберкулезных моноклональных антител (МАТ), действующих на рост живых вирулентных микобактерий при экспериментальном туберкулезе in vivo. Исследованы 4 МАТ, направленные против известных антигенов 19кДа (LpqH), 20-23кДа (MPT83) и 38кДа (PstS1). С помощью этих МАТ проводили терапию зараженных M.tuberculosis H37Rv мышей. Статистически значимые результаты воздействия МАТ против LpqH и 38кДа на микобактерии наблюдали на сроках 3 недели, на протяжении которых проводили иммунотерапию МАТ. На более поздних сроках 6-7 недель разница с контрольной группой в высеве микобактерий из легких и селезенки исчезала. Авторы полагают, что исследуемые МАТ, способны оказывать терапевтический эффект на M. tuberculosis при достаточных концентрациях в организме хозяина в начале инфекции.
Ключевые слова: экспериментальный туберкулез, моноклональные антитела, микобактерии.Avdienko V.G.1, Majorov K.B.2, Babayan S.S.2, Bocharova I.V.2, Onyan A.V.3
1ORCID: 0000-0002-1991-9549, MD, 2PhD in Biology, 3Staff scientist, Federal State Budgetary Scientific Institution «Central Tuberculosis Research Institute», Moscow
EFFECT OF ANTIMYCOBACTERIAL MONOCLONAL ANTIBODIES ON EXPERIMENTAL TUBERCULOSIS IN MICE
Abstract
The experimental data on the searching of TB monoclonal antibodies are present, which has an effect on the growth of live virulent mycobacteria in experimental tuberculosis in vivo. The four monoclonal antibodies (mAbs) to known mycobacterial antigens 19kDa (LpqH), 20-23kDa (MPT83) и 38kDa (PstS-1) were researched. Using these antibodies passed therapy of M.tuberculosis H37Rv infected mice. Statistically significant data of exposure of mAbs (to 19kDa and to 38kDa) on mycobacteria were observed on 3 weeks of infection, in during therapy. On 6-7 weeks of infection differences with control group in plated from lungs and spleens was disappeared. The authors suggest that the tested antibodies are capable of providing therapeutic effect on M. tuberculosis in sufficient concentrations in the host in the early infection.
Keywords: experimental tuberculosis, monoclonal antibodies, mycobacteria.Введение.
Известно, что при туберкулезе клеточный иммунитет играет важную роль, но при этом значение гуморального иммунитета по-прежнему остается невыясненным [1]. Большинство наблюдений, связанных с антителами у больных туберкулезом противоречиво. Так, комплемент - зависимая цитотоксическая опсонизация антителами не действует на выживание микобактерий [15], высокие титры противотуберкулезных антител коррелируют с тяжестью заболевания [13] и пассивный перенос антител не всегда дает желаемую защиту [2, 14]. У больных латентным и активным туберкулезом разное гликозилирование антител приводит к различному связыванию с Fc-gамма-RIII рецептором и как результат дает разные образцы фаголизосомального созревания и активации и по-разному приводит к киллингу зараженных макрофагов [8].
Между тем контакт антител с микобактериями возможен только после гибели макрофага, во время короткой экстрацеллюлярной фазы, когда происходит диссеминация возбудителя в межтканевой жидкости и заражение интактных клеток хозяина [5]. Именно во время этой фазы многими авторами описано действие МАТ на течение экспериментального туберкулеза [10, 14].
Целью этого исследования было изучить терапевтическое действие противотуберкулезных МАТ при экспериментальном туберкулезе у мышей.
Материал и методы.
В исследовании были использованы моноклональные антитела 2E11(IgG2a, k) и 1E5(IgG2b, k), реагирующие с антигеном 19кДа (LpqH), 2G11(IgG2b, k) и 1C10G10(IgG1, k) направленные против антигена 20-23кДа (MPT83), 2B1A3(IgG1, l) и 1F2A7(IgG2a, l) против 38кДа (PstS-1). Они были получены методом гибридомной технологии, их специфичность лежала в пределах M.tuberculosis complex. Для проведения экспериментов, чтобы исключить любые побочные эффекты действия других антител, гибридомы МАТ были выращены in vitro в культуральной среде, содержащей аффинноочищенную на белкaх A и G фетальную сыворотку, не содержащую иных иммуноглобулинов. Для очистки фетальной сыворотки и МАТ из супернатантов культуральных жидкостей использовали иммуноаффинную хроматографию на колонках с сефарозой, ковалентно-сшитой с белком A, G или L в FPLC (Pharmacia, Швеция). Эффлюаты МАТ диализовали против физраствора забуференного фосфатами (PBS), концентрировали ультрафильтрацией, а после диализа стерилизовали через фильтры 0,2mm и аликвотировали, без добавления каких-либо консервантов. Очищенную фетальную сыворотку также стерилизовали и замораживали при -20оС до использования.
В экспериментах применяли культуру M.tuberculosis H37Rv из коллекции ФГБНУ «ЦНИИ туберкулеза», Москва. Микобактерии в аликвотах хранили при температуре -80оС. Для получения бактерий в log-фазе, культуру выращивали в бульоне Дюбо в течение 14 дней при 37оС. Отмывали в PBS c 0,05% Tween80 и ресуспендировали в среде, применяемой в конкретном эксперименте, и фильтровали через стерильный фильтр с размером пор 4 мкм для удаления агломератов. Далее определяли концентрацию микобактерий в полученном фильтрате по КОЕ.
Для модели экспериментального туберкулеза использовали мышей линии BALB/c в возрасте 4-6 недель, выращенных в виварии ФГБНУ «ЦНИИ туберкулеза». Заражение проводили аэрозольно в камере (Glas-Col, США) за 45 мин дозой 70млн КОЕ, что приводило к инокулируемой дозе 500-800КОЕ на легкое через 24 часа. В каждой исследуемой и контрольной группе было по 4-6 животных [9].
Терапию проводили по следующей схеме: 0,3-0,5 мг/мл МАТ вводили внутрибрюшинно за час до заражения, на 3 третий день инфицирования, 10 день и 17 день. На 21 день инфекции, животных декапитировали методом цервикальной дислокации, стерильно извлекали легкие и селезенку. Из полученных органов в среде Версена готовили гомогенаты и рассевали в разведениях от 1/10 до 1/1000000 на чашки Петри с плотной средой (агар приготовленный на среде Дюбо). Через три недели в чашках Петри подсчитывали колонии и определяли концентрацию возбудителя в органах по стандартной методике [9], достоверность различий между опытной и контрольной группой рассчитывали с помощью критерия Манна-Уитни.
Наличие в гомогенатах органов специфических МАТ, использованных для терапии животных, оценивали в двусайтовом иммуноферментном анализе. Для этого брали парные МАТ: против 19кДа (LpqH) -2E11/1E5, 20-23кДа (MPT83) - 2G11/1C10G10 и 38кДа (Pst1) - 1F2A7/2B1A3. Кратко о методике, МАТ 2E11, 1E5, 1C10G10 и 1F2A7 в PBS наносили на поверхность планшетов для ИФА, инкубировали в течение ночи, далее добавляли ультразвуковой дезинтеграт M. tuberculosis H37Rv, после инкубации наносили исследуемые гомогенаты, а для калибровки использовали МАТ с известными концентрациями. Детекцию связанных в тройной комплекс МАТ-АГ-МАТ проводили с помощью иммунопероксидазных конъюгатов против разных изотипов мыши. Реакцию проявляли с помощью ТМБ, и спектрофотометрировали при 450нм и определяли концентрацию в исследуемых образцах по стандартам МАТ. Достоверность различий подсчитывали с помощью критерия Манна-Уитни.
Результаты.
Данные по высеваемости микобактерий из легких и селезенки, опытных и контрольных групп зараженных животных на 3 и 7 неделе сведены в таблицу 1.
Таблица 1 - КОЕ в легких и селезенке зараженных BALB/c в опытных и контрольных группах
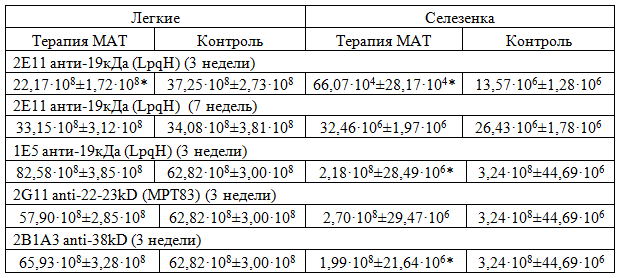
Примечание: *- различия с контрольной группой достоверны с p<0,01.
Как видно из приведенной таблицы достоверная разница между КОЕ в органах животных наблюдалась для МАТ против 19кДа и 38кДа на сроках 3 недели. На более поздних сроках различия между группами исчезали. В целом тенденцию к более низким значениям КОЕ в сравнении с контрольной группой наблюдали во всех исследуемых группах, получавших терапию МАТ, в высевах из селезенок зараженных мышей.
Присутствие исследуемых МАТ в гомогенатах органов изучали в количественном двусайтовом иммуноферментном анализе, позволяющем оценить содержание вводимых животным антител (Таблица 2).
Таблица 2 - Концентрация исследуемых МАТ в гомогенатах органов зараженных животных (мкг/мл)
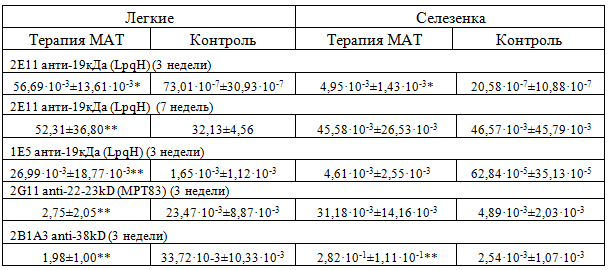
Примечание: *- различия с контрольной группой достоверны с p<0,01;**- различия с контрольной группой достоверны p<0,05.
Средние значения концентраций МАТ в группах мышей, получавших терапию, были везде выше в сравнении с контрольной группой, подтверждая наличие в межтканевой жидкости исследуемых антител. Однако, через 7 недель после заражения, мыши вырабатывали собственные антитела со специфичностью сходной с МАТ 2E11, что заметно в гомогенатах как легкого, так и селезенки.
Обсуждение.
Для исследования были взяты МАТ против известных липопротеинов микобактерий.
Так микобактериальный липогликопротеин 19 kDa (LpqH) входит как в состав клеточной стенки, так секретируется. Кроме того он есть в составе экзосом (мембранных везикул), активно вырабатываемых вирулентными микобактериями. Экзосомы содержат почти все микобактериальные белки и многие липиды, в том числе LpqH, большинство из них является агонистами TLR2. Введение микобактериальных экзосом в легкие мышей приводит к ярко выраженному воспалению у мышей дикого типа, но отсутствующее у TLR2-дефицитных животных. Предварительное введение экзосом перед заражением животных Mycobacterium tuberculosis в легкие приводило к выраженным очагам воспаления, при этом в легких и селезенке повышалась высеваемость микобактерий [11]. Кроме этого, липопротеин LpqH индуцирует апоптоз макрофагов как каспаза-зависимый (активация TLR2), так и каспаза-независимый (включение митохондриального апоптоз индуцирующего фактора [12].
Липогликопротеин MPT/MPB-83 присутствует в клеточной стенке и культуральных фильтратах M. tuberculosis и M. bovis и является агонистом TLR2. Так МАТ против MPB83, связывались с поверхностью M. bovis и повышали время выживания мышей, зараженных высокими дозами M.bovis, при этом изменялась морфология гранулем и распространение бацилл в легких, явно модулируя вирулентность in vivo. MPB83 индуцировал in vivo экспрессию металлопротеиназы 9 через взаимодействие с TLR2 и TLR1, но не TLR4 в макрофагах человека, т.е. MPB83 можно рассматривать как фактор вирулентности микобактерий [4].
Антиген 38кДа (PstS-1) – известный фосфатсвязывающий белок микобактерий, входящий в состав ABC-транспортера клеточной стенки микобактерий [3]. Этот антиген вызывает сильный специфический антительный ответ на самых ранних этапах заболевания туберкулезом у человека [6]. В интратрахеальной модели экспериментального туберкулеза с терапией МАТ против 16кДа (TBA61, IgG) и 38кДа (TBA84, IgA) на 21 день инфекции было обнаружено снижение роста микобактерий и небольшие морфометрические и гистопатологические изменения в легких мышей, обработанных МАТ[7].
Заключение.
Таким образом, из полученных данных видно, что различия между контрольными группами и опытными при обработке мышей МАТ присутствуют на ранних этапах инфекции - 3 недели и нивелируются к 7 неделе. Это указывает на то, что МАТ оказывают ингибирующее действие на микобактерии только в случае их присутствия в организме до и во время контакта с инфектом. То, что к третьей неделе достоверные различия видны при сравнении с контролем в высевах из селезенки, указывает на то, что присутствие МАТ значимо снижает диссеминацию микобактерий внутри организма.
Более того, можно говорить о наличии тенденции в снижении числа высеваемых микобактерий не только в селезенке, но и в легких инфицированных мышей, получавших МАТ, формально средние значения в опытных группах выше, чем в контрольных.
Следует обратить внимание на то, что возможное снижение высева микобактерий из органов зараженных мышей зависит от эпитопа распознаваемого МАТ на микобактериальном антигене. В случае МАТ (анти-19кДа) 2E11 наблюдается более выраженное действие на возбудителя – достоверные различия в высеве на 3 неделе и из легких и селезенки, в сравнении с действием МАТ (также анти-19кДа) 1E5, где достоверная картина наблюдается только в высевах из селезенки. Аналогичные выводы можно сделать при сравнении высевов из селезенки для всех исследуемых МАТ. Так МАТ против 20-23кДа (MPT83), оказывают меньшее влияние на микобактерии, в сравнении с МАТ против антигенов 19кДа и 38кДа, что, вероятно, может указывать на разную степень участия этих антигенов в репликации и распространении микобактерий.
Таким образом, действие антител на микобактерии при туберкулезе становится актуальным только внутри организма in vivo, при непосредственном контакте с возбудителем или его антигенами в самом начале заболевания.
Список литературы / References
- AchkarM., Chan J., Casadevall A. B cells and antibodies in the defense against Mycobacterium tuberculosis infection /J.M. Achkar, J.Chan, A. Casadevall //Immunol Rev. – 2015 - Vol. 264(1). - P.167-181.
- Balu S., Reljic R., Lewis M.J., Pleass R.J., McIntosh R., van Kooten C., van Egmond M., Challacombe S., Woof J.M., and Ivanyi, J. A novel human IgA monoclonal antibody protects against tuberculosis / S. Balu, R. Reljic, M.J. Lewis, etal. //J. Immunol. – 2011. – Vol. 186. – P. 3113–3119.
- Braibant M.M., Gilot J.P. The ATP binding cassette (ABC) transport systems of Mycobacterium tuberculosis / M.M. Braibant, J.P. Gilot //FEMS Microbiology Reviews. – 2000. – Vol. 24. – P. 449-467.
- Chambers MA, Gavier-Widen D, Hewinson RG. Antibody bound to the surface antigen MPB83 of Mycobacterium bovis enhances survival against high dose and low dose challenge./ M.A. Chambers, D. Gavier-Widen, R.G. Hewinson //FEMS Immunol Med Microbiol. – 2004. –Vol. 41. –P.93-100.
- Driver ER, Ryan GJ,Hoff DR, Irwin SM, Basaraba RJ, Kramnik I, Lenaerts AJ. Evaluation of a mouse model of necrotic granuloma formation using C3HeB/FeJ mice for testing of drugs against Mycobacterium tuberculosis /E.R. Driver, G.J. Ryan, D.R. Hoff etal. //Antimicrob Agents Chemother. – 2012. – Vol. 56. – P. 3181–3195.
- Ivanyi J, Ottenhoff TH. Significance of antigen and epitope specificity in tuberculosis. / J. Ivanyi, T.H. Ottenhoff // Front Immunol. – 2014. – Vol. 23(5). – P. 524.
- Lopez Y, Yero D, Falero-Diaz G, Olivares N, Sarmiento ME, Sifontes S, Solis RL, Barrios JA, Aguilar D, Hernandez- Pando R. Induction of a protective response with an IgA monoclonal antibody against Mycobacterium tuberculosis 16 kDa protein in a model of progressive pulmonary infection./ Y. Lopez, D. Yero, G. Falero-Diaz etal.//Int J Med Microbiol. - 2009. – Vol.299. – P. 447–452.
- Lu L.L., Chung A.W., Rosebrock T.R., Day C., Fortune S.M., Alter G. A Functional Role for Antibodies in Tuberculosis/ L.L.Lu, A.W.Chung, T.R. Rosebrock, etal. //Cell. - 2016. – Vol. – P. 433–443.
- Majorov KB, Eruslanov EB, Rubakova EI, Kondratieva TK, Apt AS. Analysis of cellular phenotypes that mediate genetic resistance to tuberculosis using a radiation bone marrow chimera approach./B. Majorov , E.B. Eruslanov , E.I. Rubakova //See comment in PubMed Commons belowInfect Immun. – 2005. – Vol.73(9). – P. 6174-6178.
- Pethe K., Bifani P., Drobecq H., Sergheraert C., Debrie A.-S., Locht C., and Menozzi F.D. Mycobacterial heparin-binding hemagglutinin and laminin-binding protein share antigenic methyllysines that confer resistance to proteolysis./ K. Pethe, P. Bifani, H. Drobecq etal. // – 2002. - Vol.99(16). – P. 10759–10764.
- Prados-Rosales R, Baena A, Martinez LR, Luque-Garcia J, Kalscheuer R, Veeraraghavan U, Camara C, Nosanchuk JD, Besra GS, Chen B, Jimenez J, Glatman-Freedman A, Jacobs WR Jr, Porcelli SA, Casadevall A. Mycobacteria release active membrane vesicles that modulate immune responses in a TLR2-dependent manner in mice./ Prados-Rosales, A. Baena, L.R. Martinez, etal. //J Clin Invest. – 2011. – Vol.121(4). – P. 1471-83.
- Sánchez A, Espinosa P, García T, Mancilla R. The 19 kDa Mycobacterium tuberculosis lipoprotein (LpqH) induces macrophage apoptosis through extrinsic and intrinsic pathways: a role for the mitochondrial apoptosis-inducing factor./ A. Sánchez , P. Espinosa , T. García // Clin Dev Immunol. 2012. - Vol. 2012:950503. doi: 10.1155/2012/950503.
- Steingart, K.R., Flores, L.L., Dendukuri, N., Schiller, I., Laal, S., Ramsay, A., Hopewell, P.C., and Pai, M. Commercial serological tests for the diagnosis of active pulmonary and extrapulmonary tuberculosis: an updated systematic review and meta-analysis./ K.R. Steingart, L.L. Flores, N. Dendukuri, //PLoS Med. - 2011. – Vol. 8(8):e1001062. doi: 10.1371/journal.pmed.1001062.
- Teitelbaum R., Glatman-Freedman A., Chen B., Robbins J. B., Unanue E., Casadevall A., AND Bloom B.R. A mAb recognizing a surface antigen of Mycobacterium tuberculosis enhances host survival./ R. Teitelbaum, A. Glatman-Freedman, B. Chen, etal. //Proc.Natl. Acad. Sci. USA. - 1998. – Vol. 95. – P.15688–15693.
- Zimmerli S, Edwards S, Ernst JD. Selective receptor blockade during phagocytosis does not alter the survival and growth of Mycobacterium tuberculosis in human macrophages./ Zimmerli, S. Edwards, J.D. Ernst //Am J Respir Cell Mol Biol. 1996. – Vol. 15(6). – P.760-770.
