Role of the [alkyl(aryl)sulfonyl]-triazole sulfonic acid fragment structure in the development of adaptations in Paramecium caudatum Ehrenberg
Role of the [alkyl(aryl)sulfonyl]-triazole sulfonic acid fragment structure in the development of adaptations in Paramecium caudatum Ehrenberg
Abstract
The toxicity of 1,2,4-triazole and 1,2,4-triazolid methane-benzene and p-toluenesulfonic acids to Paramecium caudatum Ehrenberg as well as the ability of infusoria to adapt to their toxicity were studied. The fact that the synthesized compounds differed significantly in toxicity, increasing with rise of concentration and time of exposure was eshtablished. Pre-cultivation of infusoria for 10 days in aqueous solutions of [alkyl(aryl)sulfonyl]-triazoles at a concentration of 0.0001 mg/ml was performed. Then, infusoria were transferred to solutions of the same substances at concentrations of 0.1 and 1 mg/ml, and their mortality was studied. It turned out that the structure of the triazolide sulfonic acid fragment influences the ability of infusoria to adapt. The best adaptation takes place with triazolid compounds that contain a methyl group.
1. Введение
Понимание механизмов, с помощью которых организмы адаптируются к быстрым изменениям окружающей среды вследствие антропогенного воздействия, стало одним из важных вопросов в биологии, потому что адаптации являются основой эволюции. В своей фундаментальной работе Хочачка и Сомеро рассмотрели биохимические механизмы, лежащие в основе адаптаций [1]. Они утверждают, что уровень обмена веществ, и в частности энергетического метаболизма, определяют адаптивные возможности организма. Усилия ученых последних десятилетий были направлены на поиск биохимических механизмов адаптаций [2, С.127]. Они предположили, что организмам проще мигрировать из зоны, содержащей ксенобиотики, чем перестроить метаболизм клеток. По этой причине только у неподвижных форм можно одновременно наблюдать разные формы биохимических приспособлений после воздействия ксенобиотиками [3, С. 35].
Между тем существует ряд исследований, показавших, что строение и концентрация антропогенного ксенобиотика играет немаловажную роль в способности организмов адаптироваться [4, С.108], [5, С. 76-78], [6, С. 121].
Одной из перспективных групп организмов-индикаторов, позволяющих быстро выявить адаптивную реакцию организмов, являются протисты, в частности, инфузории. Их высокая чувствительность к токсическому действию различных поллютантов позволяет обнаружить загрязнения на самых ранних стадиях и при незначительных концентрациях [7, С.13].
Поэтому для выяснения роли структурных фрагментов производных 1,2.4-триазола в развитии биологического ответа мы использовали Paramecium caudatum Ehrenberg. Для исследования выбраны производные алкил- и арилсульфокислот 1,2,4-триазола, а также исходный 1,2.4-триазол.
2. Материал и методы
Общая методика получения [алкил(арил)сульфонил]-триазолов (I-III).
В раствор 1,2,4–триазола в безводном растворителе (ТГФ) добавили эквимольное количество триэтиламина и при перемешивании внесли по каплям эквимольное количество раствора хлорангидрида соответствующей сульфокислоты в безводном растворителе. После перемешивания в течение 1 часа выпавший осадок гидрохлорида триэтиламмония отфильтровали, фильтрат упарили в вакууме. Получили масло, закристаллизовавшееся при охлаждении (0+5ºC). Продукт реакции очищали перекристаллизацией из бензола. Получили белое мелкокристаллическое вещество.
1-(Метилсульфонил)-1Н-1,2,4-триазол (I). Выход 61%, т.пл. 90–91°C, ИК спектр, n, см−1: 1366, 1138 (–SO2N), 1324 (CH3–S); Спектр ЯМР 1Н (400 МГц, ДМСО-d6, внутренний стандарт - ТМС), d, м.д.: 3.43 с (3H CH3), 8.13 с (1H, H5 Het), 8.69 с (1H, H3 Het).
4-(Фенилсульфонил)-4Н-1,2,4-триазол (II). Выход 64%, т.пл. 102–103°C, ИК спектр, n, см−1: 1328, 1155 (–SO2N); Спектр ЯМР 1Н (400 МГц, ДМСО-d6, внутренний стандарт - ТМС), d, м.д.: 7.54 м (2H, H3, H5), 7.63 м (1H, H4), 7.73 м (2H, H2, H6), 8.31 с (2H, Н2, H5 Het).
4-(Толилсульфонил)-4Н-1,2,4-триазол (III). выход 61%, т.пл. 98–99°C, ИК спектр, n, см−1: 1375, 1141 (–SO2N); Спектр ЯМР 1Н (400 МГц, ДМСО-d6, внутренний стандарт - ТМС), d, м.д.: 2.32 с (3H CH3), 7.32 м (2Н, H3, H5), 7.66 м (2H, H2, H6), 8.30 с (2H, Н2, H5 Het).
Объектом исследования служили инфузории Paramecium caudatum Ehrenberg из моноклональной линии, выделенной из проб, взятых в Саратовском водохранилище. Инфузории содержались в органической среде на основе дрожжевого отвара [8, С.207-212] по методике полунепрерывного культивирования с ежедневной заменой части среды [9].
Инфузории содержали при температуре +24 ºС. В качестве культиваторов использовали стеклянные плоскодонные колбы объемом 100 мл.
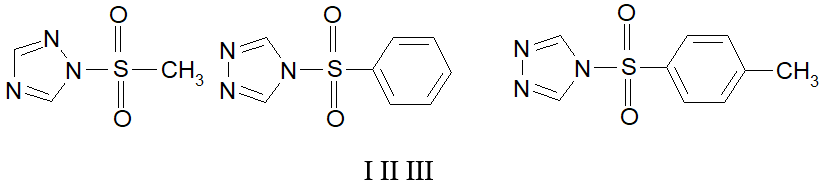
Рисунок 1 - Используемые растворы
Серия 1
С помощью микропипетки из культуры отбирали по 10 штук инфузорий и вносили в лунки планшета для исследования таким образом, чтобы для каждой концентрации синтезированного триазолида анализировали не менее 36 лунок. Объем среды в лунке доводили до 100 мкл путем добавления чистого раствора исследуемого вещества рабочей концентрации. Затем через 1 и 3 часа проводили подсчет погибших клеток. Каждый эксперимент проводили в трех повторах.
Серия 2
В течение 10 дней культура Paramecium caudatum Ehrenberg адаптировалась исследуемыми соединениями. Ежедневно сливали 1/3 объема культуры и доливали такое же количество питательной среды с исследуемым веществом в концентрации 0,001 мг/мл. Затем преадаптированных особей по 10 штук помещали в лунки планшета для исследований, чтобы для каждого вещества было проанализировано не менее 36 лунок.
Достоверность различий между опытом и контролем, действием различных веществ в разных концентрациях оценивали с помощью полного двухфакторного дисперсионного анализа [10]. Различия между выборками считались статистически значимыми при p≤0,05.
3. Результаты и обсуждения
Проведенные исследования показали, что токсический эффект исследуемых соединений носит дозозависимый характер, и смертность инфузорий возрастает с увеличением концентрации соединений и времени воздействия.
Проведённый статистический анализ показал, что соединения достоверно различаются по токсичности (p<0,05). С увеличением времени воздействия и концентрации веществ достоверно возрастает токсичность соединений, что выражается в повышении уровня смертности (таблица 1).
Таблица 1 - Гибель Paramecium caudatum Ehrenberg (%) при воздействиях 1,2,4-TriH и [алкил(арил)сульфонил]-триазолами (I-III)
Исследуемые концентрации (мг/мл) | 0,0001 | 0,001 | 0,01 | 0,1 | 1 | |||||
Время воздействия –(час) | 1 | 3 | 1 | 3 | 1 | 3 | 1 | 3 | 1 | 3 |
TriH | 0 | 0 | 4 | 6 | 72 | 77 | 84 | 86 | 95 | 95 |
I | 0 | 0 | 3 | 5 | 25 | 36 | 64 | 72 | 100 | 100 |
II | 0 | 0 | 2 | 3 | 18 | 22 | 49 | 52 | 100 | 100 |
III | 0 | 0 | 3 | 4 | 15 | 20 | 42 | 49 | 100 | 100 |
В концентрации 1 мг/мл синтезированные триазолиды вызывают 100% гибель инфузорий, в то время как 1,2,4-триазол вызывает смертность 95% особей. Обнаружили, что с увеличением молекулярной массы синтезированных триазолидов в концентрации 0,1 мг/мл их токсичность падает. В концентрации 0,0001 мг/мл все исследованные соединения оказались нетоксичными для инфузорий.
Результаты второй серии экспериментов представлены в таблице 2. Проведённый полный двухфакторный дисперсионный анализ показал, что предварительная преадаптация в течение 10 суток обнаруженной нетоксичной дозой достоверно (p<0,0001) снижает смертность инфузорий при последующем помещении их в токсичные концентрации – 0,1 и 1 мг/мл. Можно утверждать, что механизмы, используемые Paramecium caudatum Ehrenberg для адаптации, различны для анализируемых веществ. Наиболее сильно снижается смертность под действием соединений I и III, в структуру сульфокислоты которых входит метильная группа. Проведённый полный двухфакторный дисперсионный анализ показал, что предварительная преадаптация в течение 10 суток обнаруженной нетоксичной дозой достоверно (p<0,0001) снижает смертность инфузорий при последующем помещении их в токсичные концентрации – 0,1 и 1 мг/мл. Можно утверждать, что механизмы, используемые Paramecium caudatum Ehrenberg для адаптации, различны для анализируемых веществ.
Таблица 2 - Смертность инфузорий (в %) после преадаптирования культур 1,2,4-TriH и [алкил(арил)сульфонил]-триазолами (I-III) самих к себе нетоксичной дозой в течение 10 суток и последующим воздействии двумя токсичными дозами
Концентрации действующих веществ после преадаптации в течение 10 суток нетоксичной дозой | 0,1 мг/мл | 1 мг/мл | ||
Время ( в часах) воздействия действующей дозой | 1 | 3 | 1 | 3 |
TriH | 30 | 40 | 40 | 41 |
I | 19 | 20 | 21 | 25 |
II | 20 | 24 | 38 | 40 |
III | 10 | 11 | 15 | 16 |
Наиболее сильно снижается смертность под действием соединений I и III, в структуру сульфокислоты которых входит метильная группа.
Большинство ксенобиотиков, попав в организм, не оказывают прямого биологического эффекта и, подвергаясь биотрансформации, выделяются в виде метаболитов. Так как в процессе биотрансформации принимают участие ферменты, можно предположить, что для некоторых из них наличие метильных групп в структуре ксенобиотиков является фактором, индуцирующим их активность. Это совпадает с результатами исследований, полученными нами ранее при анализе возможности развития адаптивного ответа у Staphylococcus aureus [11 С. 27-29].
4. Заключение
1,2.4-Триазол и его производные [алкил(арил)сульфонил]-триазолы токсичны для Paramecium caudatum Ehrenberg в концентрациях от 0,001 до 1 мг/мл. С увеличением времени воздействия и концентрации их токсичность для инфузорий возрастает.
Преадаптация культур инфузорий в течение 10 дней нетоксичной дозой 0,0001мг/мл исследуемыми соединениями, приводит к развитию адаптивного ответа к высокотоксичным дозам, причём наиболее сильная адаптация развивается при преадаптации триазолидами, в структуру сульфокислоты которых входит метильная группа.
